Расчет теплоты сгорания веществ
Расчетные формулы. При расчетах теплового баланса на пожаре определяют, как правило, низшую теплоту сгорания (табл.2.1):
QB – QH=QИС (2.1),
где QB-высшая теплота сгорания; QH-низшая теплота сгорания;
QИС- теплота испарения воды, выделяющейся при сгорании вещества.
Таблица 2.1.
| Тип горючего вещества | Расчет теплоты сгорания | Размерность |
| Индивидуальное вещество |
Qн= 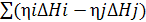 (2.2) (2.2)
| кДж/моль; |
| Вещества сложного Состава (формула Д.И.Менделеева) | Qн=339,4С+1257Н-108,9(О-S)-25,1(9H+W)(2.3) | кДж/кг |
| Смесь газов |
Qн= 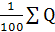 Hi∙φri (2.4) Hi∙φri (2.4)
| кДж/моль; кДж/м3 |
где  - соответственно теплоты образования одного кмоля i-го конечного продукта горения и
- соответственно теплоты образования одного кмоля i-го конечного продукта горения и 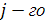 исходного вещества;
исходного вещества;
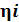 ,
, 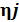 - соответственно количество кмолей
- соответственно количество кмолей 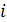 -гопродукта реакции и
-гопродукта реакции и 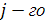 исходного вещества в уравнении реакции горения;
исходного вещества в уравнении реакции горения;
С, Н,S,W- соответственно содержание, %вес, углерода, серы, водорода, влаги в составе вещества;
О-сумма кислорода и азота ,%вес
QHi-низшая теплота сгорания 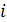 -го горючего компонента газовой смеси, кДж/моль; кДж/м3
-го горючего компонента газовой смеси, кДж/моль; кДж/м3
φri-содержание 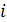 -го горючего компонента в газовой смеси ,% об.
-го горючего компонента в газовой смеси ,% об.
Расчет теплоты сгорания газовоздушных смесей проводят по формуле по формуле
Qсмн= 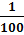 Qнφr (2.5),
Qнφr (2.5),
где Qсмн- теплота сгорания газовоздушной смеси, кДж/м3, кДж/м3
QH-низшая теплота сгорания горючего вещества, кДж/м3, кДж/м3
|
|
|
φri- концентрация горючего в смеси, % об.
Удельная скорость (интенсивность) тепловыделения при горении:
q=QH∙m (2.6)
q-удельная интенсивность тепловыделения,кВт/м3;
m-массовая скорость выгорания, кг/(м2∙с).
Скорость тепловыделения при горении:
Q= QH∙m (2.7),
где Q-интенсивность тепловыделения, кВт;
F-площадь горения, м3.
Примеры решения задач
Определить низшую теплоту сгорания уксусной кислоты, если теплота ее образования 485,6 кДж/моль;
Решение: Для расчета по формуле (2.2)запишем уравнение горения уксусной кислоты в кислороде:
СН3СООН+2О2=2СО2+2Н2О;
QH=(2∙396,9+2∙242,2-1∙485,6)=792,6 кДж/моль=792,6∙103 кДж/моль;
Для расчета количества тепла, выделяющегося при горении 1кг горючего, необходимо полученную величину разделить на его молекулярную масса (64):
QH=792,6∙103/64=12384кДж/кг.
Рассчитать низшую теплоту сгорания органической массы состава:
С-62%, Н-8%, О-28%, S-2%.
Решение: По формуле Д.И.Менделеева(2.3)
QH=339,4∙62+1257∙8-108,9(28-2)-
25,1∙9∙8=26460кДж/кг.
Определить низшую теплоту сгорания газовой смеси, состоящей из
|
|
|
СН4-40%, С4Н10-20%, О2-15%, Н2S-5%, NH3-10%, CO2-10%
Решение: Для каждого горючего компонента смеси по формуле (2.2) находим теплоты сгорания (табл.2.2)
Таблица 2.2
| Уравнение реакции | Теплота образования горючего, 103 кДж/моль; | Теплота сгорания, 10-3 кДж/моль; |
| СН4+2О2=СО2+2Н2О | 333,5 | QH=1∙396,9+2∙242,2-333,5 =547,8 |
| C4H10+5,6O2=4CO2+5H2O | 132,4 | QH=4∙396,9+5∙242,2-132,5 =2666,1 |
| H2S+1,5O2=H2O+SO2 | 201,1 | QH=242,2+297,5=201,1=338,6 |
| NH3+0,75O2=1,4H2O+0,5N2 | 46,1 | QH=1,5∙242,2-46,1=317,2 |
По формуле (2.4)определим теплоту сгорания газовой смеси:
QH=1/100∙(547.8∙40+2666,1∙20+338,6∙5+317,2∙10)103=1020∙103 кДж/кг.
Для определения теплоты сгорания 1м3газовой смеси необходимо полученное значение разделить на объем, занимаемый 1 Кмолем газа при стандартных условиях(24,4м3):
QH=1020∙10 3/24,4=41803 кДж/кг.
Рассчитать теплоту сгорания 1м3стехиометрической гексано-воздушной смеси.
Решение: Находим стехиометрический состав горючей смеси по уравнению реакции горения:
C6H14+9,5O2+9,5∙3,76N2=6CO2+7H2O=9,5∙3,76N
Весь объем вступивших в реакцию компонентов(1+9,5+9,5∙3,76) принимаем за 100%,а количество горючего(1кмоль)будет соответствовать стехиометрической концентрации:
Φст= 
Теплоту сгорания 1м3гексана определим по формуле (2.2) или по табл. Приложения 3.
|
|
|
QH= 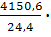 103=170,1
103=170,1  103 кДж/м3
103 кДж/м3
Теплоту сгорания 1м3стехиометрической гексано- воздушной смеси определим по формуле (2.5.):
QHсм=170,1∙103∙2,2/100=3742 кДж/м3
Определить интенсивность тепловыделения на пожаре органической массы (состав в примере 2), если скорость выгорания 0,015кг/(м2/с), а площадь пожара 150м2.
Решение: согласно формуле (2.7): QH=26460,0∙0,15∙150=59,5∙103кВт
Контрольные задачи
1. Определить низшую теплоту сгорания 1м3этана, пропана, пентана, гексана. Построить график зависимости от молекулярной массы горючего. Теплоты образования горючих веществ: этан-88,4кДж/моль, пропан-109,4 кДж/моль, бутан-132,4 кДж/моль, пентан-184,4 кДж/моль, гексан-211,2 кДж/моль.
2. Рассчитать теплоту сгорания 1м3ацетилено-воздушной смеси на нижнем и верхнем концентрационных пределах воспламенения, а так же при стехиометрической концентрации. КПВ ацетилена равна 2,0+81% Примечание: Построить график зависимости низшей теплоты сгорания от концентрации горючего в воздухе. При расчете теплоты сгорания смеси на ВКПВ необходимо учесть , что только часть горючего способна полностью окислиться в воздухе, остальное количество горючего не вступит в реакцию горения, вследствие недостатка окислителя.
|
|
|
3. Определить низшую теплоту сгорания 2кг древесины состава: С-49%, Н-8%, О-43%. Какова удельная интенсивность тепловыделения на пожаре, если массовая скорость выгорания составляет 0,01кг/(м2/с)?
4. Для условия предыдущей задачи определить изменения теплоты и удельной интенсивности тепловыделения при содержании влаги в древесине(сверх 100%)в количестве 3,5,10,15%. Скорость выгорания влажной древесины соответственно снизиться до 0,009; 0,008; 0,006; 0,005 кг/(м2/с). Построить график зависимости QH,q
от содержания влаги в горючем материале. Примечание:для решения задачи необходимо пересчитать состав древесины с учетом влаги таким образом, чтобы содержание всех компонентов равнялось100%.
5. Определить интенсивность тепловыделения кВт, при горении газовой смеси состава: СО-15%, С4Н8-40%, О2-20%, Н2-14%, СО2-11%., если скорость истечения 0,8м3/с.
Расчет температуры горения
Температура горения определяется из уравнения я теплового баланса:
QH=  рi∙Vпri(Tr-To) (2.8)
рi∙Vпri(Tr-To) (2.8)
При этом адиабатическая температура горения:
Тr*=Та + QH/  рi∙Vпri+CpB∆VB; (2.9)
рi∙Vпri+CpB∆VB; (2.9)
А действительная температура горения:
Тr=Та+ Qпr/  pi∙Vпri+ CpB∆VB;
pi∙Vпri+ CpB∆VB;
где, Тr* и Тr –соответственно адиабатическая и действительная температуры горения;
Т0 –начальная температура;
Сpi , CpB – соответственно теплоемкости воздуха и i-того продукта горения;
Vпri –объем i-го продукта горения;
∆VB –избыток воздуха;
QH –низшая теплота горения вещества;
Qпr –теплота , пошедшая на нагрев продуктов горения. При этом
Qпr= QH(1-𝛈), (2.11)
𝛈 –доля теплопотерь в результате излучения энергии, химического и механического недожога.
Расчет температуры горения по формуле (2.9) или (2.10)может быть проведен только методом последовательных приближений, поскольку теплоемкость газов зависит от температуры горения (табл.2.3.)
Таблица 2.3
| Определяемые параметры | Примечание | |
| 1 | Объем и состав продуктов горения | (§1.2) кмоль, м3 |
| 2 | Низшая теплота горения или количество тепла, пошедшего на нагрев продуктов горения (при наличии тепло потерь) | QпrQH кДж/моль, кДж/кг |
| 3 | Среднее значение энтальпии продуктов горения | ∆Нср= Qн(пr)/ 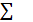 Vпri (2.12) Vпri (2.12)
|
| 4 | По средней энтальпии с помощью табл.1 ( если ∆Нср выражена к кДж/кмоль) или табл.2 ( если ∆Нср выражена к кДж/м3), ориентируясь на азот ( наибольшее содержание в продуктах горения), определяем приближенно температуру горения Т1( табл.1, 2) | |
| 5 | Рассчитываем теплосодержание продуктов горения с температурой, равной Т1(табл. 1, 2) | Qпr= 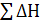 i∙Vi (2.13) i∙Vi (2.13)
|
| 6 | Сравниваем QпrcQн(пr), если Qпr<Qн(пr), то задается Т1>Т2( в этом случае, если Qпr>Qн(пr),то задается Т1<Т2) | ∆Нi–энтальпия итого продукта горения Vi-объем итого продукта горения |
| 7 | Рассчитываем Qпrпо формуле (2.13) | |
| 8 | Расчет проводим до получения неравенства вида Q1пr<Qн(пr),<Qн 2(пr), | |
| 9 | Интерполяцией определяем температуру горения | Тr=Т1+  .(2.14) .(2.14)
|
Действительная температура горения на пожаре для большинства газообразных, жидких и твердых веществ изменяется в достаточно узких пределах(1300+1800К).
В связи с этим расчет действительной температуры горения может быть значительно упрощен, если теплоемкость продуктов горения выбирать при температуре 1500К:
Тr=Т0+ 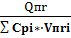 ; (2.15)
; (2.15)
где 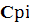 – теплоемкость i-го продукта горения при 1500К (табл. 2.4)
– теплоемкость i-го продукта горения при 1500К (табл. 2.4)
Таблица 2.4.
| Вещество | Теплоемкость | |
| кДж/(м3∙К) | кДж/(моль∙К) | |
| Двуокись углерода | 2.27 | 50,85∙10-3 |
| Двуокись серы | 2,28 | 51,07∙10-3 |
| Вода (пар) | 1,78 | 39,87∙10-3 |
| Азот | 1,42 | 31,81∙10-3 |
| Воздух | 1,44 | 32,26∙10-3 |
Примеры решения задач
Дата добавления: 2018-08-06; просмотров: 20102; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
