Определить объем теоретического количества воздуха, необходимого для горения 1кг бензола.
Решение: горючее – индивидуальное химическое соединение, поэтому для расчета по формуле (1.3.б) запишем уравнение химической реакции горения:
С2Н2+7,75O2+7,75∙3,76N2=6CO2+3H2O+7,75∙3,75N2 и найдем:
nО2=7,75; nN2=7,5∙3,76=28,2; nr=1,
Молекулярная масса бензола М=6∙12+6∙1=78 объем 1 кмоля газа при нормальных условиях составляет 22.4м3:
V0B=  м3/кг
м3/кг
Определить объем воздуха, необходимого для горения 1кг органической массы состава: С-60%, О-25%, N-5%, W-%(влажность), если коэффициент избытка воздуха 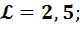 а температура воздуха 305К, давление 995ГПа.
а температура воздуха 305К, давление 995ГПа.
Решение: Так как горючее вещество сложного состава, то теоретическое количество воздуха при нормальных условиях определим по формуле (1.4):
V0B=0,269( 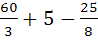 )=5,9 м3/кг
)=5,9 м3/кг
Из формулы (1.7) рассчитаем практическое количество воздуха при нормальных условиях:
V0B= 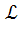 V0B=2,5∙5,9=14,75 м3/кг
V0B=2,5∙5,9=14,75 м3/кг
Находим количество воздуха, пошедшего на горение вещества при заданных условиях горения; используя формулу (1.6), получим:
VB(р,т)=  =16,8 м3/кг
=16,8 м3/кг
Определить объем воздуха, необходимого для горения 5м3смеси газов, состоящих из 20% СН4, 10% СО, 5%N, 35%О2, если коэффициент избытка воздуха равен 1,8.
Решение: Горючее – смесь газов. Поэтому для расчета объема воздуха, пошедшего на сгорание, воспользуемся формулой (1.5). Для определения стехиометрических коэффициентов при кислороде nо2 запишем уравнение реакции горения горючих компонентов в кислороде:
СН4+2О2=СО2+2Н2О;
|
|
|
С 2Н2+2,5О2=2СО2+Н2О; СО+0,5О2=СО2 тогда
V0B= 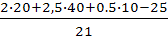 =5,7 м3/кг
=5,7 м3/кг
Для горения 5м3 газовой смеси необходимый теоретический объем воздуха составит: V0B=5∙5,7 =32,5 м3 Практическое количество воздуха : V0B=1,8∙32,5=58,5 м3.
Определите коэффициент избытка воздуха при горении уксусной кислоты, если на горение 1кг поступило 3 м3 воздуха.
Решение: Для определения коэффициента избытка воздуха по формуле (1.7) необходимо рассчитать его теоретическое количество. Молекулярная масса уксусной кислоты-60.
СН3СООН+2О2+2∙3,76N2=2СО2+2∙3,76 N2;
V0B= 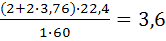 м3/кг
м3/кг
тогда коэффициент избытка воздуха равен:

Горение протекало при недостатке воздуха.
Определить объем воздуха, пошедшего на окисление 1м3 аммиака:
NН3+0,75О2 +0,75 3,76 N2=1,5Н2О+0,5N2+0,75∙3,76N2,
тогда
V0B= 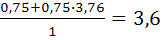 м3/кг
м3/кг
Для определения коэффициента избытка воздуха по формуле (1.10) необходимо рассчитать теоретическое количество продуктов горения 1м3аммиака (см. след параграф 1.2 формула (1.14)):
V0пр= 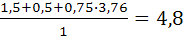 м3/кг
м3/кг
Определить объем окислительной среды, состоящей из 60%О2 и 40%N2,необходимый для горения 1 кг изопропилового спирта, если ее температура равна 295К, давление 620гПа.
Решение: так как окислительная среда отличается по составу от воздуха, определим по формуле (1.1) объемное соотношение кислорода и азота: 40:60+0,67
|
|
|
Уравнение реакции горения изопропилового спирта:
С3Н7ОН+4,5О2+4,5 0,67N2=3СО2+4Н2О+4,5⋅0,67 N2
Теоретический объем окислительной среды при нормальных условиях рассчитаем по формуле (1.3). Молекулярная масса горючего-60.
V0ос= 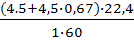 =2,8 м3/кг
=2,8 м3/кг
Объем окислительной среды при заданных условиях горения определим из формулы (1.6):
V0ос(рr)= 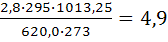 м3/кг
м3/кг
Определить сколько кг динитротолуола сгорело в герметичном объеме 100м3, если содержание кислорода в продуктах сгорания составило 12%.
Решение: Так как в продуктах горения содержится кислород, то горение протекало в избытке воздуха, коэффициент избытка которого определим по формуле (1.10). Для этого запишем уравнение горения:
С7Н6(NO2)2+6,5O2+6,5∙3,76N2=7CO2+3H2O+N2+6,5∙3,76N2
Молекулярная масса горючего-182.Теоретический объем воздуха равен:
V0B= 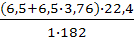 =3,8 м3/кг
=3,8 м3/кг
Теоретический объем продуктов горения (формула 1.14):
V0пr= 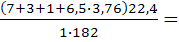 4,4 м3/кг
4,4 м3/кг

Практический объем воздуха, пошедший на горение:
VB= 2,55 ∙3.8=9,7 м3/кг
Тогда массу сгоревшего динитротолуола Р определим из соотношения:
Рr= 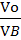 , Рr=
, Рr= 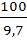 =10,3 кг
=10,3 кг
Контрольные задачи
1. Определить количество (теоретическое) воздуха, необходимое для горения 1кг: метилового, этилового, пропилового и амилового спиртов. Построить график зависимости объема воздуха от молекулярной массы спирта.
|
|
|
2. Определить теоретический объем воздуха, необходимого для горения 1м3: метана, этана, пропана, бутана и пентана. Построить график зависимости объема воздуха от положения вещества в гомологическом ряду (содержания углерода в молекуле вещества).
3. Определить теоретический объем воздуха, пошедший на горение 1кг: метана, метилового спирта. Объяснить причину влияния состава вещества на объем воздуха, требуемый для их горения.
4. Определить объем воздуха, пошедший на горение 1 кг древесины состава: С-47%, Н-8%, О-40%, W-5% если коэффициент избытка воздуха равен 2,8; давление 900ГПа, температура 285К.
5. Сколько воздуха поступило на горение 1кг углерода, если в продуктах горения содержание кислорода составило 17%?
6. Сколько воздуха требуется подать на сжигание 200м3 генераторного газа состава: СО-29%, Н2-14% , СН4-3%, СО2-6,5%, N2-45%, O2-2,5% если коэффициент избытка воздуха равен 2,5?
7. Определить количество сгоревшего толуола, кг. в помещении объемом 400м3,если после пожаре при отсутствии газообмене установлено, что содержание кислорода снизилось до 17%.
|
|
|
8. Сколько м3хлора поступило на горение 300м3 водорода, если в продуктах горения избыток окислителя составил80м3?
9. Определить избыток воздуха в продуктах горения газовой смеси состава: СО-15%, С4Н10-45%,О2-30%,N2-10% если коэффициент избытка равен 1,2 ;температура 265К; давление 850ГПа
10. Сколько м3 окислительной среды, состоящей из 50% кислорода, 50% азота, необходимо для горения 8кг этилацетата, если коэффициент избытка равен 1,2; температура 265К; давление 850 ГПа.
11. Определить коэффициент избытка окислительной среды, состоящей из 70% кислорода и 30% азота, если при горении серы содержание кислорода снизилось до 55%. Определить количество сгоревшей серы, кг , если объем помещения равен 180м3.
12. Сколько антрацита (принять, что содержание углерода равно 100%) сгорело в помещении объемом 150м3, если прекращение горения наступило при снижении кислорода до 13%, газообмен не учитывать
Домашнее задание 1
Рассчитать объем окислительной среды, м3, необходимый для горения i-того горючего вещества (таблица 1.2.).
Таблица 1.2
| № Вари-анта | Горючее вещество | Химическая формула | Количество горючего вещества | Состав окислительной среды | Условия горения |
| 1 | Метиловый спирт | СН4О | 2кг | воздух | Т=1013ГПа
Р=300К
 =3 =3
|
| 2 | Анилин | С6Н7N | 1 кг | Кислород70% Азот30% | Т=290
Р=900
 =2,5 =2,5
|
| 3 | Смесь газов | СО-45% N2-15% C4H8-10% O2-30% | 1м3 | Воздух | Нормальные
 =2,5 =2,5
|
| 4 | Нитробензол | С6Н5NO2 | 30кг | Воздух | Т=280
Р=950
 =2,5 =2,5
|
| 5 | Сложное вещество | С=65% О=20% Н=5% S=10% | 1 кг | Воздух |  =1,4
Нормальные =1,4
Нормальные
|
| 6 | Этилен | С 2Н4 | 5 м3 | Кислород % Азот% | Нормальные
 =2,5 =2,5
|
| 7 | Сера | S | 2 кг | Кислород % Азот% | Т=300
Р=1200
 =1,8 =1,8
|
| 8 | Сложное вещество | С -90% Н-3% N-5% O-2% | 1 кг | Воздух | Т=300
Р=950
 =1,5 =1,5
|
| 9 | Смесь газов | СН4-15% С3Н8-70% О2-10% Н2-5% | 5 м3 | Воздух | Нормальные
 =1,9 =1,9
|
| 10 | Алюминий | Аl | 15 кг | Кислород42 % Азот58% | Нормальные
 =2,8 =2,8
|
| 11 | Сплав | Мg-20% Al-80% | 1 кг | Воздух | Т=265
Р=920
 =1,5 =1,5
|
| 12 | Муравьиная кислота | СН2О2 | 1 кг | Воздух | Нормальные
 =1,2 =1,2
|
| 13 | Диметиловый эфир | (СН3)2О | 10 кг | Воздух | Т=283
Р=1016
 =4,2 =4,2
|
| 14 | Смесь газов | Н2S-25% SO2-15% CO2-15% H2-30% O2-15% | 15 м3 | Воздух | Нормальные
 =1,4 =1,4
|
| 15 | Сложное вещество | С-82% Н-8% W-10% | 1 кг | Воздух | Т=260
Р=1100
 =1,4 =1,4
|
| 16 | Глицерин | С3Н8О3 | 1 кг | Воздух | Т=305
Р=1013
 =1,9 =1,9
|
| 17 | Ацетилен | С2Н2 | 1 м3 | Хлор 18 % Азот82% | Нормальные
 =1,9 =1,9
|
| 18 | Смесь газов | СН4-30% O2-8% N2-15% Н2-47% | 1 м3 | Воздух | Нормальные
 =3,2 =3,2
|
| 19 | Этиловый эфир уксусной к-ты | С4Н8О2 | 1 кг | Воздух | Т=270
Р=850
 =1,5 =1,5
|
| 20 | Метилэтил- кетон | С4Н8О | 5 кг | Воздух | Нормальные
 =2,5 =2,5
|
| 21 | Хлорбензол | С6Н5Cl | 1 кг | Воздух | Т=305
Р=1000
 =2,8 =2,8
|
| 22 | Нитротолуол | С7Н7NO2 | 1 кг | Кислород25 % Азот75% | Т=280
Р=980
 =1,4 =1,4
|
Домашнее задание 2:
Сколько воздуха требуется подать на сжигание n-го объема (м3) генераторного газа при нормальных условиях.
Таблица 1.3
| № Вар- та | n-й объем генераторного газа | Коэф-фициент избытка воздуха | СО% | Н2-% | N% | O2% | CH4% | СО2% |
| 1 | 200 | 2,5 | 29 | 14 | 45 | 2,5 | 3 | 6.5 |
| 2 | 500 | 3,2 | 14 | 29 | 45 | 3 | 2,5 | 6,5 |
| 3 | 450 | 1,8 | 10 | 30 | 50 | 2 | 2 | 6 |
| 4 | 368 | 1,7 | 25 | 35 | 20 | 5 | 5 | 10 |
| 5 | 400 | 1,9 | 20 | 45 | 25 | 5 | 2 | 3 |
| 6 | 800 | 1,5 | 12,5 | 35 | 12,5 | 12 | 8 | 10 |
| 7 | 1000 | 2,3 | 10 | 30 | 50 | 2 | 2 | 6 |
| 8 | 900 | 2,5 | 15 | 28 | 45 | 3 | 2,5 | 6,5 |
| 91 | 890 | 2.6 | 27 | 16 | 45 | 2,5 | 3 | 6.5 |
| 10 | 530 | 3.0 | 12,5 | 34,5 | 12,5 | 13 | 8 | 10 |
| 11 | 456 | 3,1 | 29 | 14 | 43 | 2,5 | 5 | 6.5 |
| 12 | 450 | 3,3 | 14 | 29 | 45 | 3 | 2,5 | 6,7 |
| 13 | 470 | 3,5 | 27 | 14 | 47 | 2,5 | 3 | 6.5 |
| 14 | 760 | 2,4 | 29 | 14 | 45 | 2,5 | 3 | 6.5 |
| 15 | 267 | 5,0 | 29 | 14,5 | 44 | 2,5 | 3,5 | 6.5 |
| 16 | 400 | 2,0 | 10,5 | 32,5 | 50 | 2 | 2 | 6 |
| 17 | 580 | 2,1 | 25 | 35 | 20 | 5 | 5 | 10 |
| 18 | 230 | 2.2 | 28 | 47 | 24,5 | 5,5 | 2,5 | 2,5 |
| 19 | 150 | 2.3 | 25 | 16 | 47 | 2,5 | 3 | 6.5 |
| 20 | 180 | 2.4 | 29 | 46 | 24,5 | 5,5 | 2 | 3 |
| 21 | 280 | 2,3 | 20 | 14 | 70 | 4,5 | 3,7 | 6.8 |
| 22 | 270 | 1,9 | 20 | 45 | 25 | 5 | 2 | 3 |
Дата добавления: 2018-08-06; просмотров: 7483; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
