Ковалентная связь. Виды ковалентной связи. Электроотрицательность химических элементов.
Различают три основных типа химических связей: ковалентную, ионную и металлическую.
| Ковалентная связь | |
| неполярная | полярная |
| Н2, F2, O2, N2 | HCl, H2O |
| между атомами неметаллов с одинаковой электроотрицательностью | между атомами неметаллов с разной электроотрицательностью |
Рассмотрим образование молекулы Н2 как один из простейших случаев химической связи.
| 1S1 |
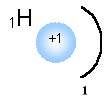

При образовании химической связи происходит взаимное перекрывание электронных облаков.
Химическая связь, образованная посредством общих электронных пар, называется ковалентной связью.

Если между атомами возникла одна ковалентная связь (одна общая электронная пара), то она называется одинарной, если больше, то кратной: двойной (две общие электронные пары), тройной (три общие электронные пары).
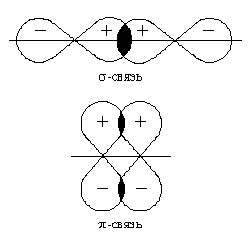
Электронная пара может обозначать перекрывание s-s-, s-р- или р-р- электронных облаков:

Если электронные облака перекрываются по линии, соединяющей центры 2-х атомов, то такая связь называется δ- связью.
Если р-электронные облака перекрываются по обе стороны от линии, соединяющей ядра атомов, такая связь называется π-связью:
До сих пор мы рассматривали образование ковалентной связи между атомами с одинаковой ЭО. В этом случае связывающие электронные пары располагаются симметрично между ядрами соединяющихся атомов.
|
|
|
Ковалентную химическую связь, которая образуется между атомами с одинаковой ЭО за счет образования общих электронных пар, называют ковалентной неполярной связью.
Но многие молекулы состоят из атомов, ЭО которых незначительно отличаются.
В этом случае общая электронная пара смещается в сторону более ЭО элемента, например:


РЯД ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ:
Н → С → S → Br → Cl → N → O → F
Химическую связь, образованную атомами, ЭО которых отличается, но незначительно, называют ковалентной полярной связью.
Электроны, участвующие в образовании химической связи, называют валентными электронами.
Величина валентности определяется числом связей, образованных атомом.
Ионная связь, ее образование. Заряды ионов.
В Периодической системе Д.И.Менделеева особняком стоят благородные газы. Атомы благородных газов имеют завершенный внешний электронный слой, на котором у атома гелия находится два электрона, а у атомов остальных элементов - по восемь.
Атомы всех других химических элементов стремятся приобрести именно такую устойчивую электронную конфигурацию и достигают этого либо в результате присоединения электронов от других атомов, либо в результате отдачи своих электронов с внешнего уровня другим атомом.
|
|
|
Если различие в ЭО элементов достаточно велико, то может произойти не просто смещение электронов в сторону более ЭО элемента, а полная передача электронов от одного атома к другому. Например, при возникновении химической связи между атомами Na и Cl валентный электрон натрия переходит на внешний электронный слой хлор, достраивая его до восьмиэлектронной структуры.
| -1ē |
| 7 |

Na0 + Cl0 Na+ + Cl- Na+ Cl- .
атом атом ион ион ионное соединение
Ионы- это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
Атомы, которые почти полностью отдают свои валентные электроны, превращаются в положительно заряженные ионы (катионы), а атомы, которые эти электроны приобретают, - в отрицательно заряженные ионы (анионы).
| Na+ + Cl- NaCl |
Cl0 + 1 ē → Cl-
Разноименно заряженные ионы, притягиваясь друг к другу силой электростатического притяжения, образуют соединение - NaCl.
|
|
|
Химическая связь, возникающая между катионами и анионами в результате действия электростатических сил притяжения, называется ионной связью.
Соединения, которые при этом образуются, называются ионными соединениями.
Соединения с ионным типом химической связи образуются в том случае, когда взаимодействуют атомы элементов с резко различной ЭО - типичного Ме (щелочными и щелочноземельными) и типичного НеМе (галогенами, кислородом). Классическим примером веществ с ионной связью являются галогениды и оксиды щелочных металлов.
Ионные соединения - это не только бинарные соединения щелочных и щелочноземельных металлов. Это также соединения, образованные тремя и более элементами. Это все соли кислородсодержащих кислот, а также гидроксиды щелочных и щелочноземельных металлов.
Классификация ионов по разным признакам:
По составу
простые сложные
Na+, Cl-, Ca2+ OH-, SO42-, NH4+
По знаку заряда
катионы анионы
Ме+, NH4+, H+ OH-, анионы кислотных остатков
|
|
|
Дата добавления: 2018-05-13; просмотров: 1903; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
