Реакция с гидрохлоридом гидроксиламина.
В три пробирки наливают по 2 мл 3% раствора гидрохлоридагидроксиламина, добавляют в каждую по капле индикатора метилового оранжевого. Наливаютв одну около 1 мл формалина, в другую – ацетона, третью оставляют для сравнения. Нагревают пробирки на водяной бане. Наблюдается отчетливое покраснение индикатора. (Сравнивают окраску раствора в пробирках с окраской метилового оранжевого в 3% растворе гидрохлорида гидроксиламина.)
Вопросы и задания1. Запишите наблюдения. Сравните реакционную способность альдегида и кетона.
2. Составьте уравнения реакций.
Реакция с реактивом Толленса (реакция серебряного зеркала).
В очень чистой пробирке смешивают 1 мл 10% раствора нитрата серебра и 1 мл 2 н раствора гидроксида натрия. В смесь по каплям вносят 25% раствор аммиака до растворения выпавшего осадка гидроксида серебра. Для того чтобы реагент был более чувствителен, необходимо избегать большого избытка аммиака. Реактив должен быть приготовлен непосредственно перед употреблением. Его не следует хранить, так как при стоянии раствор в результате разложения образует весьма взрывчатый осадок.
В полученный реактив добавляют несколько капель формалина и осторожно нагревают на водяной бане. Наблюдается выделение серебра на стенках пробирки.Повторите опыт с раствором глюкозы.
Вопросы и задания1. Запишите наблюдения.
2. Составьте уравнения реакций.
|
|
|
Реакция с реактивом Фелинга.
Приготавливают в пробирке реактив Фелинга, сливая по 1 мл исходных растворов(реактив Фелинга1 и реактив Фелинга2). К 2 мл готового реактива Фелингадобавляют 2-3 капли формалина и нагревают на водяной бане. Повторяют опыт с раствором глюкозы.
Вопросы и задания1. Запишите наблюдения.
2. Составьте уравнения реакций.
Опыт 4. Качественные реакции карбоновых кислот
Карбоновые кислоты – органические соединения, содержащие в молекуле карбоксильную группу –СООН, связанную с углеводородным радикалом.
В зависимости от числа карбоксильных групп карбоновые кислоты делятся на одноосновные (монокарбоновые) и многоосновные (дикарбоновые, трикарбоновые и т.д.).
В зависимости от характера и строения углеводородного радикала различают алифатические кислоты (пропановая, акриловая кислоты) и ароматические (бензойная кислота).
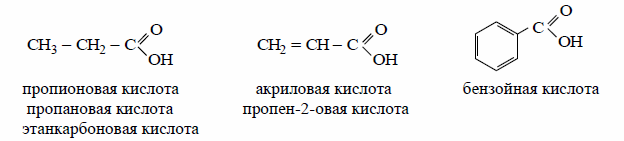
К важнейшим производным карбоновых кислот относятся соли (ацетат натрия, формиат калия), сложные эфиры (метилацетат и изопропилацетат) а также галогенангидриды, ангидриды и амиды карбоновых кислот.

Галогенангидридами карбоновых кислот называют продукт замещения гидроксильной группы кислоты на атом галогена (бромангидрид уксусной кислоты).
|
|
|
Ангидриды карбоновых кислот могут рассматриваться как продукт дегидратации двух молекул кислоты (ангидрид уксусной кислоты).
Амиды кислот – продукт замещения гидроксильной группы кислоты на аминогруппу (или замещенную аминогруппу).

Систематические названия карбоновых кислот составляют из названия главной углеродной цепи молекулы, суффикса –овая и слова кислота. Для многоосновных кислот используются суффиксы –диовая, - триовая и т.д. Названия солей и эфиров кислот производят обычно от латинских названий кислот, а по международной номенклатуре – от названий углеводородов, добавляя окончание –оат:
Химические свойства карбоновых кислот определяются прежде всего электронным строением карбоксильной группы, специфическим распределением в ней электронной плотности в сторону карбонильного кислорода, в результате чего значительно ослабляется связь О – Н в гидроксиле и облегчается отрыв протона, т.е. проявляется повышенная кислотность по сравнению со спиртами.
В водном растворе карбоновые кислоты диссоциируют. Однако большинство их является слабыми электролитами, имеющими степень диссоциации α < 1. ЗначениярКа(рКа= - lgКа) для одноосновных карбоновых кислот находятся в интервале 3,7 – 6,0.
|
|
|
Введение в молекулу карбоновой кислоты любой электроноакцепторной группы (обладающей отрицательным индуктивным или мезомерным эффектами) смещающей электронную плотность на себя, увеличивает частичный положительный заряд δ+ на углероде карбоксильной группы и тем самым усиливает все сдвиги электронной плотности между атомами, ослабляя связь О – Н, тем самым повышая кислотность молекулы. Как результат, значение рКа понижается.
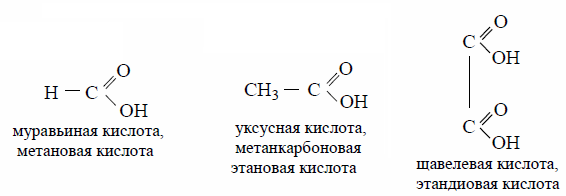
Введение электронодонорной группы, в том числе углеводородного радикала, (обладающего +I эффектом) ослабляет все сдвиги электронной плотности в карбоксильной группе, повышая прочность связи О – Н, а значит понижая кислотность молекулы. Поэтому в гомологическом ряду одноосновных карбоновых кислот наиболее сильной является первая кислота – муравьиная, значение рКа = 3,75. Для уксусной кислоты рКа = 4,76, для пропионовой кислоты рКа = 4,89.
При взаимодействии карбоновых кислот с металлами, гидроксидами, карбонатами металлов, аммиаком, аминами образуются соли, подтверждая кислотный характер карбоновых кислот. Со спиртами карбоновые кислоты образуют сложные эфиры.
К действию окислителей одноосновные карбоновые кислоты устойчивы. Исключение составляет муравьиная кислота и кислоты с третичным атомом углерода в α-положени.
Дата добавления: 2018-05-12; просмотров: 926; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
