Коливально-обертальні спектри молекул
Енергія коливального руху молекул більша за енергію їхнього обертання, тому одночасно з коливанням можуть збуджуються й обертальні стани молекул. Переходи між цими станами призводять до появи коливально-обертальних спектрів молекул. Розглянемо спочатку випадок малих збуджень, коли ангармонізмом і відцентровим спотворенням форми молекул можна знехтувати. У цьому випадку коливання й обертання молекул відбуваються незалежно одне від одного, і їхня енергія є адитивною сумою коливальної та обертальної енергій
 , (19.25)
, (19.25)
де  . Між цими термами можуть мати місце переходи дозволені такими правилами відбору для вібронного й ротаційного квантових чисел
. Між цими термами можуть мати місце переходи дозволені такими правилами відбору для вібронного й ротаційного квантових чисел  ( наближення гармонічного осцилятора) та
( наближення гармонічного осцилятора) та  . При кімнатній температурі лише незначна кількість молекул знаходиться в збудженому стані й тому найбільш інтенсивними, здебільшого, будуть лінії, що виникають при переходах між станами із квантовими числами
. При кімнатній температурі лише незначна кількість молекул знаходиться в збудженому стані й тому найбільш інтенсивними, здебільшого, будуть лінії, що виникають при переходах між станами із квантовими числами  і
і  . У спектрах поглинання спостерігаються дві гілки ліній: одна - при виконанні правила відбору
. У спектрах поглинання спостерігаються дві гілки ліній: одна - при виконанні правила відбору  , яка називається
, яка називається  – гілкою, і друга - при
– гілкою, і друга - при  , яка називається
, яка називається  - гілкою.
- гілкою.
На рис.19.11 зображені терми двоатомної молекули з обертальними квантовими числами  для двох коливальних станів нульового не збудженого з квантовим числом
для двох коливальних станів нульового не збудженого з квантовим числом  і
і  , а також спектральні лінії спектра поглинання для
, а також спектральні лінії спектра поглинання для  - і
- і  - гілок.
- гілок.
Запишемо співвідношення для частот (енергій квантів)  - та
- та 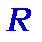 - гілок спектра, вважаючи, в станах з різними вібронними числами момент інерції залишається незмінним
- гілок спектра, вважаючи, в станах з різними вібронними числами момент інерції залишається незмінним 
|
|
|
 (19.26)
(19.26)
 (19.27)
(19.27)
|
Рис.19.11. P- і R- гілки коливально-обертального спектра двохатомної молекули. |
де  .
.
Частоти окремих ліній для обох гілок коливально-обертальних спектрів можна знайти графічно, як це показано на рис.19.12. Гілка
 утворюється, тому що частина енергії витрачається на збудження обертальних рухів молекули, і її частоти менші частоти власних коливань молекули. R- гілка утворюється, тому що частина енергії обертальних рухів молекули передається її коливному рухові, і її частоти більші частоти власних коливань молекули. Лінія
утворюється, тому що частина енергії витрачається на збудження обертальних рухів молекули, і її частоти менші частоти власних коливань молекули. R- гілка утворюється, тому що частина енергії обертальних рухів молекули передається її коливному рухові, і її частоти більші частоти власних коливань молекули. Лінія  не утворюється, тому що переходи заборонені у двоатомних молекулах правилом відбору
не утворюється, тому що переходи заборонені у двоатомних молекулах правилом відбору  . Частоти лінійно залежать від квантового числа
. Частоти лінійно залежать від квантового числа  . Нахил прямих ліній на рис.19.12 дозволяє визначати момент інерції молекул
. Нахил прямих ліній на рис.19.12 дозволяє визначати момент інерції молекул  . Таким чином момент інерції молекули можна визначити не тільки в міліметровій і далекій інфрачервоній області спектра, як це мало місце при використанні обертальних спектрів, але й у середньому та близькому інфрачервоному діапазоні за допомогою обертально-коливальних спектрів, що значно полегшує вимірювання.
. Таким чином момент інерції молекули можна визначити не тільки в міліметровій і далекій інфрачервоній області спектра, як це мало місце при використанні обертальних спектрів, але й у середньому та близькому інфрачервоному діапазоні за допомогою обертально-коливальних спектрів, що значно полегшує вимірювання.
|
|
|
|
Рис.19.12. Схема утворення гілок обертально-коливальних спектрів, коли |
При збільшенні рівня збудження спостерігаються відхилення від лінійних залежностей частот від квантових чисел для  - і
- і  - гілок. Вони викликаються двома обставинами: відцентровою зміною
- гілок. Вони викликаються двома обставинами: відцентровою зміною
моменту інерції молекул і ангармонізмом. Спочатку розглянемо вплив відцентрової зміни моменту інерції. Внаслідок цього впливу стала обертання В починає залежати від інтенсивності збудження й в різних коливних станах сталі В уже різні , тобто  , де
, де  і
і  - сталі обертання в двох коливних станах, між якими відбувається перехід.
- сталі обертання в двох коливних станах, між якими відбувається перехід.
 (19.28)
(19.28)
 (19.29)
(19.29)
Із формул (19.28) і (19.29) видно, що частоти ліній (енергії квантів) у Р- і R- гілках нелінійно залежать від квантового числа  : у
: у  - гілці вони збігаються і утворюється „кант”, а в
- гілці вони збігаються і утворюється „кант”, а в  - гілці розходяться, коли
- гілці розходяться, коли  , а коли
, а коли  , то навпаки у
, то навпаки у  – гілці вони розходяться, в
– гілці вони розходяться, в  – гілці збігаються і утворюється „кант” (як на рис.19.13.А і Б).
– гілці збігаються і утворюється „кант” (як на рис.19.13.А і Б).
|
Рис.19.13. Схема P-,R-,Q- гілок обертально-коливальних спектрів: А) |
Додаткове врахування ангармонізму ще більшускладнює обертально-коливальні спектри молекул, саме:
1. змінюються частоти коливань:

2. з’являються нові переходи, бо необхідно враховувати додаткові правила відбору  ;
;
|
|
|
3. з’являється нове правило відбору  , внаслідок чого з’являється нова Q-гілка спектру, для якої
, внаслідок чого з’являється нова Q-гілка спектру, для якої
 (19.30)
(19.30)
Вигляд спектра можна отримати графічно за допомогою рис.19.13. У ньому відсутня лінія коливань із частотою  .
.
Інтенсивність ліній коливально-обертального спектра залежить від температури (рис.19.14). Вона подібна до температурної залежності обертального спектра, яка розглядалась у §19.2 і наведена на рис.19.3.
| Рис.19.15. Коливально-обертальний спектр |
|
Рис.19.14. Залежність інтенсивності ліній коливально-обертального спектра від частоти при двох температурах. |
Для R -, Q - гілок вона збільшується зі зростанням температури, а для Р - гілки - зменшується, бо збільшується відносна кількість збуджених молекул, які можуть використати енергію збудження на коливально-обертальний рух. Крім того збільшення температури зсуває максимум розподілу в бік більших і менших частот для Р – і R – гілок відповідно. На рис.19.15 для прикладу наведено ділянку коливально обертального спектра для НСl.
Електронні стани
Енергія збуджень електронних станів молекул більша енергії збудження її коливальних і обертальних станів 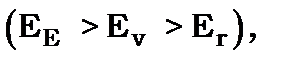 тому разом з електронними станами збуджуються й коливально-обертальні стани. Спектри молекул стають значно складнішими атомних. У більшості молекул можна виділити напрямок, уздовж якого направлені молекулярні зв’язки. Наприклад, у двоатомній молекулі він збігається з лінією, що з’єднує центри атомних ядер. Цей напрямок використовують, щоб визначати відносно нього проекції моментів кількості руху:
тому разом з електронними станами збуджуються й коливально-обертальні стани. Спектри молекул стають значно складнішими атомних. У більшості молекул можна виділити напрямок, уздовж якого направлені молекулярні зв’язки. Наприклад, у двоатомній молекулі він збігається з лінією, що з’єднує центри атомних ядер. Цей напрямок використовують, щоб визначати відносно нього проекції моментів кількості руху:
|
|
|
 (19.31)
(19.31)
де  - квантове число. Кожному значенню числа
- квантове число. Кожному значенню числа  відповідає стан, який за аналогією до атомної спектроскопії має свою назву (див. Таблицю 19.1)
відповідає стан, який за аналогією до атомної спектроскопії має свою назву (див. Таблицю 19.1)
| Таблиця 19.1.Стани з різним квантовими числами l | ||||

| 0 | 1 | 3 | 4 |
| стан | 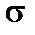
| 
| 
| 
|
Повний кутовий момент кількості руху визначається новим квантовим числом  . Його стани позначаються так, як показано в таблиці 19.2.
. Його стани позначаються так, як показано в таблиці 19.2.
| Таблиця 19.2. Стани з різними L, яке визначає сумарний орбітальний момент кількості руху молекули | ||||

| 0 | 1 | 2 | 3 |
| Стан | 
| 
| 
| 
|
Наприклад, стан 2-х електронів з  - зв’язком відповідає квантовому числу
- зв’язком відповідає квантовому числу  , тобто відповідає
, тобто відповідає  стану. Для 2-х електронів із квантовими числами
стану. Для 2-х електронів із квантовими числами  і
і  число
число  має 2 значення:
має 2 значення: 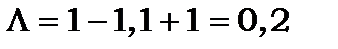 , тобто існують
, тобто існують  та
та  стани. Всі електронні рівні з відмінним від нуля квантовим числом
стани. Всі електронні рівні з відмінним від нуля квантовим числом  двічі вироджені ,поскільки енергія рівня не залежить від знака проекції орбітального момента на вісь молекули.
двічі вироджені ,поскільки енергія рівня не залежить від знака проекції орбітального момента на вісь молекули.
Повний спін молекули визначається, як і в атомі, сумарним спіновим числом  .
.  - визначає мультиплетність рівня.
- визначає мультиплетність рівня.
Проекції сумарного спіну визначаються квантовим числом 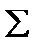 , а проекції повного електронного моменту відносно осі молекули - квантовим числом
, а проекції повного електронного моменту відносно осі молекули - квантовим числом  , де
, де
 (19.32)
(19.32)
Наприклад, у  - стані
- стані  ,
,  ,тобто для триплетного терму існує 3 значення
,тобто для триплетного терму існує 3 значення 
 .
.
Цім значенням  відповідає три терми:
відповідає три терми:  .
.
Для синглетного терму:


Таким чином, молекулярна спектроскопія, як і атомна, використовує аналогічну символіку для термів  йтакі правила відбору:
йтакі правила відбору:

 (19.33)
(19.33)
 .
.
Через велику різницю в масах між ядерним остовом і електроном, що збуджується, електронні переходи відбуваються в молекулі так швидко, що за час переходу положення ядер не змінюється 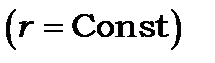 . На енергетичній діаграмі
. На енергетичній діаграмі  ці переходи зображаються вертикальними лініями. Це твердження називається принципом Франка-Кондона.
ці переходи зображаються вертикальними лініями. Це твердження називається принципом Франка-Кондона.
Електронні переходи мають значну енергію збудження  що може змінювати електронну конфігурацію, внаслідок чого з’являється дипольний момент навіть у оптично не активної молекули. Криві залежностей молекулярної енергії від відстані між її атомами в основному й збудженому електронних станах можуть бути зміщені, що відповідає сильно стиснутому або розтягнутому станам збудженої молекули (рис.19.17 і 19.18). Молекула після такого електронного переходу негайно починає коливатись. Тому при електронних переходах навіть оптично неактивні молекули мають складні електронно-коливально-обертальні спектри. Спектр кожного електронного переходу супроводжується системою коливальних супутників, які у свою чергу супроводжується обертальними супутниками. При цьому в електронному спектрі з’являються
що може змінювати електронну конфігурацію, внаслідок чого з’являється дипольний момент навіть у оптично не активної молекули. Криві залежностей молекулярної енергії від відстані між її атомами в основному й збудженому електронних станах можуть бути зміщені, що відповідає сильно стиснутому або розтягнутому станам збудженої молекули (рис.19.17 і 19.18). Молекула після такого електронного переходу негайно починає коливатись. Тому при електронних переходах навіть оптично неактивні молекули мають складні електронно-коливально-обертальні спектри. Спектр кожного електронного переходу супроводжується системою коливальних супутників, які у свою чергу супроводжується обертальними супутниками. При цьому в електронному спектрі з’являються  -,
-,  - та
- та  - гілки коливально-обертального спектра, частоти яких у випадку нехтування ангармонізмом визначатимуться за формулами:
- гілки коливально-обертального спектра, частоти яких у випадку нехтування ангармонізмом визначатимуться за формулами:

 ...
...

 ….
….

 (19.34)
(19.34)
де  і
і  сталі молекули в збудженому й не збудженому станах. Із цих формул видно, що в спектрі відсутня лінія із частотою
сталі молекули в збудженому й не збудженому станах. Із цих формул видно, що в спектрі відсутня лінія із частотою 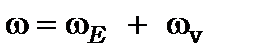 , але в ньому з’являється багато “червоних” (
, але в ньому з’являється багато “червоних” (  -гілка) і “синіх” (
-гілка) і “синіх” (  - та
- та  - гілки) ліній електронно-коливально-обертального молекулярного спектру. Звичайно, що при електронних збудженнях треба буде враховувати й ангармонізм, завдяки якому зміняться частоти коливального спектра (див. формули (19.24)) і з’являться обертони коливальних спектральних ліній, бо при значних збудженнях виникають нові правила відбору:
- гілки) ліній електронно-коливально-обертального молекулярного спектру. Звичайно, що при електронних збудженнях треба буде враховувати й ангармонізм, завдяки якому зміняться частоти коливального спектра (див. формули (19.24)) і з’являться обертони коливальних спектральних ліній, бо при значних збудженнях виникають нові правила відбору:  .Ці обставини ще більше ускладнять вигляд електронно-коливально-обертального молекулярного спектра.
.Ці обставини ще більше ускладнять вигляд електронно-коливально-обертального молекулярного спектра.
Дата добавления: 2018-05-09; просмотров: 743; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!



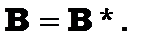

 , Б)
, Б)  .
.

