Белки как полимеры. Свойства и биологические функции белков
Белки – это биополимеры, состоящие из остатков α-аминокислот, соединённых между собой пептидными связями (-CO-NH-). Белки входят в состав клеток и тканей всех живых организмов. В молекулы белков входит 20 остатков различных аминокислот.
Структура белка
Белки обладают неисчерпаемым разнообразием структур.
Первичная структура белка – это последовательность аминокислотных звеньев в линейной полипептидной цепи.
Вторичная структура – это пространственная конфигурация белковой молекулы, напоминающая спираль, которая образуется в результате скручивания полипептидной цепи за счёт водородных связей между группами: CO и NH.
Третичная структура – это пространственная конфигурация, которую принимает закрученная в спираль полипептидная цепь.
Четвертичная структура – это полимерные образования из нескольких макромолекул белка.
Физические свойства
Свойства белков весьма разнообразны, которые они выполняют. Одни белки растворяются в воде, образуя, как правило, коллоидные растворы (например, белок яйца); другие растворяются в разбавленных растворах солей; третьи нерастворимы (например, белки покровных тканей).
Химические свойства
1. Денатурация – разрушение вторичной, третичной структуры белка под действием различных факторов: температура, действие кислот, солей тяжёлых металлов, спиртов и т.д.
2. Качественные реакции на белки:
|
|
|
а) При горении белка – запах палёных перьев.
б) Белок +HNO3 → жёлтая окраска
в) Раствор белка +NaOH + CuSO4 → фиолетовая окраска
3. Гидролиз
Белок + Н2О → смесь аминокислот
Функции белков в природе:
· каталитические (ферменты);
· регуляторные (гормоны);
· структурные (кератин шерсти, фиброин шелка, коллаген);
· двигательные (актин, миозин);
· транспортные (гемоглобин);
· запасные (казеин, яичный альбумин);
· защитные (иммуноглобулины) и т.д.
Функции белков
Функции белков в природе универсальны. Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д. Основным источником α - аминокислот для живого организма служат пищевые белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают α - аминокислоты. Многие α - аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белковα - аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми. К ним относятся валин, лейцин, треонин, метионин, триптофан и др. (см. таблицу). При некоторых заболеваниях человека перечень незаменимых аминокислот расширяется.
· Каталитическая функция - осуществляется с помощью специфических белков - катализаторов (ферментов). При их участии увеличивается скорость различных реакций обмена веществ и энергии в организме.
|
|
|
Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации ДНК и матричного синтеза РНК. Известно несколько тысяч ферментов. Среди них такие, как, например пепсин, расщепляют белки в процессе пищеварения.
· Транспортная функция - связывание и доставка (транспорт) различных веществ от одного органа к другому.
Так, белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин. Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения окислительных процессов в тканях.
· Защитная функция - связывание и обезвреживание веществ, поступающих в организм или появляющихся в результате жизнедеятельности бактерий и вирусов.
Защитную функцию выполняют специфические белки (антитела - иммуноглобулины), образующиеся в организме (физическая, химическая и иммунная защита). Так, например, защитную функцию выполняет белок плазмы крови фибриноген, участвуя в свертывании крови и тем самым уменьшая кровопотери.
|
|
|
· Сократительная функция (актин, миозин) – в результате взаимодействия белков происходит передвижение в пространстве, сокращение и расслабление сердца, движение других внутренних органов.
· Структурная функция - белки составляют основу строения клетки. Некоторые из них (коллаген соединительной ткани, кератин волос, ногтей и кожи, эластин сосудистой стенки, кератин шерсти, фиброин шелка и др.) выполняют почти исключительно структурную функцию.
В комплексе с липидами белки участвуют в построении мембран клеток и внутриклеточных образований.
· Гормональная (регуляторная) функция - способность передавать сигналы между тканями, клетками или организмами.
Выполняют белки-регуляторы обмена веществ. Они относятся к гормонам, которые образуются в железах внутренней секреции, некоторых органах и тканях организма.
· Питательная функция - осуществляется резервными белками, которые запасаются в качестве источника энергии и вещества.
Например: казеин, яичный альбумин, белки яйца обеспечивают рост и развитие плода, а белки молока служат источником питания для новорожденного.
Разнообразные функции белков определяются α-аминокислотным составом и строением их высокоорганизованных макромолекул.
|
|
|
ВОПРОС №23 ОТВЕТ) Взаимосвязь между классами органических соединений
Генетическая связь классов органических веществ состоит в том, что, используя вещества одного класса соединений, можно получить вещества, принадлежащие к другому классу органических соединений. Взаимосвязь классов органических веществ можно выразить различными схемами. Ниже приведены некоторые общие схемы взаимосвязи органических веществ, а также наиболее важные частные схемы (схемы 12.3 и 12.4).
Схема 12.3
. Взаимосвязи различных классов углеводородов
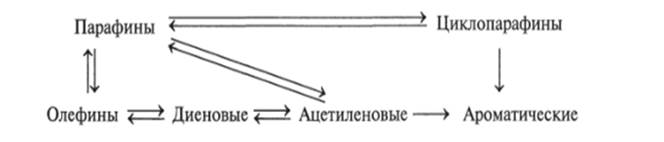
Схема 12.4. Общая взаимосвязь классов органических веществ
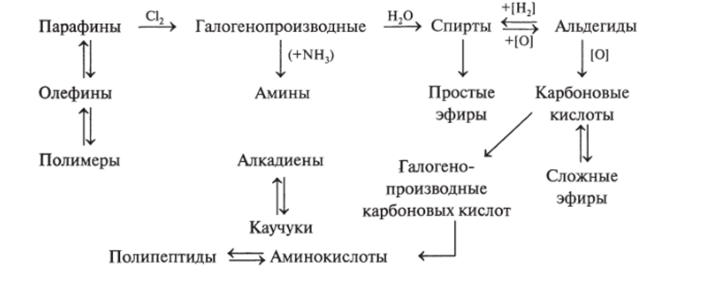
Схема 12.5. Частные превращения органических веществ
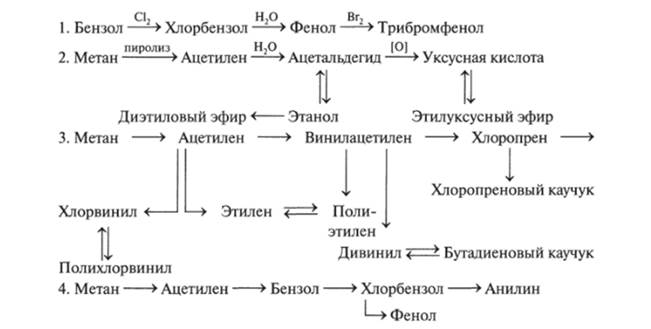
В схеме 12.5 (1—4) каждое превращение можно осуществить только в одну стадию. В заданиях часто предлагается осуществление превращений в несколько стадий (желательно наименьшее их число). Приведем примеры таких превращений (нумерация частных превращений едина).
Схем частных превращений существует бесконечное множество. Для составления таких схем необходимо знание свойств конкретных соединений и общих закономерностей взаимосвязи классов органических веществ.
Между различными классами органических веществ существует генетическая взаимосвязь, позволяющая осуществлять синтезы нужных соединений, основываясь на выбранной схеме превращений. В свою очередь, простейшие органические вещества могут быть получены из неорганических веществ. В качестве примера рассмотрим практическое осуществление реакций согласно следующей схеме:
1) Из углерода (графита) представляется возможность получить метан, с помощью прямого синтеза: так же возможно получить метан в 2 стадии – через карбид алюминия
→ 2) Из метана так же можно получить этилен. Его получение возможно различными способами в несколько стадий. К примеру, можно провести синтез Вюрца. После чего провести дегидрирование этана: так же можно проделать термический крекинг метана и частичное гидрирование полученного ацетилена
→ 3) Этиловый спирт образуется путем гидратации этилена. Гидратация осуществляется в присутствии неорганической кислоты
→ 4) Уксусный альдегид (этаналь) возможно получить с помощью дегидрирования этанола на медном катализаторе. Так же можно получить и при окислении спирта оксидом меди(II)
→ 5) Уксусный альдегид достаточно легко окисляется до уксусной кислоты. В качестве примера можно взять реакцию «серебряного зеркала», или взаимодействии с подкисленным раствором KMnO4 или K2Cr2O7 в процессе нагревания. Так же данную реакцию можно изобразить схематично, с помощью следующего уравнения
→ 6) Синтез аминоуксусной кислоты проводится через промежуточную стадию получения хлоруксусной кислоты.
ВОПРОС №24
Общая характеристика высокомолекулярных соединений: состав, строение, реакции, лежащие в основе их получения (на примере полиэтилена или синтетического каучука).
Полимеры – органические или неорганические соединения, молекулы которых состоят из десятков и сотен тысяч связанных между собой повторяющихся звеньев. Исходное вещество – мономер (низкомолекулярные вещества, способные к взаимодействию друг с другом) за счёт наличия кратных связей (этилен, стирол и т.д.) или существования функциональных групп (COOH и NH2).
Высокомолекулярные соединения (полимеры) существуют как в природе (белки, нуклеиновые кислоты, крахмал, целлюлоза, природный каучук), так и производится в больших масштабах синтетическим путём. Объёмы этих производств всё возрастают. Самыми известными полимерами являются полиэтилен, поливинилхлорид, полистирол, синтетический каучук.
Свойства:
1) химическая стойкость;
2) пластичность;
3) механическая прочность;
4) диэлектрические характеристики;
Свойства полимеров определяются как химической природой мономеров, так и строением макромолекулярной цепи.
1) Цепи могут быть линейными (полиэтилен, каучук), разветвлёнными (крахмал) или пространственно структурированными (резина).
2) В зависимости от порядка соединения мономеров в макромолекуле полимеры могут иметь регулярное (2,3) и нерегулярное строение (1).
Вид структуры определяет физические свойства молекулы.
3) Химическая природа мономера определяет гибкость и термомеханические свойства материала.
Для получения ВМС существуют 2 реакции получения:
1) Полимеризация (образование более сложной молекулы за счёт раскрытия двойной связи)
nCH2=CH2 [−CH2−CH2−]n полиэтилен n≤10000, n≤300000
nCH2=CH−CH=CH2 [−CH2−C=CH−CH2−]n
CH3 изопрен CH3 полиизопрен
2) Реакция поликонденсации заключается в химическом взаимодействии мономеров по их функциональным группам с отщеплением низкомолекулярного продукта (например, H2O)
H O
nH2N−(CH2)5−COOH −N−(CH2)5−C− n + nH2O
аминокапроновая кислота полимер «капрон»
Синтетические полимеры – уникальные материалы современности и будущего.
ВОПРОС №25
Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки
Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
В 1869 г. Д. И. Менделеев на основе анализа свойств простых веществ и соединений сформулировал Периодический закон:
Свойства простых тел и соединений элементов находятся в периодической зависимости от величины атомных масс элементов.
На основе периодического закона была составлена периодическая система элементов. В ней элементы со сходными свойствами оказались объединены в вертикальные столбцы — группы. В некоторых случаях при размещении элементов в Периодической системе приходилось нарушать последовательность возрастания атомных масс, чтобы соблюдалась периодичность повторения свойств. Например, пришлось "поменять местами" теллур и йод, а также аргон и калий.
Причина состоит в том, что Менделеев предложил периодической закон в то время, когда не было ничего известно о строении атома.
После того, как в XX веке была предложена планетарная модель атома, периодический закон формулируется следующим образом:
Свойства химических элементов и соединений находятся в периодической зависимости от зарядов атомных ядер.
Заряд ядра равен номеру элемента в периодической системе и числу электронов в электронной оболочке атома.
Эта формулировка объяснила "нарушения" Периодического закона.
В Периодической системе номер периода равен числу электронных уровней в атоме, номер группы для элементов главных подгрупп равен числу электронов на внешнем уровне.
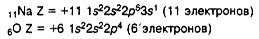
Причиной периодического изменения свойств химических элементов является периодическое заполнение электронных оболочек. После заполнения очередной оболочки начинается новый период. Периодическое изменение элементов ярко видно на изменении состава и свойств и свойств оксидов.

Научное значение периодического закона. Периодический закон позволил систематизировать свойства химических элементов и их соединений. При составлении периодической системы Менделеев предсказал существование многих еще не открытых элементов, оставив для них свободные ячейки, и предсказал многие свойства неоткрытых элементов, что облегчило их открытие.


ВОПРОС №26
Строение атомов химических элементов и закономерности в изменении их свойств на примере: а) элементов одного периода; б) элементов одной главной подгруппы
Атом – наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Общий заряд свободного атома* равен нулю, так как заряды ядра и электронной оболочкиуравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен -1).
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц – нейтронов, не имеющих заряда.
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 – 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями – квáнтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем – высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле: N = 2n2, где N – максимальное число электронов на уровне,
n – номер уровня.
Тогда для первого уровня N = 2 · 12 = 2,
для второго N = 2 · 22 = 8 и т.д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом. Очень важно понимать, что уровни читаются снизу вверх, что соответствует их энергии.
Распределение электронов по уровням можно представить в виде схемы:
11Na ) ) )
2 8 1
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
максимальным количеством электронов: на 1-м уровне не больше 2 e–, на 2-м – 8 e–,
на внешнем уровне – 8 e–;
числом электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
При перемещении слева направо вдоль периода металлические свойства элементов становятся все менее ярко выраженными. При перемещении сверху вниз в пределах одной группы элементы, наоборот, обнаруживают все более ярко
выраженные металлические свойства. Элементы, расположенные в средней части
коротких периодов (2-й и 3-й периоды), как правило, имеют каркасную
ковалентнуто структуру, а элементы из правой части этих периодов существуют в
виде простых ковалентных молекул.
Атомные радиусы изменяются следующим образом: уменьшаются при перемещении
слева направо вдоль периода; увеличиваются при перемещении сверху вниз вдоль
группы. При перемещении слева направо по периоду возрастает
электроотрицательность, энергия ионизации и сродство к электрону, которые
достигают максимума у галогенов. У благородных же газов
электроотрицательность равна 0. Изменение сродства к электрону элементов при
перемещении сверху вниз вдоль группы не столь характерны, но при этом
уменьшается электроотрицательность элементов.
В элементах второго периода заполняются 2s, а затем 2р-орбитали.
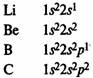
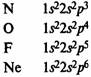
Главная подгруппа IV группы периодической системы химических элементов Д. М.
Менделеева содержит углерод С, кремний Si, германий Ge, олово Sn и свинец Pb.
Внешний электронный слой этих элементов содержит 4 электрона (конфигурация s
2p2). Поэтому элементы подгруппы углерода должны иметь некоторые черты сходства. В частности, их высшая степень окисления одинакова и равна +4.
А чем обусловлено различие в свойствах элементов подгруппы? Различием энергии
ионизации и радиуса их атомов. С увеличением атомного номера свойства
элементов закономерно изменяются. Так, углерод и кремний — типичные
неметаллы, олово и свинец — металлы. Это проявляется прежде всего в том, что
углерод образует простое вещество-неметалл (алмаз), а свинец типичный металл.
Германий занимает промежуточное положение. Согласно строению электронной
оболочки атома p-элементы IV группы имеют четные степени окисления: +4, +2, –
Формула простейших водородных соединений — ЭН4, причем связи Э—Н
ковалентны и равноценны вследствие гибридизации s- и р- орбиталей с
образованием направленных под тетраэдрическими углами sp3 -орбиталей.
Ослабление признаков неметаллического элемента означает, что в подгруппе
(С—Si—Ge—Sn—Pb) высшая положительная степень окисления +4 становится все
менее характерной, а более типичной становится степень окисления +2. Так,
если для углерода наиболее устойчивы соединения, в которых он имеет степень
окисления +4, то для свинца устойчивы соединения, в которых он проявляет
степень окисления +2. А что можно сказать об устойчивости соединений элементов в отрицательной степени окисления —4? По сравнению с неметаллическими элементами VII—V групп признаки неметаллического элемента р-элементы IV группы проявляют в меньшей степени. Поэтому для элементов подгруппы углерода отрицательная степень окисления нетипична.
ВОПРОС №27
Дата добавления: 2019-07-15; просмотров: 5638; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
