Расчет результатов титрования
базируется на законе эквивалентов: вещества реагируют между собой в эквивалентных количествах (n1 = n2). n1 , n2 –число моль экв. титранта и титруемого вещества
n=m/M или n=C×V/1000, [моль]
Формулы для расчетов в титриметрическом анализе.
|
Способ расчета | Способ титрования | ||
| прямое | обратное | косвенное | |
| По молярной концентрации раствора |
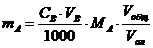
|

|
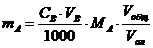
|
| По титру раствора |
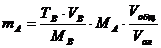
|
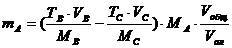
|
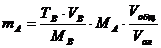
|
| По условному титру раствора | 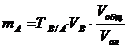
| 
| 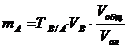
|
mA – масса определяемого вещества, г; МА, МВ, МС – молярные массы веществ А, В, С соответственно (г/моль); CB, TB, VB – молярная концентрация (моль/л), титр (г/мл) и объем (мл) стандартного раствора В; CC, TC, VC – то же для стандартного раствора С; ТВ/А – титр раствора В по веществу А (г/мл); ТС/А – титр раствора С по веществу А (г/мл); Vобщ - общий объем анализируемого раствора, мл; Vал – объем аликвоты.
Стандартизация растворов
Установление его точной концентрации с относительной погрешностью менее 0,1 %.
Растворы:
- стандартные (приготовленные)- получены растворением в определенном объеме растворителя точной навески стандартного образца, содержание в котором основного вещества известно с относительной погрешностью не более ± 1% (фиксаналы или стандарт титры)
- стандартизированные (установленные)- готовят сначала р-р приблизительно требуемой концентрации, а затем его стандартизируют по первичному стандарту-установочному веществу. Установочные вещества должны отвечать ряду требований:
а) вещество должно быть химически чистым (марки «х.ч.» или «ч.д.а.»);
|
|
|
б) состав соединения должен строго соответствовать его химической формуле и по возможности обладать большой молярной массой эквивалента;
в) вещество должно быть доступным и устойчивым при хранении.
Титрованный (стандартный) раствор – это раствор с точно известным титром или точно известной концентрацией химически активного вещества. Чтобы приготовить титрованный раствор, надо взять точную навеску вещества, растворить в дистиллированной воде и довести до определенного объёма.
Стандартные растворы
Процесс любого измерения заключается в сравнении выбранного параметра объекта с аналогичным параметром эталона. В титриметрических анализах эталонами служат растворы с точно известной концентрацией (титром, нормальностью). Такие растворы называют стандартными (титрованными). Их можно приготовить несколькими способами:
1) по точной навеске исходного
вещества;
2) по приблизительной навеске с последующим определением
концентрации по первичному стандарту;
|
|
|
3) разбавлением заранее приготовленного
раствора с известной концентрацией;
4) из фиксанала.
Рассмотрим способы приготовления стандартных растворов.
1) Приготовление титрованного раствора по точной навеске стандартного вещества. Рассчитывают массу навески стандартного вещества, необходимую дляприготовления раствора заданной концентрации в заданном объеме раствора. Массу
навески вещества, взятую на аналитических весах с точностью 0,0002 г, количественно (полностью) переносят в мерную колбу заданной вместимости, растворяют в небольшом объеме воды, доводят до метки дистиллированной водой. В первом способе в качестве исходных веществ можно применять только химически чистые устойчивые соединения, точно известного состава, отвечающие следующим требованиям:
1. Содержание основного вещества в стандарте должно быть известно с точностью до 0,1% и составлять 99,8—99,9%. Предпочтительно его 100%-ная чистота (маркировка х.ч.а. или х.ч.).
2. Устойчивость на воздухе, растворы стандарта не должны изменять титра при хранении.
3. Большая молекулярная масса, чтобы ошибки взвешивания были сведены к минимуму.
4. Хорошая растворимость, быстрая реакция с раствором вещества, концентрацию которого определяют.
|
|
|
5. Эквивалентная точка должна определяться точно и четко. Соединения, удовлетворяющие этим требованиям, называют стандартными исходными веществами или нормалями для установки титра других рабочих растворов. Примеры стандартных веществ: щавелевая кислота (H2C2O4•2H2O), тетраборат натрия (Na2B4O7•10H2O), карбонат натрия (Na2CO3), хлорид натрия (NaCl).
2)Приготовление рабочего раствора по неточной навеске (KOH, NaOH, Na2S2O3). При этом нет необходимости отбирать точную навеску вещества, так как при всей тщательности взвешивания из таких веществ нельзяполучить раствор с точной концентрацией. Поэтому для приготовления рабочихрастворов навеску взвешивают на технических весах и применяют неточнуюмерную посуду. Для стандартизации рабочего раствора еготитруют другим стандартным раствором.Растворы, титр которых находят не по точной навеске, а устанавливают по томуили иному стандартному веществу, называют стандартизированными илирастворами с установленным титром.Так, нормальность раствора гидроксида натрия и перманганата натрияустанавливают по стандартному раствору щавелевой кислоты, а нормальностьсоляной кислоты - по исходному раствору тетрабората натрия.
|
|
|
3) Приготовление рабочего раствора разбавлением более концентрированного раствора (HCl, H2SO4, HNO3).
Установление титров растворов — стандартизация — может быть осуществлено гравиметрическим и объемным методами. В последнем методе титр устанавливается быстрее, поэтому он в основном и используется. Точную навеску первичного стандарта (метод отдельных навесок) или раствор первичного стандарта (метод пипетирования) титруют стандартизируемым раствором. Правильность установки титра проверяют вычислением систематической ошибки установки титра.
4)Приготовление титрованного раствора из фиксанала.
Фиксанал - запаянная ампула, в которой находится точно известное количество вещества или раствора (0,1 моль·экв). Содержимое ампулы количественно переводят в мерную колбу заданного объема, разбивая ампулу о вложенный в воронку боек, вторым бойком разбивают верхнее углубление ампулы, с помощью промывалки через отверстие тщательно промывают ампулу. Для промывки рекомендуется не менее, чем 6-кратный объем воды (по сравнению с вместимостью ампулы). Раствор доводят до метки дистиллированной водой и перемешивают. Из фиксанала готовят как стандартные, так и рабочие растворы. Это быстрый и достаточно точный способ приготовления титрованных растворов. Для каждого титриметрического метода разработаны методики стандартизации применяемых титрантов, даются рекомендации по выбору первичных стандартов. Необходимо помнить, что характеристики стандартных растворов должны быть определены с необходимой точностью. Титр, молярность и нормальность определяют до четвертой значащей цифры, не считая нулей после запятой (например, TNaOH = 0,004014 г/см3 ; СKMnO4 = 0,04995 н.).
Дата добавления: 2018-04-05; просмотров: 2919; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
