Вычисления в титриметрическом анализе
ЛЕКЦИЯ 14
Порядок и техника титрования. Расчеты. Использование метода при анализе лекарственных веществ.
Способы выражения концентрации растворов
- Молярная концентрация или молярность [С(В) или СВ] моль/л –показывает сколько моль вещества В содержится в 1 литре раствора.
С(В)=m(г)/(Мр.в. ·Vр-ра)
- Молярная концентрация эквивалента или нормальность [C(fэкв(B)B)] моль×экв/л -показывает сколько моль эквивалента вещества В содержится в 1 литре раствора.
C(fэкв(B)B)= m(г)/(Э ·Vр-ра)
Эквивалент вещества В [ЭВ]-реальная или условная частица этого вещества, эквивалентная одному иону водорода в реакциях кислотно–основного взаимодействия или одному электрону в реакциях окисления-восстановления.
Фактор эквивалентности [fэкв(В)] –безразмерная величина, равная или меньше единицы. Рассчитывается на основании стехиометрии реакции:
Молярная масса эквивалента вещества В:
[M(fэкв(B)B)]= fэкв(B)×M(B)
Массовая доля или процентная концентрация-отношение массы (г) данного вещества в растворе к массе всего раствора.
- Титр рабочего раствора В по рабочему веществу В [T(B) или ТВ] г/мл –число граммов растворенного вещества В в 1 мл раствора
Т(В) = m/V, или через концентрацию

- Титр рабочего раствора В по определяемому веществу А или условный титр [ТВ/А или Т(В/А)] г/мл -число граммов определяемого вещества А, эквивалентное 1 мл рабочего раствора В.
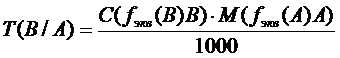
или через титр раствора
|
|
|
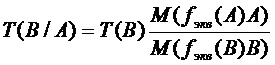 |
Титриметрический анализ.
м.а., основан на точном измерении объема реактива, расходуемого на реакцию с определяемым веществом.
Аналитический сигнал: объем реактива (V мл).

Требования к реакциям: должна протекать быстро, стехиометрически, количественно.
Титрование-процесс постепенного прибавления титранта (рабочего раствора), находящегося в бюретке, к титруемому раствору, находящемуся в колбе для титрования, до достижения точки эквивалентности.
Точка эквивалентности –момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества.
Для фиксирования т.э. используют индикаторы или различные физико-химические методы.
Титрант добавляют к точно отмеренному объему анализируемого раствора небольшими порциями. После добавления каждой новой порции титранта в системе,
описываемой уравнением химической реакции, устанавливается равновесие, например:
nА + mВ ↔ АnВm,
где А — анализируемое вещество;
В — титрант;
n, m — стехиометрические коэффициенты.
По мере протекания реакции равновесные концентрации определяемого вещества и титранта уменьшаются, а равновесные концентрации продуктов реакции увеличиваются. Когда будет израсходовано количество титранта, эквивалентное количеству титруемого вещества, реакция закончится. Этот момент называется точкой эквивалентности, которая описывается соотношением:
|
|
|
H1V1=H2V2
В точке эквивалентности произведение нормальности первого раствора на его объем равен произведению нормальности второго раствора на его объем. На практике фиксируют точку конца реакции, которая с какой-то степенью приближения соответствует точке эквивалентности. В химических методах анализа ее фиксируют визуально по заметному аналитическому эффекту (изменению окраски раствора, выпадению осадка), вызываемому каким-либо из исходных соединений, продуктов реакции или специально введенных в систему веществ — индикаторов. В физико-химических методах анализа конечную точку определяют по резкому изменению измеряемого физического параметра — рН, потенциала, электрической проводимости и т. д. Преимущества титриметрических методов анализа: быстрота определения и простота используемого оборудования, что особенно удобно при проведении серийных анализов. Порог чувствительности этих методов порядка 10-3 моль/дм3, или 0,10%; правильность ~0,5% (отн.). Эти цифры зависят от чувствительности применяемых индикаторов и концентрации реагирующих растворов.
|
|
|
Методы титрования.
- метод пипетирования
- метод отдельных навесок
Вычисления в титриметрическом анализе
В основе вычислений в объѐмном анализе лежит принцип: вещества реагируют друг с другом всегда в эквивалентных количествах.
Поэтому используют нормальную концентрацию. При одинаковых нормальностях растворы взаимодействуют равными объемами, без остатка. В точке эквивалентности произведение нормальности на объем раствора есть величина постоянная для обоих реагирующих веществ: H1V1= H2V2
Ход вычисления зависит от того, выполняют ли титрование методом пипетирования или методом отдельных навесок.
Метод пипетированиясостоит в том, что навеску анализируемого вещества
растворяют в мерной колбе, доводят объем до метки и берут для титрования
определенные (аликвотные) порции раствора с помощью пипетки.
По методу отдельных навесоккаждую навеску анализируемого вещества
растворяют в произвольном объеме воды и титруют весь полученный раствор.
Способы титрования
- прямое -титрант непосредственно прибавляют к титруемому веществу (один рабочий раствор, пример – титрование щелочи кислотой)
- обратное –титрование по остатку (два рабочих раствора – основной и вспомогательный, хорошо взаимодействующих друг с другом, например кислота и щелочь или окислитель и восстановитель)
А + В ® Д + Е
|
|
|
В + С ® F + G
метод используют в случае обратимого взаимодействия титранта с определяемым веществом, низкой скорости реакции, отсутствия подходящего индикатора, возможных побочных эффектов.
- косвенное –титрование заместителя или титрование по замещению
А + Д ® С + Е
С + В ® F + G
метод используют, когда титрант и определяемое вещество не взаимодействуют друг с другом, когда реакция протекает медленно и нестехиометрично.
Принцип титрования:к раствору анализируемого вещества неизвестной концентрации (пробе) добавляют раствор реагирующего с ним вещества известной концентрации (титранта) до тех пор, пока не будет получен сигнал индикатора, свидетельствующий о прекращении реакции (достижении конечной точки титрования).
Следует различать экспериментально наблюдаемую конечную точку титрованияи истинную точку эквивалентности,соответствующуюстехиометрическим соотношениям реагирующих веществ. В идеальном случае обеточки совпадают, однако на практике между ними существует различие(погрешность титрования). Для большинства титриметрических определенийдопустима погрешность не более ±0,1%.
С точки зрения способа осуществления различают следующие виды титрований:
- Прямое титрование:пробу титруют раствором титранта.
- Обратное титрование:титрант добавляют к пробе в избытке и затем оттитровывают не прореагировавший титрант.
- Заместительное титрование:к пробе добавляют не сам титрант, а какой- либо вспомогательный реагент, взаимодействующий с определяемым веществом и дающий эквивалентное количество продукта реакции; последний оттитровывают.
- Косвенное титрование:анализируемое вещество предварительно переводят в другое соединение, которое и оттитровывают; по результатам титрования этого соединения
рассчитывают количество определяемого вещества.
Дата добавления: 2018-04-05; просмотров: 2669; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
