Особенности реакции гидролиза:
а) эта реакция противоположна реакции образования сложного эфира; б) реакция гидролиза сложного эфира обратима, так же, как и реакция этерификации.
Физические свойства сложных эфиров:
Много сложных эфиров карбоновых кислот имеют характерные фруктовые или цветочные запахи, за что их используют как искусственные ароматизаторы.
Например:
Бутилацетат имеет грушевый аромат
Метиловый эфир масляной кислоты - яблоневый
Этиловый эфир масляной кислоты - ананасовый или «абрикосовый».
Этиловый эфир изовалериановой кислоты -малиновый.
Этиловый эфир валериановой кислоты -виноградный.
Изоамиловый эфир изовалериановой кислоты -банановый.
Октиловый эфир уксусной кислоты -апельсиновый.
Етилсалицилат – мятный.
Бензилацетат – жасминовый.
Бензилбензоат – цветочный.
Применение эфиров на основе свойств.
Етилформиат и этилацетат используются как растворители целлюлозных лаков. Сложные эфиры на основе низших спиртов и кислот используют в пищевой промышленности при создании фруктовых эссенций, а на основе ароматических спиртов - в парфюмерной промышленности. Воски входят в состав косметических кремов и лекарственных мазей. Животные жиры и масла представляют собой сырье для получения высших карбоновых кислот, моющих средств и глицерина. На основе растительных масел изготавливают олифы, составляющих основу масляных красок. Нитроглицерин - известный лекарственный препарат и взрывчатое вещество, основа динамита. Сложные эфиры серной кислоты используют в органическом синтезе.
|
|
|
Понятие о жирах как сложных эфирах.
Жиры- сложные эфиры трёхатомного спирта - глицерина и высших карбоновых кислот. Все жиры животного происхождения - твёрдые вещества. Исключение лишь составляет рыбий жир.
 Жиры растительного происхождения - жидкие вещества, исключение составляет твёрдое кокосовое масло.
Жиры растительного происхождения - жидкие вещества, исключение составляет твёрдое кокосовое масло.
Между растительными и животными жирами имеется существенное различие. Так, в состав жидкого жира входят непредельные кислоты, а в состав твёрдого жира - предельные. Например, жидкий жир - содержит олеиновую кислоту C17H33COOH или линолевую кислоту C17H31COOH. Твёрдый жир содержит, например, пальмитиновую кислоту C15H31COOH или стеариновую кислоту C17H35COOH.
Как уже говорилось, жиры и масла принадлежат к классу сложных эфиров. Жиры вместе с белками и углеводами составляют группу органических соединений, имеющих исключительное физиологическое значение: они являются важнейшей частью пищи!
Жиры важны и в техническом отношении: они являются источником получения глицерина, высших карбоновых кислот и мыла. Некоторые растительные жиры и масла используются при изготовлении олифы, линолеума, масляных красок и лаков. Некоторые жиры, благодаря своей большой вязкости, могут служить смазочным материалом.
Жиры состоят из разнообразных кислот. Удалось выделить кислоты от С4 до С24, как предельные, так и непредельные. Так, к важнейшим предельным кислотам, выделенным из жиров, является стеариновая, капроновая, каприловая, каприновая, масляная. К непредельным - олеиновая, линолевая, линоленовая.
|
|
|
 В природе встречаются как жидкие, так и твёрдые жиры. Но те и другие образованы одним и тем же спиртом. Несложно догадаться, что за агрегатное состояние жиров отвечают входящие в его состав кислоты (предельные - для твёрдых жиров, непредельные - для жидких).
В природе встречаются как жидкие, так и твёрдые жиры. Но те и другие образованы одним и тем же спиртом. Несложно догадаться, что за агрегатное состояние жиров отвечают входящие в его состав кислоты (предельные - для твёрдых жиров, непредельные - для жидких).
Растительные жиры - масла, как правило жидкие, но среди них встречаются и твёрдые (пальмовое и кокосовое масло). Животные жиры - сало, преимущественно твёрдые и имеют различную температуру плавления. Температура застывания жиров всегда ниже температуры их плавления.
Свойства жиров:К важнейшим свойствам жиров относятся следующие:
- жиры легче воды, их плотность колеблется от 0,9г/см3 до 0,98г/см3 при 150С
- в воде не растворяются;
|
|
|
- в присутствии щёлочи или белка образуются достаточно прочные эмульсии. Примером жировой эмульсии может служить всем известное молоко!
-хорошо растворяются в бензине, сероуглероде, хлороформе, четырёххлористом углероде, но в спирте для некоторых жиров растворимость значительно меньше.
-имеют различную температуру плавления.
- температура застывания жиров всегда ниже температуры их плавления.
-все жиры нелетучие и при нагревании разлагаются.
В чистом виде жиры бесцветны, без запаха и вкуса. Окраска и запах природных жиров обусловлен примесями.
Природные жиры не являются индивидуальными соединениями, а представляют собой разнообразную смесь глицеридов.
4.Химические свойстважиров: гидролиз (омыление) жиров, гидрирование жидких жиров.
Омыление жиров.Как любые сложные эфиры, жиры способны омыляться. Этот процесс важен как с биологической, так и с технической точки зрения. В живой природе омыление жиров связано с жизненными процессами жирового обмена и проходит под влиянием ферментов.
В технике омыление жиров осуществляют нагреванием их со щелочами (щелочное омыление) или серной кислотой (кислотное омыление), а иногда используют перегретый пар и специальные катализаторы (вещества, ускоряющие химическую реакцию).
|
|
|
Основные химические реакции, протекающие при омылении разнообразных жиров, заключаются в образовании солей жирных кислот при их взаимодействии с различными щелочами.
В мыловарении омылением называют процесс получения мыла из жиров, жирных кислот и жирозаменителей при обработке их щелочами.
Омыление нейтральных жиров. При омылении нейтральных жиров растворами едких щелочей одновременно протекают две химические реакции: расщепление (гидролиз) триглицеридов и нейтрализация (связывание) щелочью выделяющихся в результате расщепления жирных кислот.Расщепление триглицеридов протекает ступенчато. Сначала отщепляется одна молекула жирной кислоты, потом вторая и наконец третья, при этом высвобождается глицерин. По мере отщепления жирных кислот они мгновенно нейтрализуются едкой щелочью.
Названия жирных кислот с числом углеродных атомов в цепи свыше 6 являются историческими, т.е. тривиальными, большинство из которых впервые были выделены из жиров.
Гидрированиерастительных масел– важнейший промышленный процесс. Он стал возможным благодаря работам французского химика Поля Сабатье, нашедшего катализатор этого процесса: мелкоизмельченные металлические никель или платина. За это открытие в 1912г. Сабатье был удостоен Нобелевской премии.В результате этого процесса получается искусственный твердый жир – саломас,идущий на изготовление маргарина и заменителей сливочного масла. В жировую основу маргарина добавляют эмульгаторы, молоко, соль, сахар, ароматические вещества, сливочное масло.
Маргарин –это твердый жир, содержащий только остатки предельных карбоновых кислот. Поэтому маргарин не будет проявлять свойства непредельных УВ.
Сливочное масло –содержит остатки непредельных кислот, поэтому будет обесцвечивать бромную воду или раствор перманганата калия.эксперимент: опустить в раствор KMnO4 кусочек исследуемого жира. результат: если р-р обесцветился, значит – это сливочное масло, если не обесцветился, значит это маргарин.
Вы знаете, что маргарин может быть разной консистенции от «мягкого» до «твердого», склонного к крошению, хрупкого продукта.-как вы считаете, почему?(зависит от количества двойных связей).
Ещё применение жиров: краска, свечи, мыло, парфюмерия, глицерин, корм для животных.
Контроль знаний:
1.Какие соединения называют эфирами и жирами?
2.Приведите примеры применения эфиров и жиров.
3.Охарактеризуйте физические и химические свойства сложных эфиров и жиров. Напишите уравнения соответствующих реакций.
4.При стирке белья в жёсткой воде расход мыла значительно больше. Почему? Ответ поясните уравнением реакции.
5.Каков состав и в чём преимущества синтетических моющих средств по сравнению с натуральным мылом?
Домашнее задание:
Проработать: Л1.стр.135-143,пересказ конспекта лекции №13.
Лекция № 14.
Тема: Углеводы, их классификация: моносахариды (глюкоза), дисахариды (сахароза) и полисахариды (крахмал и целлюлоза). Значение углеводов в живой природе и в жизни человека. Глюкоза — вещество с двойственной функцией — альдегидоспирт. Химические свойства глюкозы: окисление в глюконовую кислоту, восстановление в сорбит, брожение (молочнокислое и спиртовое). Применение глюкозы на основе свойств. Дисахариды и полисахариды. Понятие о реакциях поликонденсации и гидролиза на примере взаимопревращений: глюкоза – полисахарид.
Основные понятия и термины по теме:классификация углеводов: моносахариды, олигосахариды, полисахариды, характеристика представителей моносахаридов: глюкоза, фруктовый сахар, дезоксирибоза, качественные реакции.
План изучения темы
(перечень вопросов, обязательных к изучению):
1.Определение понятия: углеводы. Классификация.
2. Состав, физические и химические свойства углеводов.
3.Рспространение в природе. Получение. Применение
Содержание лекции:
Углеводы – органические соединения, содержащие карбонильные и гидроксильные группировки атомов, имеющие общую формулу Cn(H2O)m, (где n и m>3).
Углеводы – вещества, имеющие первостепенное биохимическое значение, широко распространены в живой природе и играют большую роль в жизни человека.
Название углеводы возникло на основании данных анализа первых известных представителей этой группы соединения. Вещества этой группы состоят из углерода, водорода и кислорода, причем соотношение чисел атомов водорода и кислорода в них такое же, как и в воде, т.е. на каждые 2 атома водорода приходится один атом кислорода. В прошлом столетии их рассматривали как гидраты углерода. Отсюда и возникло русское название углеводы, предложенное в 1844г. К.Шмидтом. Общая формула углеводов, согласно сказанному, СмН2пОп. При вынесении «n» за скобки получается формула См(Н2О)n, которая очень наглядно отражает название «угле - воды». Изучение углеводов показало, что существуют соединения, которые по всем свойствам нужно отнести в группу углеводов, хотя они имеют состав, не точно соответствующий формуле СмH2пОп. Тем не менее старинное название «углеводы», сохранилось до наших дней, хотя наряду с этим названием для обозначения рассматриваемой группы веществ иногда применяют и более новое название – глициды.
Углеводы можно разделить на три группы: 1) Моносахариды – углеводы, способные гидролизоваться с образованием более простых углеводов. К данной группе относятся гексозы (глюкоза и фруктоза), а также пентоза (рибоза). 2) Олигосахариды – продукты конденсации нескольких моносахаридов (например, сахароза). 3) Полисахариды – полимерные соединения, содержащие большое число молекул моносахаридов.
Моносахариды. Моносахариды являются гетерофункциональными соединениями. В их молекулах одновременно содержатся и карбонильная (альдегидная или кетонная), и несколько гидроксильных групп, т.е. моносахариды представляют собой полигидроксикарбонильные соединения - полигидроксиальдегиды и полигидроксикетоны. В зависимости от этого моносахариды подразделяются на альдозы (в моносахариде содержится альдегидная группа) и кетозы (содержится кетогруппа). Например, глюкоза – это альдоза, а фруктоза – это кетоза.
Получение. В свободном виде в природе встречается преимущественно глюкоза. Она же является структурной единицей многих полисахаридов. Другие моносахариды в свободном состоянии встречаются редко и в основном известны как компоненты олиго- и полисахаридов. В природе глюкоза получается в результате реакции фотосинтеза:
6CO2 + 6H2O ® C6H12O6(глюкоза) + 6O2
Впервые глюкоза получена в 1811 году русским химиком Г.Э.Кирхгофом при гидролизе крахмала. Позже синтез моносахаридов из формальдегида в щелочной среде предложен А.М.Бутлеровым
| O |
В промышленности глюкозу получают гидролизом крахмала в присутствии серной кислоты.
(C6H10O5)n(крахмал) + nH2O ––H2SO4,t°® nC6H12O6(глюкоза)
Физические свойства.Моносахариды – твердые вещества, легко растворимые в воде, плохо – в спирте и совсем нерастворимые в эфире. Водные растворы имеют нейтральную реакцию на лакмус. Большинство моносахаридов обладают сладким вкусом, однако меньшим, чем свекловичный сахар.
Глюкоза C6H12O6 (альдегидоспирт).
Глюкозу называют также виноградным сахаром, так как она содержится в большом количестве в виноградном соке. Кроме винограда глюкоза находится и в других сладких плодах и даже в разных частях растений. Распространена глюкоза и в животном мире: 0,1% ее находится в крови. Глюкоза разносится по всему телу и служит источником энергии для организма. Она также входит в состав сахарозы, лактозы, целлюлозы, крахмала.
В организме человека глюкоза содержится а мышцах, крови, и в небольших количествах во всех клетках.
В природе глюкоза на ряду с другими углеводами образуется в результате реакции фотосинтеза:
6СО2+6Н2О хролофил С6Н12О6+6О2-Q.
Физические свойства. Глюкоза -- бесцветное кристаллическое вещество со сладким вкусом, хорошо растворимое в воде. Из водного раствора она выделяется в виде кристаллогидрата С6Н12Об*Н2О. По сравнению со свекловичным сахаром она менее сладкая.
Глюкоза может существовать в линейной и циклической формах:
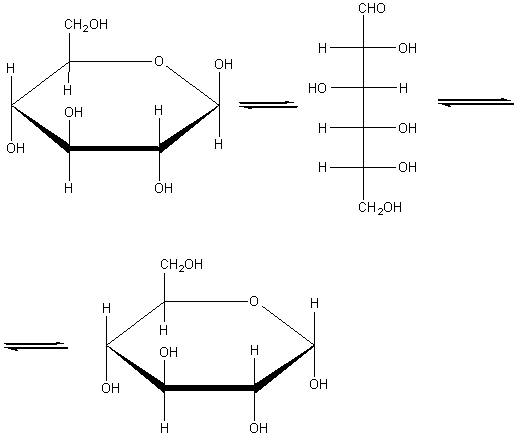
Получение.
Первый синтез простейших углеводов из формальдегида в присутствии гидроксида кальция был произведен А. М. Бутлеровым в 1861 г. На производстве глюкозу чаще всего получают гидролизом крахмала в присутствии серной кислоты:
(С6Н10О5)n + nН2О Н2SO4, t nС6Н12О6
Химические свойства:
Глюкоза обладает химическими свойствами, характерными для спиртов и альдегидов. Кроме того, она обладает и некоторыми специфическими свойствами.
1) Реакции альдегидной группы:
а) реакция «серебряного зеркала»:
CH2OH–(CHOH)4–CH=O + 2[Ag(NH3)2]OH →
→ CH2OH–(CHOH)4–COONH4 + 2Ag↓ +3NH3 + H2O;
б) реакция с гидроксидом меди (II):
t
CH2OH–(CHOH)4–CH=O + 2Cu(OH)2 →
CH2OH–(CHOH)4–COOH + Cu2O↓ + 2H2O,
в) восстановление:
[H]
CH2OH–(CHOH)4–CH=O → CH2OH–(CHOH)4–CH2OH.
2) Реакции гидроксильной группы:
а) взаимодействие с гидроксидом меди (II): Как и все многоатомные спирты, глюкоза с гидроксидом меди (II) дает интенсивное синее окрашивание (качественная реакция). Осадок гидроксида меди(II) сначала растворяется, затем при нагревании становится желто-оранжевым, что говорит о наличии альдегидной группы.
HOCH2(CHOH)4CHO + 2Cu(OH)2 ----- HOCH2(CHOH)4COOH + Cu2O + 2H2O
 ярко синий раствор
ярко синий раствор
При действии бромной водой глюкоза также окисляется в глюконовую кислоту.
-Окисление глюкозы азотной кислотой приводит к двухосновной сахарной кислоте:

Восстановление глюкозы в шестиатомный спирт сорбит:

Cорбит содержится во многих ягодах и фруктах.

б) брожение – расщепление глюкозы под действием ферментов (специфические реакции)
C6H12O6 → 2C2H5OH + 2CO2 – спиртовое брожение,
C6H12O6 → 2CH3CH(OH)COOH – молочнокислое брожение
Существуют специфические свойства глюкозы, подобно алифатическим альдегидам она присоединяет молекулу синильной кислоты. Что позволяет увеличить длину цепи углевода:
HOCH2-(CHOH)4—COH + HCN ---- HOCH2_(CHOH)4-CHOH-CN
Фруктоза C6H12O6 (кетоноспирт). В растительном мире широко распространена фруктоза или фруктовый (плодовый) сахар. Фруктоза содержится в сладких плодах, меде. Извлекая из цветов сладких плодов соки, пчелы приготавливают мед, который по химическому составу представляет собой в основном смесь глюкозы и фруктозы. Также фруктоза входит в состав сложных сахаров, например тростникового и свекловичного.

Химические свойства:Фруктоза вступает во все реакции, характерные для многоатомных спиртов, однако реакции карбонильной (альдегидной) группы, в отличие от глюкозы, для нее не характерны.
Рибоза C5H10O5 – пентоза (альдегидоспирт)

Химические свойства аналогичны глюкозе.
Дисахариды.
Важнейшие дисахариды -- сахароза, мальтоза и лактоза. Все они являются изомерами и имеют формулу С12Н22О11, однако их строение различно
Сахароза C12H22O11 – дисахарид. Сахароза образована остатками a-глюкозы и b-фруктозы:

Химические свойства:
1) Гидролиз:
C12H22O11 + H2O → C6H12O6 + C6H12O6.
Сахароза глюкоза фруктоза
2) Взаимодействие с гидроксидом кальция с образованием сахарата кальция.
3) Сахароза не реагирует с аммиачным раствором оксида серебра, поэтому ее называют невосстанавливающим дисахаридом.
Индусы еще за 300 лет до нашей эры умели получать тростниковый сахар из тростника. В наше время получают сахарозу из тростника, произрастающего в тропиках (на о.Куба и в других странах Центральной Америки).
В середине 18 века дисахарид был обнаружен и в сахарной свекле, а в середине 19 века был получен в производственных условиях.
В сахарной свекле содержится 12-15% сахарозы, по другим источникам 16-20% (сахарный тростник содержит 14-26% сахарозы).
Тростниковый сахар применяется в медицине для изготовления порошков, сиропов, микстур и т.д.
Свекловичный сахар широко применяется в пищевой промышленности, кулинарии, приготовлении вин, пива и т.д.
Из молока получают молочный сахар - лактозу. В молоке лактоза содержится в довольно значительном количестве: в коровьем молоке 4-5,5% лактозы, женское молоко содержит 5,5-8,4% лактозы.
Лактоза отличается от других сахаров отсутствием гидроскопичности - она не отсыревает. Это свойство имеет большое значение: если нужно приготовить с сахаром какой-либо порошок, содержащий легко гидролизующее лекарство, то берут молочный сахар. Если взять тростниковый или свекловичный сахар, то порошок быстро отсыреет и легко гидролизующее лекарственное вещество быстро разложится.
Значение лактозы очень велико, т.к. она является важным питательным веществом, особенно для растущих организмов человека и млекопитающихся животных.
Солодовый сахар - это промежуточный продукт при гидролизе крахмала. По другому его называют еще мальтоза, т.к. солодовый сахар получается из крахмала при действии солода (по лат. солод - maltum).
Солодовый сахар широко распространен как в растительных, так и в животных организмах. Например, он образуется под влиянием ферментов пищеварительного канала, а также при многих технологических процессах бродильной промышленности: винокурения, пивоварении и т.д.
Мальтоза С12H22O11 – дисахарид, образованный двумя остатками a-глюкозы.

Химические свойства аналогичны глюкозе, поэтому ее называют восстанавливающим дисахаридом. Молекула мальтозы состоит из двух остатков б -глюкозы в пиранозной форме, соединенных через 1-й и 4-й атомы углерода.
Лактоза состоит из остатков (3-галактозы и а-глюкозы в пиранозной форме, соединенныхчерез 1-й и 4-й атомы углерода. Все эти вещества представляют собой бесцветные кристаллы сладкого вкуса, хорошо растворимые в воде. Химические свойства дисахаридов определяются их строением. При гидролизе дисахаридов в кислой среде или под действием ферментов связь между двумя циклами разрывается и образуются соответствующие моносахариды, например:
С12Н22О11 + Н2О Н+, t С6Н12О6 + С6Н12О6
глюкоза фруктоза
По отношению к окислителям дисахариды делят на два типа: восстанавливающие и невосстанавливающие. К первым относятся мальтоза и лактоза, которые реагируют с аммиачным раствором оксида серебра по упрощенному уравнению:
NH3
C12H22O11 + Ag2O ------ > С12Н22О12 + 2Ag.
Эти дисахариды могут также восстанавливать гидроксид меди (II) до оксида меди (I):
C12H22O11 + 2Сu(ОН)2 ---- > С12Н22О12 + Cu2Ov + 2Н2О.
Восстановительные свойства мальтозы и лактозы обусловлены тем, что их циклические формы содержат гликозидный гидроксил (обозначен звездочкой), и, следовательно, эти дисахариды могут переходить из циклической формы в альдегидную, которая и реагирует с Ag2O и Сu(ОН)2. В молекуле сахарозы нет гликозидного гидроксила, поэтому ее циклическая форма не может раскрываться и переходить в альдегидную форму. Сахароза -- невосстанавливающий дисахарид; она не реагирует с гидро-ксидом меди (II) и аммиачным раствором оксида серебра.
Распространение в природе.Наиболее распространенный дисахарид -- сахароза. Это химическое название обычного сахара, который получают экстракцией из сахарной свеклы или сахарного тростника. Сахароза -- главный источник углеводов в пище
человека. Лактоза содержится в молоке (от 2 до 8%) и получается из молочной сыворотки. Мальтоза содержится в проросших семенах хлебных злаков. Мальтоза также образуется при неполном гидролизе крахмала.
Полисахариды: Молекулы полисахаридов можно рассматривать как продукт поликонденсации моносахаридов.Важнейшие из полисахаридов – это крахмал и целлюлоза (клетчатка). Они построены из остатков глюкозы. Общая формула этих полисахаридов (C6H10O5)n
Крахмал (С6H10O5)n – природный полимер, молекулы которого состоят из линейных и разветвленных цепей, содержащих остатки a-глюкозы. Крахмал - образуется в растениях при фотосинтезе и откладывается в виде "резервного" углевода в корнях, клубнях и семенах.Зерна риса, пшеницы, ржи и других злаков содержат 60-80% крахмала, клубни картофеля - 15-20%. Крахмальные зерна растений различаются по внешнему виду, что хорошо видно, когда их рассматриваешь под микроскопом.
Физические свойства: Внешний вид крахмала хорошо всем известен: это белое вещество, состоящее из мельчайших зерен, напоминающих муку, поэтому его второе название «картофельная мука». Крахмал не растворим в холодной воде, в горячей набухает и постепенно растворяется, образуя вязкий раствор (клейстер).При быстром нагревании крахмала происходит расщепление гигантской молекулы крахмала на мелкие молекулы полисахаридов, называемых декстринами. Декстрины имеют общую молекулярную формулу с крахмалом (С6Н12О5)х, разница лишь в том, «х» в декстринах меньше «n» в крахмале.Пищеварительные соки содержат несколько разных ферментов, которые при низкой температуре доводят гидролиз крахмала до глюкозы:
(С6Н10О5) ------- (С6Н10О5)х --------- С12Н22О11 --------- С6Н12О6
Крахмал легко подвергается гидролизу: при нагревании в присутствии серной кислоты образуется глюкоза.(C6H10O5)n(крахмал) + nH2O ––H2SO4,t°® nC6H12O6(глюкоза)
Химические свойства:
1) Гидролиз
H+, t
(C6H10O5)n + nH2O → nC6H12O6
глюкоза
2) Крахмал дает интенсивно синее окрашивание с йодом за счет образования внутрикомплексного соединения(качественная реакция).
3) Крахмал не вступает в реакцию «серебряного зеркала».
Применение: Ферментативный гидролиз (разложение путем брожения) крахмала имеет промышленное значение в производстве этилового спирта из зерна и картофеля. Процесс начинается с превращением крахмала в глюкозу, которую затем сбраживают. Используя специальные культуры дрожжей и изменяя условия, можно направить брожение и в сторону получения бутилового спирта, ацетона, молочной, лимонной и глюконовой кислот. Подвергая крахмал гидролизу кислотами, можно получить глюкозу в виде чистого кристаллического препарата или в виде патоки - окрашенного нескристаллизирующего сиропа. Наибольшее значение крахмал имеет в качестве пищевого продукта: в виде хлеба, картофеля, круп, являясь главным источником в нашем рационе питания. Кроме того, чистый крахмал применяется в пищевой промышленности в производстве кондитерских и кулинарных изделий, колбас. Значительное количество крахмала употребляется для проклеивания тканей, бумаги, картона, производства канцелярского клея. В аналитической химии крахмал служит индикатором в йодометрическом методе титрования. Для этих случаев лучше применять очищенную амилозу, т.к. ее растворы не загустевают, а образуемая с йодом окраска более интенсивна. В медицине и фармации крахмал применяется для приготовления присыпок, паст (густых мазей), а также при производстве таблеток. В животном мире роль «запасного крахмала» играет родственный крахмалу полисахарид - гликоген. Гликоген содержится во всех животных тканях. Особенно много его в печени (до 20%) и в мышцах (4%).
Целлюлоза (С6H10O5)n – природный полимер, молекулы которого состоят из линейных цепей, содержащих остатки b-глюкозы. . Целлюлоза – многоатомный спирт, на элементную ячейку полимера приходятся три гидроксильных группы. В связи с этим, для целлюлозы характерны реакции этерификации (образование сложных эфиров). Наибольшее практическое значение имеют реакции с азотной кислотой и уксусным ангидридом.
Нахождение в природе: Целлюлоза, так же как и крахмал, образуется в растениях при реакции фотосинтеза. Она является основной составной частью оболочки растительных клеток; отсюда происходит ее название -- целлюлоза («целлула» -- клетка). Волокна хлопка -- это почти чистая целлюлоза (до 98%). Волокна льна и конопли тоже состоят главным образом из целлюлозы. В древесине ее содержится примерно 50%.
Получение:Образцом почти чистой целлюлозы является вата, полученная из очищенного хлопка. Основную массу целлюлозы выделяют из древесины, в которой она содержится вместе с другими веществами. Наиболее распространенным методом получения целлюлозы в нашей стране является так называемый сульфитный. По этому методу измельченную древесину в присутствии раствора гидросульфита кальция Ca(HSO3)2 или «гидросульфита натрия NaHSO3 нагревают в автоклавах при давлении 0,5-- 0,6 МПа и температуре 150 "С. При этом все другие вещества разрушаются, а целлюлоза выделяется в сравнительно чистом виде. Ее промывают водой, сушат и направляют на дальнейшую переработку, большей частью на производство бумаги.
Физические свойства. Целлюлоза -- волокнистое вещество, нерастворимое ни в воде, ни в обычных органических растворителях. Растворителем ее является реактив Швейцера -- раствор гидроксида меди (II) с аммиаком, с которым она одновременно и взаимодействует.
Химические свойства:
1) Гидролиз:
H+, t
(C6H10O5)n + nH2O → nC6H12O6.
глюкоза
2) Образование сложных эфиров с азотной и уксусной кислотами:
(C6H7O2(OH)3)n + 3nCH3COOH → (C6H7O2(OCOCH3)3)n + nH2O
|
| + 3n HNO3 | H2SO4 ––––® |
| + 3n H2О |
Применение.Целлюлоза используется человеком с очень древних времен. Ее применение весьма разнообразно.Большое значение имеют продукты этерификации целлюлозы. Так, например, из ацетилцеллюлозы получают ацетатный шелк. Для этого триацетилцеллюлозу растворяют в смеси дихлорметана и этанола. Образовавшийся вязкий раствор продавливают через фильеры -- металлические колпачки с многочисленными отверстиями (рис. 36). Тонкие струи раствора опускаются в шахту, через которую противотоком проходит нагретый воздух. В результате растворитель испаряется и триацетил целлюлоза выделяется в виде длинных нитей, из которых прядением изготовляют ацетатный шелк Ацетил целлюлоза идет также на производство негорючей пленки и органического стекла, пропускающего ультрафиолетовые лучи. Тринитроцеллюлоза (пироксилин) используется как взрывчатое вещество и для производства бездымного пороха. Для этого тринитроцеллюлозу растворяют в этил-ацетате или в ацетоне. После испарения растворителей компактную массу размельчают и получают бездымный порох. Динитроцеллюлоза (коллоксилин) применяется также для получения коллодия. В этих целях ее растворяют в смеси спирта и эфира. После испарения растворителей образуется плотная пленка -- коллодий, применяемый в медицине. Динитроцеллюлоза идет также на производство пластмассы целлулоида. Его получают путем сплавления ди-нитроцеллюлозы с камфорой.
Целлюлоза (клетчатка) -- основное вещество растительных клеток. Древесина на 50% состоит из целлюлозы, а хлопок и лен -- это практически чистая целлюлоза.
Целлюлоза представляет собой твердое волокнистое вещество, нерастворимое в воде, но растворимое в аммиачном растворе гидроксида меди (II) (реактиве Швейцера).
Целлюлоза -- природный полимер. В отличие от крахмала, ее молекулы состоят только из линейных цепей, содержащих остатки р-глюкозы, которые связаны через первый и четвертый углеродные атомы.

Контроль знаний:
1.Какой дисахарид лежит в нашей сахарнице?
2.Почему жизнь на Земле основана на углероде?
3. Какие вещества относятся к углеводам? Как классифицируют углеводы и почему?
4. Какие характерные химические свойства глюкозы и крахмала.
5. Приведите примеры значения углеводов.
6.Составьте уравнение реакций, при которых сахарозу можно превратить в этанол?
7. Изобразите известные вам процессы брожения глюкозы и укажите их практическое значение.
8.Вычислите, какой объём (в л.) оксида углерода (IV) образуется при окислении 0,25 моль сахарозы.
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1. Стр.146-152,153-156,157-161,162-165,пересказ конспекта лекции №13.
Лекция № 15.
Тема: Амины. Понятие об аминах. Анилин как ароматический амин, органическое основание. Взаимное влияние атомов в молекуле анилина: ослабление основных свойств и взаимодействие с бромной водой. Применение анилина на основе свойств.
Аминокислоты. Получение аминокислот из карбоновых кислот и гидролизом белков. Химические свойства аминокислот как амфотерных органических соединений: взаимодействие со щелочами, кислотами и друг с другом (реакция поликонденсации). Пептидная связь и полипептиды. Применение аминокислот на основе свойств.
Белки. Получение белков реакцией поликонденсации аминокислот. Первичная, вторичная и третичная структуры белков. Химические свойства белков: горение, денатурация, гидролиз и цветные реакции. Биохимические функции белков. Генетическая связь между классами органических соединений.
Основные понятия и термины по теме:классификация аминокислот и структуры белков, изомерия. характеристика представителей, химические свойства, качественные реакции.
План изучения темы
(перечень вопросов, обязательных к изучению):
1.Понятие об аминах. Анилин как ароматический амин, органическое основание.
2.Способы получения аминокислот.
3.Химические свойства аминокислот как амфотерных органических соединений.
4.Применение аминокислот.
5.Получение белков реакцией поликонденсации аминокислот
6.Первичная, вторичная и третичная структуры белков.
7.Качественные реакции на белки.
8.Биохимические функции белков.
9.Генетическая связь между классами органических соединений.
Содержание лекции:
Дата добавления: 2018-04-04; просмотров: 1479; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


