Аммиачная буферная система состоит из двух составных частей
Классифицируйте её по составу и природе компонентов.
Укажите интервал значений рН, внутри которого эта система обладает буферной емкостью.
Напишите уравнения реакций, отражающих механизм её действия (ионная форма).
Объясните, почему аммиачная буферная система не входит в состав крови
1.Состав и природа компонентов:
А)NН4ОН (NН3 х Н2О)-гидроксид аммония, слабый электролит
Б) NН4С1 – соль, хлорид аммония, сильный электролит.
Гидроксид аммония - слабый электролит, в растворе частично диссоциирует на ионы:
NН4ОН <=> NН4+ + ОН-
При добавлении к раствору гидроксида аммония хлорида аммония, соль как сильный электролит практически полностью диссоциирует на ионы:
NН4С1 > NН4+ + С1-
и подавляет диссоциацию основания, равновесие которого смещается в сторону обратной реакции.
- Интервал значений рН, внутри которого рассматриваемая система обладает буферной емкостью,рассчитывается по формуле:
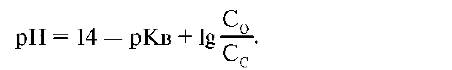 ,
,
гдеКв – константа диссоциации NН4ОН=1,8*10-5, С0-концентрация основания, Сс-концентрация соли.
рН=14-4,74+lg(C0/Cc)=9,26+lg(C0/Cc). В зависимости от соотношения C0/Cc интервал значений рН составляет 8,26-10,26.
- Способность аммиачного буфера поддерживать практически постоянное значение рН раствора основана на том, что входящие в них компоненты связывают ионы Н+ и ОН-, вводимые в раствор или образующиеся в результате реакции, протекающей в этом растворе. При добавлении к аммиачной буферной смеси сильной кислоты, ионы Н+ будут связываться молекулами или гидроксида аммония, а не увеличивать концентрацию ионов Н+ и уменьшать рН раствора:
NH4OH+H+=NH4++H2O
|
|
|
При добавлении щелочи ионы ОН - будут связывать ионы NН4+, образуя при этом малодиссоциированное соединение, а не увеличивать рН раствора:
NH4++ОН-= NH4OH
- Аммиачная буферная система не входит в ТОР РТсостав крови, поскольку интервал значений рН, внутри которого она будет обладать буферной емкостью, находится в щелочной области (рН больше 8). Нормальное значение рН плазмы крови составляет 7,40 ± 0,05, т.е ниже области буферирования.
1. 3) Напишите схему реакции взаимодействия этаналя с метиламином.
Опишите механизм этой реакции.
Обоснуйте роль кислотного катализатора.
Объясните возможность протекания реакции гидролиза полученного имина в кислой и щелочной среде.

2.Механизм этой реакции –нуклеофильное присоединение с последующим отщеплением молекулы воды
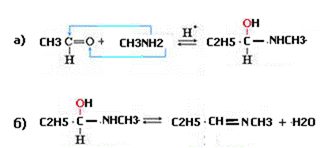
3. Роль кислотного катализатора – протонирование на стадии а)
4. В присутствии разбавленных кислот иминыгидролизуются водой с образованием карбонильных соединений и аминов, эта реакция обратна реакции синтеза иминов:
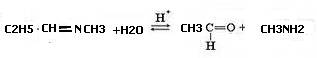
В присутствии щелочи гидролиз не идет
|
|
|
Билет 4.
Термодинамическая система( ТМ) - это любой реальный объект, выделяемый из окружающей среды с целью изучения процессов обмена в-вом и энергией между составляющими его частями, а так же между ним и окружающей средой с помощью термодинамических методов
Классификация термодинамических систем
3. Открытые обмениваются с ОС как веществом, так и энергией(организм, открытый сосуд с кипящей водой)
4. Закрытый–обменивается с ОС только энергией в форме теплоты или работы (газ в закрытом балоне)
5. Изолированные- не обмениваются ни в-вом, ни энергии. В природа абсолютно изолированных нет.
По наличию поверхности раздела внутри ТС
1.Гомогенные – поверхность раздела отсутствует, все компоненты находятся водой фазе, все физические и химическиесв-ва в любой части объема одинаковы (смесь газов)
2. Гетерогенные-содержится поверхность раздела, отделяющие части системы(фазы) различны по св-вам (кровь)
Параметры–величины, определяющие состояния ТС
По возможности непосредственного измерения
Основные параметры-параметры, которые можно измерить с помощью соотв-х приборов (m, V, C,плотность, объем)
Функции состояния - внутренняя энергия E(U);энтальпия (H); энтропия (S); энергия Гиббса (G); свободная энергия или энергия Гельмгольца
|
|
|
Можно определить изменение значений функции состояния
∆X(X2-X1), ГДЕ Х-U,H,S,G,H
Термодинамическое состояние-совокупность значений некоторого числа физ. величин, характеризующих все физ и хм св-ва системы
Виды состояний:
Неравновесное- параметры меняются самопроизвольно(стакан с горячей водой)
Равновесное-параметры не меняются без внешних воздействий
Стационарное=постоянство параметров за счет внешних параметров (присуще жив организмам)
Процесс-переход системы из одного состояния я в другое, сопровождается изменениями термодинамических параметров.
Классификация-
по постоянству параметров:
А)изохорные(v=const)
B)Изобарные (давление- const)
C)изотермические( температура =const)
По знаку тепловому эффекта:экзотермические и эндотермические
По затрате Энергии: самопроизвольные, несамопроизвольные
По хар-ку протекания:-обратимые – протекают в прямом и обратном направлениях через одни и те же стадии, без изменений в окруж. среде.
-необратимые – все процессы не могут протекать в прямом и обратном направлениях через 1 и те же стадии.
Дата добавления: 2018-02-28; просмотров: 5889; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
