ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ РАСТЕНИЙ
Традиционные методы селекции и методика слияния протопластов позволяют получать новые генотипы растений, и в этом смысле указанные методы можно отнести к генно-инженерным. Однако новые генетические комбинации, возникающие случайным образом, требуют много труда, времени и терпения, чтобы получить желаемое изменение фенотипа, как результат реорганизации генетического материала. Кроме того, скрещивание происходит между ограниченным числом генотипов, и общий генофонд оказывается ограниченным. В этом генофонде может вообще не содержаться генов, которые могли бы улучшить сорт.
Технология рекомбинантных ДНК в принципе позволяет выделять в чистом виде и в достаточном количестве любой ген и при наличии подходящего вектора или иным способом встраивать этот ген (или гены) в состав хромосомной ДНК и добиться его экспрессии. Мы будем рассматривать генетическую инженерию в плане использования технологии рекомбинантных ДНК для создания новых генотипов, а значит, и форм растений. Применение этой технологии делает поиск целенаправленным и значительно расширяет возможности манипулирования генетическим аппаратом при сокращении времени получения новых форм растений.
Важным преимуществом растений по сравнению с животными является то обстоятельство, что клетки растений в культуре обладают свойством тотипотентности, т. е. при наличии
|
|
|
7-177193
|
|
подходящих условий по крайней мере часть клеток может развиться в целое растение. Таким же свойством обладают и растительные протопласты — клетки, лишенные целллюлозной оболочки.
Какие же гены нужно клонировать и вводить в растения, чтобы их улучшить? Наиболее целесообразно приобретение следующих признаков: устойчивость к холоду, засухе, повышенной засоленности почвы, т. е. к стрессовым воздействиям внешней среды, также полезна устойчивость к вредителям, гербицидам и пестицидам, резистентность к болезням, скороспелость и др. Определение и выделение генов, ответственных за эти признаки,— задача чрезвычайно трудная. Дело осложняется еще и тем, что геном растений изучен хуже, чем геном млекопитающих.
Другая проблема связана с введением и адекватной экспрессией генов. Здесь основная задача связана с созданием векторных молекул и с разработкой метода прямого переноса генов. Сюда же входит задача отбора трансформированных клеток и обеспечение стабильного наследования приобретенного признака. Решение этих задач существенно облегчается в связи с обнаружением природного генного вектора, возникшего в результате эволюции почвенных бактерий.
|
|
|
Наконец, третья проблема касается регенерации трансформированных клеток или протопластов в целое фертильное растение. Дело в том, что регенерацию удалось получить для двудольных растений. Только для некоторых хозяйственно полезных растений удалось наладить методический цикл от протопласта до растения. Это картофель, люцерна, томаты, морковь, табак, капуста и др. Что же касается злаков, то регенерацию их клеток пока надежно осуществить не удалось.
Мы перечислили основные проблемы, которые «лежат на поверхности», и трудно предсказать, какое множество препятствий встанет на пути исследователей.
Векторы на основе Ті-плазмид. Некоторые виды бактерий из группы агробактерий (Agrobacteria) могут заражать растения и вызывать при этом образование опухолей — корончатых галлов. Опухоли состоят из недифференцированных клеток, интенсивно делящихся и растущих в месте заражения. Почти все двудольные растения чувствительны к бактериям, а злаки и другие однодольные — нет. При культивировании клетки опухоли могут расти в отсутствие гормонов, необходимых для роста нормальных растительных клеток. Если убить все бактерии антибиотиком, то клетки корончатых галлов сохраняют трансформированный фенотип. На примере одного из самых сильных индукторов опухолей — Agrobacteriumtumefaciense— было пока-
|
|
|
194
зано, что собственно опухолеродным агентом является плазмида, часть которой встречается в хромосомах клеток растения (рис. 3.17).
После трансформации клетки растения начинают синтезировать необычные аминокислоты — опины, которые используются бактериями в качестве источника азота и углерода. Таким образом образование опухоли сопровождается перестройкой метаболизма клеток, и они начинают синтезировать соединения, необходимые только для бактерий.
Плазмиды, вызывающие опухоли, называются Ті-плазмидами (от англ. tumorinducing — инициирующие опухоль). Это кольцевые молекулы длиной около 200 кб (3—5% от размера хромосомы агробактерий). В бактериальных клетках они реплицируются автономно. Ті-плазмиды различают по типу синтезируемого опина. Чаще всего встречаются плазмиды, кодирующие нопалин или октопин, причем клетка может содержать только один тип плазмиды: либо октопиновую, либо нопалиновую.
Генетические исследования показали, что гены, ответственные за индукцию опухоли, синтез опинов и подавление дифференцировки, расположены близко друг от друга и входят в состав Ті-области плазмиды, которая встраивается в хромосому клетки при инфекции. Т-сегмент имеет длину около 20 кб (10% Ті-плазмиды) и встраиваются в различные, по-видимому неспецифичные, области хромосомы. На Т-области картировано семь генов, каждый из которых регулируется собственным промотором. Эти гены отвечают за синтез опина и за подавление дифференцировки клеток (подавление образования корней и побегов). Важно отметить, что все гены, ответственные за перенос и
|
|
|
195
|
|
|
|
интеграцию Т-ДНК, находятся не в Т-ДНК, а в области вирулентности (vir-область) (рис. 3.18).
Уникальные биологические свойства Ті-плазмиды делают его идеальным вектором, естественным агентом для переноса генов. Она имеет широкий круг хозяев, встраивает ДНК. в состав хромосомы, где она реплицируется и большая ее часть транслируется с образованием белка. Существенно также, что границы Т-ДНК обозначены прямыми повторяющимися последовательностями длиной 25 нуклеотидных пар, и любая ДНК, вставленная между этими повторами, будет принята за Т-ДНК и перенесена в растительную клетку. Поскольку гены в составе К-ДНК имеют промоторы, то под их контроль можно поставить чужеродные гены. Однако из-за больших размеров манипуляции с Ті-плазмидой затруднены, вставить ген в плазмиду традиционными методами не представляется возможным.
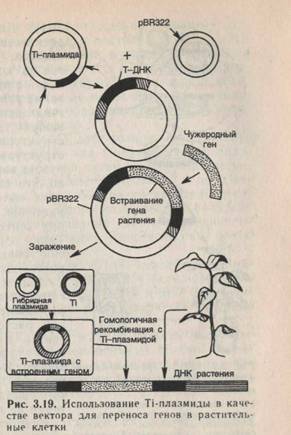
Промежуточный и бинарный векторы. Один из способов введения чужеродной ДНК заключается в использовании промежуточного вектора. Смысл подхода состоит в следующем (рис. 3.19). Сначала Т-ДНК с помощью рестриктаз вырезают из плазмиды и вставляют в вектор для клонирования в Е. coli(например, pBR 322). Плазмиду с Т-ДНК размножают и, используя стандартные методы, встраивают чужеродный ген внутрь Т-области и вновь размножают с уже вставленным геном. Затем полученную рекомбинантную плазмиду вводят в клетки А. tumefacien . ee , несущие полную Ті-плазмиду. В результате двойного кроссинговера (гомологичной рекомбинации) между гомологичными районами Т-ДНК часть рекомбинантной плазмиды, которая содержит чужеродный ген, включится в Ті-плазмиду, заместив в ней нормальную Т-ДНК. Наконец, бактериями, имеющими Ті-плазмиду со встроенными генами, заражают растения и в результате получают клетки корончатого галла, которые будут содержать Т-область со встроенным в нее чужеродным геном.
196
Другой распространенный метод введения чужеродной генетической информации заключается в использовании бинарных векторов. Оказалось, что для заражения и трансформации растительных клеток агробактериями необходима vir-область, ответственная за перенос ДНК и прямые повторы, ограничивающие Т-район. Более того, vir-область и ДНК, содержащая на концах пограничные повторы Т-района, могут находиться в разных плазмидах. Бактерии, содержащие Ті-плазмиду с vir-областью и другую плазмиду, в которой в Т-ДНК встроены любые гены, обеспечивают интеграцию последней в геном растения. Гомологичная рекомбинация для этого не требуется.
Однако полученные клетки не будут способны к регенерации, поскольку в них подавлена дифференцировка. Если же в гены, блокирующие дифференцировку, ввести мутации или вырезать их из Т-ДНК, трансформированные клетки обретут способность к регенерации. Так, ген алкогольдигидрогеназы (АДГ) дрожжей был встроен в область клонированной Т-ДНК, ответственную за подавление дифференцировки. Этой Т-ДНК трансформировали клетки табака, из которых затем удалось регенерировать целые растения, содержащие в геноме многочисленные копии АДГ —Т-ДНК. Растения были фертильными и в клетках потомства также содержались копии химерной ДНК (рис. 3.20).
В общем случае для конструирования безвредного (для регенерации) вектора из Т-ДНК нужно удалить все ее собственные гены, оставив сигнальные прямые повторы и чужеродную
197
|
|
ДНК. Для того чтобы эта ДНК экспрессировалась в растительных клетках, конструируют составной ген, в котором регуляторная область с промотором взята от одного из генов Т-области (например, гена нопалинсинтетазы, ответственного за синтез нопалина), а структурная часть представлена структурной частью гена, который нужно ввести в растение. Показано, что такие составные гены, будучи интегрированными в геном растения, хорошо экспрессируются под контролем нового промотора. Таким образом, проблема экспрессии генов в трансформированных растениях в принципе решена.
Еще одно семейство плазмид А. rhizogenesвызывает усиленное образование корешков при заражении растений. Эти плазмиды названы Ri-плазмидами (от англ. rootinducing—индуцирующий корни). Корешки быстро растут в культуре, подобно ткани корончатого галла, причем отсутствие бактерий не влияет на их рост. Выяснилось, что клетки корешков также содержат опины, а их геномы содержат по нескольку копий Т-ДНК. Ri-плазмиды выгодно отличаются от Ті-плазмид тем, что они являются естественными безвредными векторами, т. е. после трансформации растительные клетки способны регенерировать в здоровые плодовитые растения. В настоящее время эти плазмиды рассматриваются как более перспективные векторы.
Векторы на основе ДНК-содержащих вирусов растений. Подавляющее большинство фитовирусов в качестве носителя генетической информации содержат РНК- Лишь 1—2% от числа вирусов, инфицирующих растения, относятся к ДНК-содер-жащим. Именно они наиболее удобны для использования в технологии рекомбинантных ДНК и рассматриваются главными кандидатами на роль векторов для переноса генов в растения.
198
Наиболее перспективным в этом отношении и поэтому лучше изученным является вирус мозаики цветной капусты CaMV (cauliflowermozaicvirus), поражающий в основном растения семейства крестоцветных. Частицы этого вируса имеют диаметр около 50 нм и содержат кольцевую ДНК длиной 8 кб. С вирионной-ДНК транскрибируются не менее 80% информации, и, по крайней мере, некоторые из образовавшихся РНК являются матрицами для синтеза белков.
Небольшой размер генома CaMV дает возможность манипулировать invitro с вирусной ДНК, как с бактериальной плазмидой, и затем вводить ее в растения путем втирания в листья. Инфицирование небольшого числа клеток приводит к заражению всего растения, так как вирус быстро распространяется, передаваясь от клетки к клетке. При использовании 1—5 мкг клонированной ДНК для инфицирования одного растения посредством механической инокуляции достигается почти 100%-ная эффективность инфекции.
Для клонирования ДНК CaMV в Е. coliиспользуют плазмидные векторы Е. coli , например, pBR 322. После обработки соответствующими рестриктазами ДНК CaMV и pBR 322 и лигирования образуется гибридная плазмида, способная к амплификации в Е. coli .
Прямая интеграция ДНК CaMV в геном хозяина после инфекции не показана. Разработан методический прием — агро-инфекция, позволяющий осуществить прямое встраивание вирусной ДНК после инокуляции. Для этого геном CaMV встраивается в Т-ДНК и в ее составе интегрирует в ядерный геном различных растений.
К преимуществам векторных систем на основе вирусов можно отнести следующие: малый размер генома, что дает возможность легко манипулировать вирусной ДНК; высокая ко-пийность вирусной ДНК в клетках зараженных растений (до 50 000 на клетку); наличие сильных промоторов, которые могут обеспечить эффективную экспрессию чужеродных генов.
Среди недостатков следует отметить небольшую емкость вектора (менее 800 н. п.) и ограниченный круг хозяев — крестоцветные. Емкость вектора можно увеличить до 800—1000 н. п., если инфицировать вирусом растительные протопласты. В этом случае инфекция не передается от клетки к клетке и нет необходимости в упаковке ДНК в частицы. Таким образом, часть вирусного генома, ответственная за упаковку в вирусные частицы, может быть удалена и замещена чужеродной ДНК.
В заключение следует отметить, что сильные вирусные промоторы могут использоваться для экспрессии чужеродных ге-
199
нов в других векторных системах. Например, промотор 35S РНК вируса мозаики цветной капусты является сильным промотором, кроме того, он не проявляет тканеспецифичности экспрессии и активен не только в клетках крестоцветных, но и в клетках других семейств.
Использование хлоропластной и митохондриальной ДНК растений для создания челночных векторов. Геном хлоропласта состоит из кольцевых молекул ДНК длиной 120—140 кб. Внутри хлоропластов одного вида содержится до нескольких десятков таких кольцевых молекул, близких по нуклеотидной последовательности. Клетка содержит до нескольких десятков хлоропластов, и, таким образом, общее число кольцевых молекул составляет несколько сот копий на клетку. В состав кольцевых молекул входят гены рибосомальных и транспортных РНК, а также гены, продукты которых необходимы для функционирования хлоропластов.
Репликация и транскрипция хлоропластного генома осуществляется автономно. Последнее обстоятельство дает возможность использовать хлоропластную ДНК в качестве вектора. Если же «сшить» бактериальную плазмиду с фрагментом ДНК хлоропласта, содержащим участки начала репликации и участки инициации и терминации транскрипции, то можно получить челночный вектор. Такой вектор способен реплицироваться в прокариотических клетках, а в клетках эукариот не только реплицироваться, но и экспрессировать чужеродную генетическую информацию. Такие векторы будут функционировать как эпи-сомы, т. е. автономно от хромосомы. Для конструирования челночных векторов растений могут быть также использованы кольцевые молекулы митохондриальной ДНК, длина которых варьирует в широких пределах — от 1 до 50 кб.
Кольцевые молекулы ДНК также обнаружены в ядре и цитоплазме растительных клеток. Происхождение их еще не ясно. Это могут быть амплифицированные гены или транспозоно-по-добные элементы. Эти кольцевые молекулы интенсивно изучаются и, по-видимому, могут быть использованы для создания векторов.
Методы прямого переноса генов в растение. Трансформациярастительныхпротопластов.При обработке целлюлозной клеточной стенки растения ферментом цел-люлазой, выделенной из грибов, образуется клетка, лишенная оболочки, или протопласт. Разработаны методы прямой трансформации протопластов с помощью ДНК. Наибольшей эффективности трансформации (10" ) удалось достигнуть комбинацией методики кальциевой преципитации ДНК с методикой слия-
200
ния протопластов. Хотя частота трансформации значительно ниже, чем, например, частота переноса ДНК при совместном культивировании с A . tumefaciens , метод прямого переноса обладает рядом преимуществ.
Донорная ДНК может не содержать специальных биологических сигналов и функций трансформации (пограничных областей Т-ДНК и vir-области, см. с. 196). Для трансформации может быть использован практически любой ДНК-вектор, несущий чужеродный ген. При этом, гибридный ген стабильно интегрирует в ядерную ДНК растения и экспрессируется (при наличии соответствующих регуляторных областей).
Методкокультивации.Этот метод может рассматриваться как индукция опухолей в искусственных условиях. Сначала получают культуру протопластов, затем на начальной стадии ее роста, когда протопласты только что регенерировали клеточную стенку и начали делиться, культуру заражают агро-бактериями. Период кокультивации, в течение которого протопласты агрегируют с бактериями, составляет 32 ч.
Модификация метода кокультивации протопластов с А. tumefacienseпозволила повысить его эффективность (до 10-1) и сократить время получения трансформантов до трех недель. При этом в качестве селективного признака использовали то обстоятельство, что только трансформированные клетки способны расти без добавок фитогормонов.
МикроинъекцииДНК.В ряде экспериментов было показано, что метод микроинъекций может успешно применяться для трансформации растительных клеток аналогично микроинъекциям животных клеток (см. с. 189). Это стало возможным после преодоления ряда технических трудностей, в частности, разработки метода получения протопластов для инъекций путем прикрепления их к стеклам полилизином.
Для микроинъекций применяется микроигла с внешним диаметром 2 мкм и внутренним 1 —1,25 мкм. Объем инъекций в каждый протопласт составляет (1 —10)* 10-4 мл, при концентрации ДНК — 0,1 —1,0 мкг/мкл.
Трансформация растительных клеток происходит с эффективностью 10—20%, независимо от типа вектора. В этом смысле метод можно рассматривать как наиболее универсальный. Важно также, что трансформация не является видоспецифич-ной, и ее можно применять, когда другие способы переноса генов невозможны (например, агробактерии имеют ограниченный круг хозяев). Многие исследователи полагают, что микроинъекции пригодны для всех типов растений.
201
Э л е к т р операция.Этот метод основан на том, что импульсы высокого напряжения обратимо увеличивают проницаемость биомембран. Для растительных протопластов процедура электропорации оказалась очень эффективной. Метод состоит в следующем: на растительные протопласты в высоких концентрациях, находящиеся в среде электропорации, содержащей ДНК, действуют высоковольтным импульсом. В результате молекулы ДНК поглощаются клетками через поры в клеточной мембране. Далее после разведения протопласты высеваются на соответствующую среду для проращивания. Эффективность переноса определяется через 24—48 ч после электрошока (напряжение 200—350 В, длительность импульса 54 мс).
При переносе электропорацией удалось получить экспрессию чужеродных генов. Она показана на двух типах промоторов— NOS (нопалинсинтетазного) промотора Ті-плазмиды А. tumefaciens , под контролем которого экспрессировалась хлорамфениколацетилтрансфереза (CAT), и З5S-поромотора вируса CaMV.
Упаковкав липосомы. Это один из методов, используемых для защиты экзогенного генетического материала, который вводится в протопласты растений, от разрушающего действия нуклеаз.
Экзогенный генетический материал, вводимый в протопласты растений, нуждается в надежной защите от действия ферментов — нуклеаз, которые разрушают нуклеиновые кислоты. Один из методических подходов заключается в использовании липосом. Липосомы — это сферические образования, оболочки которых состоят из фосфолипидов. Их можно получить в результате резкого встряхивания или обработки ультразвуком водных эмульсий фосфолипидов. Липосомы, состоящие из фос-фатидилсерина и холестерина, наиболее пригодны для введения ДНК в клетки животных и растений.
С помощью липосом в протопласты растений были введены РНК вируса табачной мозаики, ДНК Ті-плазмиды А. tumefaciens , а также целые метафазные хромосомы. Особенно важно для системы переноса в протопласты растений то, что липосомы надежно защищают молекулы нуклеиновых кислот от действия нуклеза, присутствующих в значительных количествах вне клеток. К преимуществам систем переноса с помощью липосом можно отнести их низкую токсичность по отношению к клеткам и возможность их использования на множестве растений, клетки которых способны утилизировать липосомы.
В заключение следует подчеркнуть, что дальнейшее совершенствование методов прямого переноса генов в существенной
202
степени зависит от роста эффективности трансформации клеток. К настоящему времени эффективность прямого переноса генов в протопласты повысилась в 100 раз по сравнению со временем первых сообщений. Без селекции 2% всех колоний подвергаются трансформации.
Метод биологической баллистики. Метод биологической баллистики (биолистики) является одним из самых эффективных на сегодняшний день методов трансформации однодольных. В качестве исходного материала для трансформации берется суспензионная культура, каллусная ткань или 4—5-дневные культивируемые незрелые зародыши однодольных.
Суть метода заключается в том, что на мельчайшие частички вольфрама, диаметром 0,6—1,2 мкм, напыляется ДНК вектора, содержащего необходимую для трансформирования генную конструкцию. Вольфрамовые частички, несущие ДНК, наносятся на целлофановую подложку и помещаются внутрь биолистической пушки. Каллус или суспензия клеток наносится в чашку Петри с агаризированной средой и помещается под биолистическую пушку на расстоянии 10—15 см. В пушке вакуумным насосом уменьшается давление до 0,1 атм. В момент сбрасывания давления вольфрамовые частички с огромной скоростью выбрасываются из биолистической пушки и, разрывая клеточные стенки, входят в цитоплазму и ядро клеток. Обычно клетки, располагающиеся непосредственно по центру, погибают из-за огромного количества и давления вольфрамовых частиц, в то время как в зоне 0,6—1 см от центра находятся наиболее удачно протрансформированные клетки. Далее клетки осторожно переносят на среду для дальнейшего культивирования и регенерации.
С помощью биолистической пушки были протрансформиро-ваны однодольные растения, такие, как кукуруза, рис, пшеница, ячмень. При этом были получены стабильные растения-трансформанты.
Кроме успехов в получении трансгенных однодольных, био-листическая трансформация применяется для прямого переноса ДНК в эмбриогенную пыльцу и дальнейшего быстрого получения трансгенных дигаплоидных растений, которые являются важным этапом в селекционной работе. В настоящее время этим методом была проведена трансформация растений табака и после регенерации гаплоидных растений получены стабильные трансформанты.
203
Дата добавления: 2021-01-20; просмотров: 756; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!