Атомная кристаллическая решётка
Ковалентные связи могут приводить к образованию веществ не молекулярного, а атомного строения, т. е. веществ с атомной кристаллической решёткой. Это такие решётки, в узлах которых располагаются отдельные атомы, соединённые между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллической решётки может служить аллотропная модификация углерода — алмаз (рис. 11).
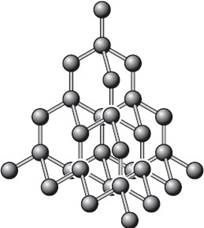
Рис. 11. Атомная кристаллическая решётка алмаза
| Аллотропия — это существование одного и того же химического элемента в виде двух или нескольких простых веществ; может быть обусловлена образованием молекул с различным числом атомов либо образованием кристаллов различных модификаций. |
Необычайная твёрдость алмаза по особой шкале твёрдости веществ (как вы помните, она называется шкалой Мооса) оценена самым высоким значением — 10. Благодаря высокой твёрдости алмаз используется для изготовления буров, свёрл, шлифовальных инструментов, стеклорезов, хотя в сознании большинства это камень ювелиров, которые используют отшлифованные алмазы, называемые бриллиантами (рис. 12).

Рис. 12. Большая императорская корона российских монархов с 4936 бриллиантами весом в 2858 каратов
В России особую пышность и блеск приобрели бриллиантовые украшения при Екатерине II. Достаточно вспомнить портрет члена государственного совета «бриллиантового князя» А. Б. Куракина работы В. Боровиковского (рис. 13).
|
|
|

Рис. 13. В. Л. Боровиковский. Портрет вице-канцлера князя А. Б. Куракина. 1801—1802
...Под ним Казбек, как грань алмаза, Снегами вечными сиял...
/М. Лермонтов/
Массу драгоценных камней выражают в особых единицах — каратах. Откуда взялась эта странная единица? В пустынных районах Аравийского полуострова растёт удивительное дерево под названием царьградский рожок — по-латыни caratina silikva. Косточки плодов этих деревьев всегда имеют одну и ту же массу — 0,2 г. Именно с помощью этих косточек ювелиры и взвешивали драгоценные камни, а единицу их массы назвали каратом — по латинскому наименованию дерева.
В атомной кристаллической решётке другой аллотропной модификации углерода — графита (рис. 14) — атомы, лежащие в одной плоскости, прочно связаны в правильные шестиугольники. Связи между слоями непрочны, поэтому графит мягок. Но, так же как алмаз, он тугоплавок. Из графита изготавливают электроды, твёрдые смазки, стержни для карандашей, замедлители нейтронов в ядерных реакторах.
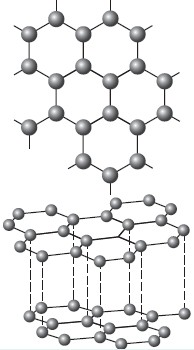
Рис. 14. Атомная кристаллическая решётка графита
Атомные кристаллические решётки имеют не только простые, но и сложные вещества. Например, все разновидности оксида алюминия: наждак, корунд, рубин (рис. 15), сапфир.
|
|
|

Рис. 15. Рубиновая звезда на Боровицкой башне Московского Кремля (а всего их пять — на Боровицкой, Троицкой, Спасской, Никольской и Водовзводной башнях)
Наиболее распространённое в неживой природе соединение с атомной кристаллической решёткой — это оксид кремния (IV). Почти чистым диоксидом кремния является широко распространённый минерал кварц (рис. 16), встречающийся как в магматических, так и метаморфических породах (особенно в гранитах и гнейсах). Чистый кварц прозрачен и бесцветен.

Рис. 16. Кварц: а — атомная кристаллическая решётка; б —кристаллы природного кварца — горного хрусталя
Нередко встречаются окрашенные за счёт наличия примесей кристаллы розового, жёлтого, молочного, дымчатого цвета. По внешнему виду кристаллы кварца легко отличить от других минералов — шестигранная призма заканчивается трёхгранной пирамидой (рис. 16, б). Области применения кварца очень разнообразны. Чистый кварц используют при создании микросхем в радиоэлектронике, в косметологии, для создания строительных материалов (кварцевый песок — одна из составляющих бетона), разные виды минерала нашли поклонников среди ювелиров.
В следующем параграфе мы поговорим о металлической химической связи и её особенностях, о кристаллическом строении металлов и сплавов.
|
|
|
Теперь вы знаете
- каков механизм образования ковалентной связи
- что такое электроотрицательность
- какие вещества образуют молекулярную кристаллическую решётку
- какие вещества образуют атомную кристаллическую решётку
Теперь вы можете
- объяснить, как образуется ковалентная химическая связь
- дать формулировку электроотрицательности, записать ряд важнейших неметаллов в порядке увеличения их электроотрицательности
- назвать два типа кристаллических решёток, характерных для веществ с ковалентной связью, привести примеры таких веществ
Выполните задания
1. Объясните, что такое кристаллическая решётка вещества.
2. Запишите схему образования ковалентной связи для молекулы воды.
3. Сформулируйте, какая ковалентная связь называется полярной, какая — неполярной, чем они отличаются.
4. Объясните, можно ли говорить об ионной связи как о разновидности ковалентной. Аргументируйте свой ответ.
5. Дайте характеристику таких модификаций углерода, как алмаз и графит, с точки зрения их строения и свойств.
6. Сравните ионную кристаллическую решётку с молекулярной и атомной.
|
|
|
7. Перечислите основные месторождения алмазов в нашей стране и в мире в целом.
Темы для рефератов
1. Сравнительная характеристика веществ с молекулярной и атомной кристаллическими решётками на примере твёрдого углекислого газа и графита (Маслова).
2. Алмаз как минерал, одна из кристаллических модификаций углерода (Тихонова).
3. История знаменитого алмаза «Шах» (или «Эксельсиор», или «Куллинан») - Некрасов.
4. Драгоценные камни (алмазы, рубины, сапфиры) в искусстве, литературе, музыке, кинофильмах. - Никишина
Вторая тема занятия сегодня: Составление структурных и электронных формул соединений с ковалентной химической связью.
Формулы ковалентных связей
Формулы для ковалентных связей в корне отличаются от формул для ионных связей. Дело в том, что ковалентные соединения могут образовываться самыми разными способами, поэтому в результате реакции возможно появление различных соединений.
Эмпирическая формула
В эмпирической формуле указываются элементы, из которых состоит молекула, с наименьшим целочисленными соотношениями.
Например, C2H6O - соединение содержит два атома углерода, шесть атомов водорода и один атом кислорода.
Молекулярная формула
Молекулярная формула указывает из каких атомов состоит соединение и в каких количествах эти атомы в нем находятся.
Например, для соединения C2H6O молекулярными формулами могут быть: C4H12O2; C6H18O3...
Для полного описания ковалентного соединения молекулярной формулы недостаточно:

Как видим, оба соединения имеют одинаковую молекулярную формулу – C2H6O, но являются совершенно разными веществами:
· диметиловый эфир применяется в холодильных установках;
· этиловый спирт - основа алкогольных напитков.
| Изомеры – соединения, обладающие одним и тем же качественным и количественным составом, но разными свойствами |
Структурная формула
Структурная формула служит для точного определения ковалентного соединения, т.к., кроме элементов в соединении и количества атомов, показывает еще и схему связей соединения.
В качестве структурной формулы используют электронно-точечную формулу и формулу Льюиса.
4. Структурная формула для воды (H2O)
Рассмотрим порядок построение структурной формулы на примере молекулы воды.
I. Строим каркас соединения
Атомы соединения располагаются вокруг центрального атома. В качестве центральных обычно выступают атомы: углерода, кремния, азота, фосфора, кислорода, серы.

Дата добавления: 2020-12-22; просмотров: 494; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
