Многостадийность, обратимость
 |

 Другая особенность биохимических процессов, протекающих в организме, заключается в их многостадийности, так как вероятность обратимого протекания отдельной стадии значительно выше, чем всего процесса в целом (рис. 2). Это объясняется тем, что разница между величинами Gнач и Gкон для каждой отдельной стадии обычно невелика (| Gр| 10 Дж/моль). Обратимость отдельных стадий биохимических процессов позволяет живому организму легко регулировать синтез тех или иных соединений в зависимости от потребности и тем самым поддерживать стационарное состояние. Вероятность прямой реакции тем больше, чем больше уменьшение энергии Гиббса.
Другая особенность биохимических процессов, протекающих в организме, заключается в их многостадийности, так как вероятность обратимого протекания отдельной стадии значительно выше, чем всего процесса в целом (рис. 2). Это объясняется тем, что разница между величинами Gнач и Gкон для каждой отдельной стадии обычно невелика (| Gр| 10 Дж/моль). Обратимость отдельных стадий биохимических процессов позволяет живому организму легко регулировать синтез тех или иных соединений в зависимости от потребности и тем самым поддерживать стационарное состояние. Вероятность прямой реакции тем больше, чем больше уменьшение энергии Гиббса.
Рис. 3. Изменение энергии Гиббса в многостадийном биохимическом процессе (р, Т = const)
Гомеостаз
В живых организмах некоторые процессы и реакции протекают в условиях, близких к равновесным (например, протолитиче- ские, гетерогенные, лигандообменные, окислительно-восстано- вительные, адсорбционные). В связи с этим в организме под- держиваются различные балансы: кислотно-основной, гетеро- генный, лигандообменный, окислительно-восстановительный, что в целом и определяет гомеостаз.
 Обучающие тесты с решением
Обучающие тесты с решением
1.  Если система обратимым образом получает количество теплоты Q при температуре Т, то об энтропии системы можно сказать, что она …
Если система обратимым образом получает количество теплоты Q при температуре Т, то об энтропии системы можно сказать, что она …
1) возрастает на величину Q T
2) возрастает на величину Q/T
3) возрастает на величину, большую Q/T
4) возрастает на величину, меньшую Q/T
Ответ: Энтропия – это приведенная теплота: S = Q/T. В соответст- вии со II началом термодинамики для необратимого самопроиз- вольного процесса в изолированной системе энтропия возрастает, т.е. ΔS > Qнеобр./Т.
При обратимом процессе в изолированной системе энтропия оста- ется постоянной, т.е. ΔS = Qобр./Т.
Правильный ответ 2.
2. Укажите, в каких процессах и при каких условиях изменение эн- тропии может быть равно работе процесса?
1) в изобарных, при постоянных Р и Т
2) в изохорных, при постоянных V и Т
3) изменение энтропии никогда не равно работе
4) в изотермических, при постоянных P и V
Ответ: Энтропия характеризует ту часть энергии, которую нельзя превратить в работу (связанная энергия), и отражает стремление системы к максимуму беспорядка. Поэтому ни для каких процессов изменение энтропии не может быть равно работе.
Правильный ответ 3.
3. 
 Если Н < 0 и < 0, то в каком случае реакция может проте-
Если Н < 0 и < 0, то в каком случае реакция может проте-




 кать самопроизвольно?
кать самопроизвольно?
| 1) [ H] > [T S] | 3) [ Н] < [T | S] | ||
| 2) при любых соотношениях | Н и Т | S | 4) [ Н] = [T | S] |
 Ответ: При постоянстве температуры и давления химические ре- акции могут самопроизвольно протекать только в таком направле- нии, при котором энергия Гиббса системы уменьшается (ΔG < 0). В изобарно-изотермических условиях изменение энергии Гиббса равно: ΔG = ΔH – T ΔS.
Ответ: При постоянстве температуры и давления химические ре- акции могут самопроизвольно протекать только в таком направле- нии, при котором энергия Гиббса системы уменьшается (ΔG < 0). В изобарно-изотермических условиях изменение энергии Гиббса равно: ΔG = ΔH – T ΔS.

 Если ΔH < 0 и ΔS < 0, то реакция возможна при условии, что ΔH больше по абсолютной величине, чем T ΔS ( |ΔH| > |T ΔS| ).
Если ΔH < 0 и ΔS < 0, то реакция возможна при условии, что ΔH больше по абсолютной величине, чем T ΔS ( |ΔH| > |T ΔS| ).
Правильный ответ 1.
4. 
 При каких соотношениях Н и Т химический процесс на-
При каких соотношениях Н и Т химический процесс на-
правлен в сторону эндотермической реакции:
1)  Н < T
Н < T
2) Н > Т
3) Н = Т
4) Н Т



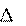


 Ответ: Для ответа на вопрос воспользуется предыдущими рассу- ждениями. Для самопроизвольного протекания процесса необходи- мо, чтобы энергия Гиббса системы уменьшалась, ΔG < 0. Для эндо- термических процессов ΔH > 0, поэтому такие процессы будут идти самопроизвольно, если энтропия системы будет увеличиваться, т.е.
Ответ: Для ответа на вопрос воспользуется предыдущими рассу- ждениями. Для самопроизвольного протекания процесса необходи- мо, чтобы энергия Гиббса системы уменьшалась, ΔG < 0. Для эндо- термических процессов ΔH > 0, поэтому такие процессы будут идти самопроизвольно, если энтропия системы будет увеличиваться, т.е.
|ΔH| < |T ΔS|.
Правильный ответ 1.
5. 
 Для процесса тепловой денатурации многих ферментов Н > 0 и
Для процесса тепловой денатурации многих ферментов Н > 0 и

 > 0. Может ли данный процесс протекать самопроизвольно?
> 0. Может ли данный процесс протекать самопроизвольно?
1) может при высоких температурах, так как |Т S| > | Н|
2) 
 может при низких температурах, так как |Т S| < | Н|
может при низких температурах, так как |Т S| < | Н|
3) не может, так как |Т S| > | Н|
4) не может, так как |Т S| < | Н|


 Ответ: Для самопроизвольного протекания реакции, необходимо, чтобы энергия Гиббса системы уменьшалась, ΔG < 0. Поскольку ΔH > 0 и ΔS > 0, то из уравнения: ΔG = ΔH – T ΔS, следует, что при низких температурах значение T ΔS мало и знак ΔG определяется знаком ΔH. Так как процесс эндотермический ΔH > 0, то самопро- извольно реакция будет протекать только при высокой температу- ре. В этом случае |T ΔS| > |ΔH|.
Ответ: Для самопроизвольного протекания реакции, необходимо, чтобы энергия Гиббса системы уменьшалась, ΔG < 0. Поскольку ΔH > 0 и ΔS > 0, то из уравнения: ΔG = ΔH – T ΔS, следует, что при низких температурах значение T ΔS мало и знак ΔG определяется знаком ΔH. Так как процесс эндотермический ΔH > 0, то самопро- извольно реакция будет протекать только при высокой температу- ре. В этом случае |T ΔS| > |ΔH|.
Правильный ответ 1.
 Обучающие задачи с решением
Обучающие задачи с решением
1.  По стандартным энтальпиям образования реагирующих веществ и продуктов реакции вычислите значение энтальпии реакции гид- ролиза мочевины, одного из важнейших продуктов жизнедеятель- ности организма:
По стандартным энтальпиям образования реагирующих веществ и продуктов реакции вычислите значение энтальпии реакции гид- ролиза мочевины, одного из важнейших продуктов жизнедеятель- ности организма:
СО(NH2)2(водн.) + Н2О(ж) СО2(водн.) + 2NH3(водн.)
Решение:
По таблице термодинамических величин (табл. 2 приложения) на- ходим значения стандартных энтальпий образования всех веществ, участвующих в реакции:
 Но (СО
Но (СО
) = 413,6 кДж/моль;
 обр 2
обр 2
Но (NH
) = 79,9 кДж/моль;
 обр 3
обр 3
Но (СО(NH ) ) = 319,2 кДж/моль;
 обр 2 2
обр 2 2
Но (H O) = 286 кДж/моль.
обр 2




 Для решения используем 1-е следствие из закона Гесса:
Для решения используем 1-е следствие из закона Гесса:

|
|
Нор-ции= [–413,6 + 2 (–79,9)] – [(–319,2) – (–286)] = +31,8 кДж/моль.
Ответ: энтальпия реакции гидролиза мочевины до оксида углеро- да(IV) и аммиака равна +31,8 кДж/моль, процесс эндотермический.
2.  Определите тепловой эффект реакции образования диэтилового эфира, применяемого в медицине для наркоза, по стандартным эн- тальпиям сгорания веществ, участвующих в реакции:
Определите тепловой эффект реакции образования диэтилового эфира, применяемого в медицине для наркоза, по стандартным эн- тальпиям сгорания веществ, участвующих в реакции:
2С2Н5ОН(ж) С2Н5ОС2Н5(ж) + Н2О(ж).
Решение:
 По таблице термодинамических величин находим значения стан- дартных энтальпий сгорания:
По таблице термодинамических величин находим значения стан- дартных энтальпий сгорания:
 Но (С Н ОС Н ) = 2727 кДж/моль;
Но (С Н ОС Н ) = 2727 кДж/моль;
 сгор 2 5 2 5
сгор 2 5 2 5
Но (С Н ОН) = 1371 кДж/моль;
сгор 2
Но (Н
5
О) = 0 кДж/моль.
сгор 2

 Для решения используем 2-е следствие из закона Гесса:
Для решения используем 2-е следствие из закона Гесса:


 = 2 Но
= 2 Но
(С Н
ОН) [ Но
(С Н ОС Н ) Но
(Н О)];
р-ции
сгор 2 5
сгор 2 5 2 5
сгор 2
р-ции
= [2 ( 1371)] [( 2727) 0] = 15 кДж/моль.


 Ответ: тепловой эффект реакции образования диэтилового эфира составляет 15 кДж/моль.
Ответ: тепловой эффект реакции образования диэтилового эфира составляет 15 кДж/моль.
3.  Рассчитайте изменение энтропии, энергии Гиббса и энтальпии в процессе усвоения в организме человека сахарозы, который сво- дится к ее окислению:
Рассчитайте изменение энтропии, энергии Гиббса и энтальпии в процессе усвоения в организме человека сахарозы, который сво- дится к ее окислению:
С12Н22О11(к) + 11О2(г) 12СО2(г) + 11Н2О(ж)
Решение:
 По таблице термодинамических величин находим значения стан- дартных энтальпий, энтропий и свободных энергий Гиббса для всех веществ, участвующих в реакции:
По таблице термодинамических величин находим значения стан- дартных энтальпий, энтропий и свободных энергий Гиббса для всех веществ, участвующих в реакции:
 Но (С Н О ) = 2222 кДж/моль;
Но (С Н О ) = 2222 кДж/моль;
обр 12 22 11
Но (О ) = 0 кДж/моль;
 обр 2
обр 2
Но (СО
) = 393 кДж/моль;
обр 2
Но (Н О) = 286 кДж/моль;
обр 2
 Sо (С Н О ) = +360 Дж/моль К;
Sо (С Н О ) = +360 Дж/моль К;
 обр 12 22 11
обр 12 22 11
Sо (О ) = +205 Дж/моль К;
обр 2
Sо (Н
О) = +70 Дж/моль К;
обр 2
Sо (СО
) = +214 Дж/моль К;
обр
 Gо
Gо
2
(С Н О
) = 1545 кДж/моль;
 обр 12 22 11
обр 12 22 11
Gо (О ) = 0 кДж/моль;
 обр 2
обр 2
Gо (СО
) = 394 кДж/моль;
обр 2
Gо (Н О) = 237 кДж/моль.
обр 2
Используя 1-е следствие из закона Гесса, рассчитываем искомые
величины:



|
 – [ Но (С Н О ) + 11 Но (О )]
– [ Но (С Н О ) + 11 Но (О )]

 обр
обр
12 22 11
обр 2
 Нор-ции = [12 (–393) + 11 (–286)] – [–2222 + 11 0] = –5676 кДж/моль;
Нор-ции = [12 (–393) + 11 (–286)] – [–2222 + 11 0] = –5676 кДж/моль;
 = [12Sо
= [12Sо
(СО
) + 11Sо
(Н О)] –
р-ции
обр 2
обр 2
– [Sо
(С Н О ) + 11Sо
(О )] =




 обр
обр
12 22 11
обр 2
р-ции
= [12 214 + 11 70] – [360 + 11 205] = +723 Дж/моль К;

 = [12 Gо
= [12 Gо
(СО
) + 11 Gо
(Н О)] –
р-ции
обр 2
обр 2
 – [ Gо
– [ Gо
(С Н О ) + 11 Gо
(О )] =
 обр
обр
12 22 11
обр 2


 р-ции=[12 (–394)+ 11 (–237)] – [( 1545) + 11 0] = –5790 кДж/моль.
р-ции=[12 (–394)+ 11 (–237)] – [( 1545) + 11 0] = –5790 кДж/моль.


|
|
р-ции
= 5676 кДж/моль; Sо


|
= +723 Дж/моль К;
4. Проверьте, нет ли угрозы, что оксид азота(I) применяемый в ме- дицине в качестве наркотического средства, будет окисляться ки- слородом воздуха до весьма токсичного оксида азота(II):
2N2О(г) + О2(г) = 4NO(г).
Решение:
Для ответа на поставленный в задаче вопрос необходимо рассчи- тать изменение энергии Гиббса для предполагаемой реакции, вос- пользовавшись значениями стандартных энергий Гиббса из табли- цы термодинамических величин:





|

 Ответ: так как Gо 0, реакция при заданных условиях не пойдет.
Ответ: так как Gо 0, реакция при заданных условиях не пойдет.
5. Энтальпия сгорания глюкозы равна –2802 кДж/моль при 298 К. Сколько г глюкозы нужно израсходовать, чтобы подняться по лест- ничному проему на 3 м. Принять, что в полезную работу можно об- ратить 25% энтальпии.
Решение:

 Максимальная полезная работа, которая может быть совершена че- ловеком в результате окисления 1 г глюкозы кислородом (с учетом КПД организма), равна:
Максимальная полезная работа, которая может быть совершена че- ловеком в результате окисления 1 г глюкозы кислородом (с учетом КПД организма), равна:
Аmax = n(С6Н12О6) Нсгор.(С6Н12О6)

 1 г
1 г
Аmax =
180
г/моль
2802 кДж/моль 0,25 = 3,89 кДж.
Работа, необходимая для подъема человека массой 70 кг на высоту 3 м, составляет:

 А = m q h = 70 кг
А = m q h = 70 кг  9,8 кг/с2
9,8 кг/с2  3 м = 2058 Дж = 2,058 кДж. Следовательно, если окисляется 1 г глюкозы, то полезная работа равна 3,89 кДж, а если полезная работа равна 2,058 кДж, то необхо- дима глюкоза массой:
3 м = 2058 Дж = 2,058 кДж. Следовательно, если окисляется 1 г глюкозы, то полезная работа равна 3,89 кДж, а если полезная работа равна 2,058 кДж, то необхо- дима глюкоза массой:
 2,058
2,058
m(С6Н12О6) =
3,89
= 0,529 г.
Ответ: необходимо израсходовать 0,529 г глюкозы.
6. Человек в теплой комнате съедает 100 г сыра (энергетическая ценность его составляет 15,52 кДж/г). Если предположить, что в организме не происходит накопление энергии, то какую массу воды он выделит, чтобы установилась первоначальная температура?
Решение:
 Потоотделение охлаждает тело, поскольку для испарения воды тре- буется энергия. Мольная энтальпия парообразования воды равна 44 кДж/моль. Испарение воды происходит при постоянном давле- нии, поэтому можно приравнять энтальпию испарения воды к ко- личеству теплоты, которую необходимо выделить:
Потоотделение охлаждает тело, поскольку для испарения воды тре- буется энергия. Мольная энтальпия парообразования воды равна 44 кДж/моль. Испарение воды происходит при постоянном давле- нии, поэтому можно приравнять энтальпию испарения воды к ко- личеству теплоты, которую необходимо выделить:
Q = n(H2O) Hисп(Н2О).
Энергия, получаемая при усвоении сыра составляет:
 Q = m(сыра) Кал (сыра) = 100 г
Q = m(сыра) Кал (сыра) = 100 г  15,52 кДж/г = 1552 кДж.
15,52 кДж/г = 1552 кДж.
Тогда количество и масса воды, которые необходимо выделить равны:

 Q 1552
Q 1552
кДж
n (H 2 O)
Δ H исп
= 44
кДж/моль
= 35,3 моль;
 m(Н2О) = n(H2O) М(Н2О) = 35,3 моль
m(Н2О) = n(H2O) М(Н2О) = 35,3 моль  18 г/моль = 635 г.
18 г/моль = 635 г.
Ответ: необходимо выделить 635 г воды.
7.  Рассчитайте энтальпию гидратации сульфата натрия, если из- вестны энтальпии растворения безводной соли Na2SO4(к) (–23 кДж/моль) и кристаллогидрата Na2SO4 10Н2О(к) (78,6 кДж/моль).
Рассчитайте энтальпию гидратации сульфата натрия, если из- вестны энтальпии растворения безводной соли Na2SO4(к) (–23 кДж/моль) и кристаллогидрата Na2SO4 10Н2О(к) (78,6 кДж/моль).
Решение:
 При растворении безводной соли происходит ее гидратация и по- следующее растворение кристаллогидрата в воде. Эти процессы могут быть выражены с помощью треугольника Гесса и следующих термодинамических уравнений:
При растворении безводной соли происходит ее гидратация и по- следующее растворение кристаллогидрата в воде. Эти процессы могут быть выражены с помощью треугольника Гесса и следующих термодинамических уравнений:
 Na2SO4(к) + 10Н2О(ж) = Na2SO4 10Н2О(к); Н1 = ?
Na2SO4(к) + 10Н2О(ж) = Na2SO4 10Н2О(к); Н1 = ?


 Na2SO4 10Н2О(к)+Н2О(ж)= Na2SO4(р-р); Н2 = +78,6 кДж/моль Na2SO4(к)+ Н2О(ж)= Na2SO4(р-р); Н3 = –2,3 кДж/моль
Na2SO4 10Н2О(к)+Н2О(ж)= Na2SO4(р-р); Н2 = +78,6 кДж/моль Na2SO4(к)+ Н2О(ж)= Na2SO4(р-р); Н3 = –2,3 кДж/моль
Na2SO4.10H2O
 H1
H1
Na2SO4(к) H3
H2
Na2SO4(р-р)
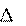



 В соответствии с законом Гесса энтальпия процесса растворе- ния безводной соли ( Н3) будет равна сумме энтальпий гидратации безводной соли до кристаллогидрата ( Н1) и энтальпии растворе- ния кристаллогидрата ( Н2): Н3 = Н1 + Н2.
В соответствии с законом Гесса энтальпия процесса растворе- ния безводной соли ( Н3) будет равна сумме энтальпий гидратации безводной соли до кристаллогидрата ( Н1) и энтальпии растворе- ния кристаллогидрата ( Н2): Н3 = Н1 + Н2.

 Поэтому энтальпия гидратации Na2SO4 будет равна:
Поэтому энтальпия гидратации Na2SO4 будет равна:

 Н1 = Н3 Н2 = 2,3 78,6 = –80,9 кДж/моль.
Н1 = Н3 Н2 = 2,3 78,6 = –80,9 кДж/моль.
Ответ: энтальпия гидратации сульфата натрия –80,9 кДж/моль.
8.  При растворении 715 г кристаллической соды Na2CO3 10Н2О было поглощено 167,36 кДж тепла. Какова теплота растворения кристаллогидрата.
При растворении 715 г кристаллической соды Na2CO3 10Н2О было поглощено 167,36 кДж тепла. Какова теплота растворения кристаллогидрата.
Решение:
Энтальпией растворения называют тепловой эффект растворения 1 моль вещества в столь большом объеме растворителя, при кото- ром дальнейшее прибавление последнего не вызывает дополни- тельных тепловых эффектов.
 715 г
715 г
 n(Na2CO3 10Н2О) =
n(Na2CO3 10Н2О) =
286 г/моль
= 2,5 моль;

 (Na CO 10Н
(Na CO 10Н
Δ H
 О) = ;
О) = ;
раств-я 2 3 2


 (Na CO 10Н
(Na CO 10Н
О)=
167 ,36
= 66,94 кДж/моль.
раств-я 2 3 2
2,5
 Ответ: теплота растворения Na2CO3 10Н2О равна 66,94 кДж/моль.
Ответ: теплота растворения Na2CO3 10Н2О равна 66,94 кДж/моль.
9.  Энтальпия растворения NH4NO3 в воде равна 26,7 кДж/моль. На сколько градусов понизится температура при растворении 20 г NH4NO3 в 180 г Н2О, если удельную теплоемкость раствора при- нять равной 3,76 Дж/(г град)?
Энтальпия растворения NH4NO3 в воде равна 26,7 кДж/моль. На сколько градусов понизится температура при растворении 20 г NH4NO3 в 180 г Н2О, если удельную теплоемкость раствора при- нять равной 3,76 Дж/(г град)?

 Решение:
Решение:
 |
H (кДж/моль);

 раст я
раст я


|
 H m ( NH 4 NO 3 )
H m ( NH 4 NO 3 )


 = –8,9оС.
= –8,9оС.

 с m ( р
с m ( р
ра )
M ( NH 4 NO 3 )
Ответ: температура раствора понизится на 8,9 градуса.

Лабораторная работа
« Определение стандартного изменения энтальпии реакции нейтрализации »
Цель работы. Экспериментально определить стандартное изменение энтальпии реакции нейтрализации и провести сравнение с расчетными его значениями.
Принадлежности к работе: а) калориметр, включающий: стеклянный стакан (1) емкостью 0,5 л; внутренний стеклянный стакан (2) емкостью 0,2 л; картонный кружок (3); корковую пробку для внутренне  го стакана с двумя отверстиями для воронки и термометра (4); б) мензурки; в) термометр; г) стеклянные воронки; д) техно-химические весы; е) растворы исследуемых кислот и оснований с известной концентрацией.
го стакана с двумя отверстиями для воронки и термометра (4); б) мензурки; в) термометр; г) стеклянные воронки; д) техно-химические весы; е) растворы исследуемых кислот и оснований с известной концентрацией.
Будьте осторожны при работе с кислотами и щелочами! Для проведения работ могут быть использованы стаканы меньшего объема, но при этом увеличиваются потери теплоты.
|
| №№ п/п | Измеряемая величина | HCl + NaOH |
| 1 | Масса калориметрического стакана m1 | |
| 2 | Масса NaOH m2 = ρщ·Ущ | |
| 3 | Масса кислоты m3 = ρк·Vk | |
| 4 | Температура кислоты tк | |
| 5 | Температура щелочи tщ | |
| 6 | Начальная тем-pa р-ра t, = 0,5(tщ+tк°) | |
| 7 | Темп-pa р-ра после нейтрализации, ts |
|

Выполнение расчетов. Рассчитайте теоретическое значение стандартного изменения энтальпии исследуемой редакции ∆Нº с использованием табличных значений термодинамических свойств веществ. Рассчитайте экспериментальное значение стандартного изменения энтальпии реакции нейтрализации по формуле:
Q = –∆Hº = ∆t·C/n(NaOH), где
С – теплоемкость калориметра, С = m1·С1 + (m2 + m3)·С2;
С1 = 0,753 Дж/г·град – удельная теплоемкость стекла;
С2 = 4,184 Дж/г·град – удельная теплоемкость раствора;
n(NaOH) – число молей NaOH в объеме раствора n = C(NaOH), моль/л· ·V(NaOH), л
Рассчитайте абсолютную и относительную ошибки, если извест- но, что энтальпия реакции нейтрализации 1 моля сильной одно- основной кислоты в достаточно разбавленных водных растворах
 при определенной температуре ( Но ) является величиной
при определенной температуре ( Но ) является величиной
теор.
практически постоянной и равной –55,9 кДж/моль.



|
=-55,9 кДж/моль


 d ; d
d ; d
= d абс.
100
(%).
абс.
эксп.
теор.
отн.
Δ Н o теор.
В выводе объясните причину уменьшения энтальпии системы в результате реакции нейтрализации сильной кислоты сильным основанием.
План оформления отчета:
1. Дата и название работы.
2. Цель работы.
3. Краткое описание проведения опыта.
4. Результаты полученных опытных данных.
5. Выводы по работе.









 ПРИЛОЖЕНИЕ
ПРИЛОЖЕНИЕ
Дата добавления: 2019-11-25; просмотров: 805; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
