Взаимосвязь термодинамических величин
Н = U + pV
 Энергия Гиббса Температура+ Энтропия
Энергия Гиббса Температура+ Энтропия

 Система самопроизвольно стремится к минимуму энергии и максимуму энтропии.
Система самопроизвольно стремится к минимуму энергии и максимуму энтропии.
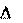
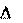

 G = H T
G = H T
= G кон. G нач.
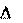
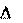
 Следовательно, термодинамический критерий G характеризует: G 0 – экзэргонические (самопроизвольные) процессы или реак- ции;
Следовательно, термодинамический критерий G характеризует: G 0 – экзэргонические (самопроизвольные) процессы или реак- ции;


 0 – эндэргонические процессы или реакции, для протекания которых необходимо затратить энергию;
0 – эндэргонические процессы или реакции, для протекания которых необходимо затратить энергию;
G = 0 – химическое равновесие.
Особенности термодинамики биохимических процессов
1. Живые организмы не избегли подчинения законам термодина- мики. В соответствии с первым законом термодинамики живые организмы не могут ни создавать энергию из ничего, ни унич- тожать ее, они могут только преобразовывать одну форму энер- гии в другую. При этом организмы потребляют из окружающей среды энергию в той форме, в которой они могут использовать ее в конкретных условиях температуры и давления, а затем воз- вращают в среду эквивалентное количество энергии в другой форме, менее пригодной для них.
Живые организмы – открытые системы, находящиеся в не- равновесном состоянии по отношению к окружающей среде. Термодинамическое равновесие для живого организма означало бы состояние смерти. В связи с этим организм «выбирает» ста- ционарное состояние.
Стационарное состояние достигается уравновешенным прито- ком и оттоком веществ и энергии.
|
|
|
Изменение энтропии (человек + окружающая среда) в стацио- нарном состоянии равно сумме изменения энтропии организма и среды:
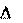
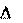
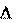 S общ. = S чел. + S среды > 0
S общ. = S чел. + S среды > 0
 Суммарное изменение энтропии, необходимое для формиро- вания человеческого организма и поддержания его жизни или существования любой другой живой системы всегда положи- тельно.
Суммарное изменение энтропии, необходимое для формиро- вания человеческого организма и поддержания его жизни или существования любой другой живой системы всегда положи- тельно.
 В организм поступают вещества с низким значением энтропии (белки, полисахариды), а выделяется большое количество про- дуктов, увеличивающих энтропию окружающей среды (Н2О, СО2, NH3 и т.д.). Процессы с отрицательным и положительным значением S взаимосвязаны: окисление глюкозы в процессе дыхания ( S 0) и синтез АТФ за счет выделившейся при окис-
В организм поступают вещества с низким значением энтропии (белки, полисахариды), а выделяется большое количество про- дуктов, увеличивающих энтропию окружающей среды (Н2О, СО2, NH3 и т.д.). Процессы с отрицательным и положительным значением S взаимосвязаны: окисление глюкозы в процессе дыхания ( S 0) и синтез АТФ за счет выделившейся при окис-

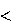 лении глюкозы энергии ( 0). Процессы роста и развития (ус-
лении глюкозы энергии ( 0). Процессы роста и развития (ус-

 ложнения) организма сопровождаются уменьшением энтропии, однако, это происходит так, что изменение общей энтропии ( Sчел. + Sсреды) положительно, но возрастает с минимальной скоростью.
ложнения) организма сопровождаются уменьшением энтропии, однако, это происходит так, что изменение общей энтропии ( Sчел. + Sсреды) положительно, но возрастает с минимальной скоростью.
Живые организмы поддерживают присущую им упорядочен- ность за счет увеличения энтропии внешней среды.
Жизнь – это постоянная борьба против тенденции к возрастанию энтропии организма, но так как избежать этого возрастания нельзя, живые организмы выбрали наименьшее «зло» – стацио- нарное состояние, в котором скорость возрастания энтропии минимальна.
|
|
|
 Производство энтропии системой, находящейся в стационар- ном состоянии, стремится к минимуму (принцип И. Приго- жина):
Производство энтропии системой, находящейся в стационар- ном состоянии, стремится к минимуму (принцип И. Приго- жина):

|
 min
min
Δ τ
Живая клетка – изотермическая химическая машина. Энергию, которую клетки поглощают из внешней среды, они получают в форме химической энергии, которая затем преобразуется для выполнения химической работы, совершаемой в процессе био-
синтеза клеточных компонентов, а также осмотической работы, необходимой для транспорта веществ в клетку, и механической работы сокращения и передвижения.
2. 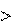 Принцип энергетического сопряжения биохимических реак- ций
Принцип энергетического сопряжения биохимических реак- ций


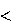
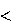 В живых системах эндэргонические реакции ( Gр-ции 0) сопря- жены с экзэргоническими ( Gр-ции 0). Для сопряжения энд- и эк- зэргонических процессов необходимо наличие общего промежу- точного соединения и чтобы на всех стадиях сопряженных реак- ций суммарный процесс характеризовался :
В живых системах эндэргонические реакции ( Gр-ции 0) сопря- жены с экзэргоническими ( Gр-ции 0). Для сопряжения энд- и эк- зэргонических процессов необходимо наличие общего промежу- точного соединения и чтобы на всех стадиях сопряженных реак- ций суммарный процесс характеризовался :

 Gсопряж.р
Gсопряж.р
Пример энергетического сопряжения.
ций 0.
I.  глюкоза + фруктоза сахароза + Н2О;
глюкоза + фруктоза сахароза + Н2О;
o


|
I =+20,9 кДж/моль
II.  АТФ + Н2О АДФ + Ф;
АТФ + Н2О АДФ + Ф;
|
|
|
o


|
II = 30,5 кДж/моль.
 Эти две реакции I и II сопряжены за счет образования при совме- стном протекании общего промежуточного соединения глюкозо- 1-фосфат - интермедиата.
Эти две реакции I и II сопряжены за счет образования при совме- стном протекании общего промежуточного соединения глюкозо- 1-фосфат - интермедиата.
 Суммарный процесс:
Суммарный процесс:

 АТФ + глюкоза + фруктоза сахароза + АДФ + Ф
АТФ + глюкоза + фруктоза сахароза + АДФ + Ф


 ции I
ции I
II = 29,2 кДж/моль;

 р ций I
р ций I
II 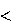 0.
0.
 Обратите внимание! Связи, по которым гидролиз проходит с большой убылью энергии Гиббса, в биохимии принято назы- вать макроэргическими. Этот термин нельзя трактовать как «бо- гатую энергией связь». Для разрыва химической связи всегда требуется затрата энергии. Представление о том, что процесс расщепления связи поставляет энергию для химической работы, не имеет физического смысла. Необходимая для энергетического сопряжения энергия высвобождается в результате перегруппи- ровки атомов в реагентах, среди которых имеется один с макро- эргической связью.
Обратите внимание! Связи, по которым гидролиз проходит с большой убылью энергии Гиббса, в биохимии принято назы- вать макроэргическими. Этот термин нельзя трактовать как «бо- гатую энергией связь». Для разрыва химической связи всегда требуется затрата энергии. Представление о том, что процесс расщепления связи поставляет энергию для химической работы, не имеет физического смысла. Необходимая для энергетического сопряжения энергия высвобождается в результате перегруппи- ровки атомов в реагентах, среди которых имеется один с макро- эргической связью.
Внутренним источником энергии в живых системах являются фосфорилированные соединения (АТФ, креатинфосфат и другие), при взаимодействии которых с биосубстратами, включая воду, выделяется энергия, необходимая для протекания важных для ор- ганизма эндэргонических процессов.
Термодинамические особенности живых организмов объяс- няют его устойчивость, позволяющую много лет сохранять рабо- тоспособность на определенном уровне, а также относительное постоянство внутренней среды – гомеостаз.
|
|
|
Дата добавления: 2019-11-25; просмотров: 185; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
