Характеристика марганца и его соединений
Получен в чистом виде в 1808 г о.Джоном. название происходит от греческого «манганоми»(проясняю, навожу блеск) и связано со словом «манганес». Обозначавшим в средние века минерал пиролюзит.
Распространенность в природе
Марганец – в свободном состоянии не встречается,по растпространенности занимает пятое место после железа. Образует большое количество собственных минералов, основными из которых являются: пиролюзит MnO2, манганит Mn2O3 · H2O, родонит MnSiO3.Содержится в океанической воде.
Положение в ПСХЭ Д.И. Менделеева
· Находится в IV периоде, вVII группе, в побочной подгруппе
· d-элемент. Валентные электроны 3d54s2.
· степени окисления +2, +3, +4, +5, +6, +7 Характерные СО +2, +4, +7 в меньшей мере +6.
· Соединения марганца (II) проявляют преимущественно основные свойства, марганца (IV) – амфотерные, соединения марганца (VI) и (VII) – кислотные.
Физические свойства.
Марганец – серебристо-белый металл, твердый и хрупкий, проводит электрический ток. Чистый марганец можно прокатывать и штамповать. Температура плавления 1245°С, температура кипения 2200°С, плотность 7,44 г/см3. На воздухе покрыт прочной оксидной пленкой.
Химические свойства
Марганец – активный металл.
I. Взаимодействие с простыми веществами.
1. Взаимодействие с неметаллами С неметаллами проявляет преимущественно СО +2
а) Легко окисляется кислородом воздуха с образованием оксидов различного состава:
|
|
|
· выше 800°С образуется смешанный оксид марганца (II, III): 3Mn + 2O2 = Mn3O4;
· 450 – 800°С - оксид марганца (III): 4Mn + 3O2 = 2Mn2O3
· ниже 450°С - оксид марганца (IV): Mn + O2 = MnO2.
б) С галогенами, кроме фтора, дает галогениды марганца (II): Mn + Cl2 = MnCl2.
2Mn + 3F2 = 2MnF3 (MnF4);
в) При нагревании реагирует с серой, азотом, фосфором, углеродом, кремнием: Mn + S = MnS;
2Mn + N2 = 2MnN (возможно образование MnN6, Mn5N2, Mn4N, Mn3N2 и других нитридов);
Mn + P = MnP (возможно образование MnP3, Mn2P, Mn3P, Mn3P2 и других фосфидов);
3Mn + С = Mn3С (возможно образование Mn5С2, Mn15С4, Mn2С7 и других карбидов);
Mn + Si = MnSi (возможно образование Mn3Si, Mn5Si и других силицидов).
III. Взаимодействие со сложными веществами.
1. Взаимодействие с водой
При комнатной температуре очень медленно взаимодействует с водой, при нагревании с умеренной скоростью: Mn + 2H2O = MnO2 + 2H2.
2. Взаимодействие с кислотами
а) Вытесняет водород из растворов неокисляющих кислот, образуюя соли марганца (II):
Mn + 2HCl = MnCl2 + H2;
Mn + H2SO4 = MnSO4 + H2;
б) с разбавленной азотной кислотой образует нитрат марганца (II) и оксид азота (II):
|
|
|
3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O.
в) Концентрированная азотная и серная кислоты пассивируют марганец. Взаимодействует при нагревании: Mn + 2H2SO4 = MnSO4 + SO2 + 2H2O;
Mn + 4HNO3 = Mn(NO3)2 + 2NO2 + 2H2O.
3. Восстановление металлов из оксидов
Восстанавливает менее активные металлы из их оксидов:
5Mn + Nb2O5 = 5MnO + 2Nb.
Способы получения
1. Восстановлением пиролюзита углеродом или кремнием (в виде силикомарганца), реже – алюминием: MnO2 + 2С = Mn + 2СО.
2. Электролизом водного раствора сульфата марганца, на катоде выделяется марганец:
MnSO4 + 2H2O 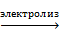 Mn + O2 + Н2 + H2SO4.
Mn + O2 + Н2 + H2SO4.
Применение.
Марганец применяют в качестве добавки к стали, улучшающей ее свойства. Повышенную стойкость к ударам и истиранию имеет марганцовистая сталь. Из сплавов Гейслера (Al - Mn) изготавливают очень сильные постоянные магниты. Манганин (12% Mn, 3% Ni, 85% Сu) обладает ничтожно малым температурным коэффициентом электросопротивления и другими ценными электротехническими свойствами.
Соединения марганца(II)
Оксид марганца (II) MnO – кристаллическое вещество серо-зеленого цвета, обладает полупроводниковыми свойствами.
MnO – основной оксид. Проявляет восстановительные свойства.
|
|
|
1. С водой и растворами щелочей не взаимодействует.
2. Взаимодействует с кислотами, образуя соли марганца (II) и воду: MnO + 2HCl = MnCl2 + H2O.
3. При сплавлении со щелочами в избытке кислорода образует гипоманганаты:
4MnO + 12NaOH + 3O2 = 4Na3MnO4 + 6H2O.
Получение.
1. Термическое разложении гидроксида марганца (II) и солей в инертной атмосфере:
Mn(OH)2 = MnO + H2O;
MnCO3 = MnO + CO2.
Гидроксид марганца (II) Mn(OH)2 – вещество белого цвета, плохо растворимое в воде.
Mn(OH)2 –основание средней силы, проявляет преимущественно основные свойства. Является восстановителем.
1. Взаимодействует с кислотами: Mn(OH)2 + H2SO4 = MnSO4 + 2H2O;
2. При обычных условиях с водными растворами щелочей не взаимодействует, при длительном нагревании возможно образование гескагидроксоманганата (II):
Mn(OH)2 + 4NaOH = Na4[Mn(OH)6].
3. На воздухе быстро окисляется: 2Mn(OH)2 + O2 = 2MnO2 + 2H2O.
Получение.
1. При взаимодействии солей марганца (II) с растворами щелочей:
Mn(NO3)2 + 2NaOH = Mn(OH)2 + 2NaNO3.
Соли марганца (II). Марганец (II) образует соли со многими анионами, многие из них хорошо растворимы в воде, образуя растворы розового цвета. Мало растворимы сульфид, карбонат и ортофосфат марганца (II). Проявляют все свойства солей, в растворе гидролизуют.
|
|
|
Обладают восстановительными свойствами.
1. В щелочной среде окисляются до манганатов – производных марганца (VI):
MnSO4 + 2Br2 + 8KOH = K2MnO4 + 4KBr + Na2SO4 + 4H2O;
2. в кислой – до производных марганца (VII):
2MnSO4 + 5PbO2 + 6HNO3 = 2HMnO4 + 3Pb(NO3)2 + 2PbSO4 + 2H2O.
Соединения марганца(IV)
Оксид марганца (IV) MnO2–наиболее устойчивое соединение марганца, кристаллическое вещество черно-бурого цвета, широко распространено в земной коре в виде минерала пиролюзит.
MnO2 – амфотерный оксид. Сильный окислитель.
1. При нагревании разлагается, постепенно отцепляя кислород и образуя оксид марганца (III), оксид марганца (II, III) и оксид марганца (II). 2MnO2 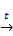 2MnO + O2
2MnO + O2
2. При 170°С восстанавливается водородом: MnO2 + H2 = MnO + H2O.
3. При сплавлении со щелочами или основными оксидами образует манганиты:
MnO2 + CaO = CaMnO3;
MnO2 + Ba(OH)2 = BaMnO3 + H2O;
в присутствии кислорода – манганаты: 2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O.
4. При нагревании с кислотами проявляет окислительные свойства:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O.
5. При взаимодействии с серной или азотной кислотой разлагается с выделением кислорода:
2MnO2 + 2H2SO4 = 2MnSO4 + O2 + 2H2O.
6. В присутствии более сильных окислителей проявляет восстановительные свойства:
2MnO2 + 3PbO2 + 6HNO3 = 2HMnO4 + 3Pb(NO3)2 + 2H2O.
Получение.
1. Термическим разложением нитрата марганца (II): Mn(NO3)2 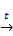 MnO2 + 2NO2
MnO2 + 2NO2
2. восстановлением перманганата калия в нейтральной среде:
2KMnO4 + 3MnCl2 + 2H2O = 5MnO2 + 2KCl + 4HCl.
Гидроксид марганца (IV) – марганцоватистая кислота Mn(OH)4 (H4MnO4), H2MnO3– неустойчивое соединение, проявляет амфотерные свойства.
Соли марганца (IV) - неустойчивы, их трудно выделить в чистом виде. Проявляют окислительные свойства.
Соединения марганца(VI)
Соединения марганца (VI) немногочисленны. Степень окисления +6 стабилизируется в манганат-ионе MnO42- (в растворе зеленого цвета), который устойчив в щелочной среде, в нейтральной и кислой среде он диспропорционирует:
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH.
Соответствующая кислота не выделена.
1. Соединения марганца (VI) – сильные окислители:
K2MnO4 + 2HCl + KNO2 = MnO2 + H2O + KNO3 + 2KCl.
2. При взаимодействии с более сильными окислителями проявляют восстановительное свойства:
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl.
Получение.
1. Образуются при восстановлении перманганата в щелочной среде:
2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + H2O;
2. при сплавлении оксидов со щелочами в присутствии кислорода воздуха:
2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O;
3. при термическом разложении перманганата:
2KMnO4 = K2MnO4 + MnO2 + O2.
Соединения марганца(VII)
Оксид марганца (VII) Mn2O7– маслянистая жидкость черно-зеленого цвета, гигроскопичная.
Mn2O7 – кислотный оксид
1. Неустойчив при нагревании. При температуре выше 50°С разлагается с образованием кислорода и низших оксидов, при более высокой температуре взрывается:
2Mn2O7 = 4MnO2 + 3O2.
2. Реагирует с водой, образуя марганцовую кислоту: Mn2O7 + H2O = 2HMnO4.
Получение.
Оксид марганца можно получить только косвенным путем:
2KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O.
Марганцовая кислота HMnO4 – сильная кислота, неустойчивая, существует только в растворах разлагается уже выше 3°С:
4HMnO4 = 4MnO2 + 2H2O + 3O2.
Соли марганцевой кислоты – перманганаты – содержат в составе перманганат-ион MnO4-, в растворе – фиолетового цвета. Проявляют окислительные свойства.
1. В кислой среде образуют соединения марганца (II):
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
2. в нейтральной – марганца (IV): 2KMnO4 + 3K2SO3 + H2O = 2MnO2 + 3K2SO4 + 2KOH
3. в щелочной – марганца (VI): 2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + H2O
4. При нагревании разлагаются: 2KMnO4 = K2MnO4 + MnO2 + O2.
Железо и его соединения
Железо – один из металлов, известных человеку с доисторических времен. Первые образцы железа, попавшие в руки человека, были метеоритного происхождения, такое железо называлось «звездным».
Распространенность в природе
Железо по распространенности в природе занимает четвертое место после кислорода, кремния и алюминия. Известно свыше 300 минералов, которые входят в состав железных руд. Железные руды, содержащие не менее 16 мас. % железа, имеют промышленное значение. Основными формами минералов железа являются оксидные и сульфидные соединения:
магнетит (магнитный железняк) Fe3O4, лимонит Fe2O3·nH2O,
гематит (железный блеск, красный железняк, кровавик) Fe2O3, пирротин FeS,
пирит FeS2. сидерит FeCO3
Очень редко встречается самородное железо метеоритного происхождения. Огромное количество железа располагается в глубинных слоях Земли, ядро нашей планеты – это сплав железа с никелем.
Железо – важнейший биоэлемент, оно входит в состав гемоглобина крови.
Дата добавления: 2019-02-22; просмотров: 9226; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
