Література для підготовки теоретичного матеріалу
Опрацювати розділи 5, 6, 7 підручника [6] та 2 посібника [3].
План вивчення розділу
1 Загальні поняття хімічної термодинаміки.
2 Термодинамічні функції. Закони термодинаміки.
3 Закон Гесса. Термохімічні рівняння.
4 Напрямок перебігу хімічних реакцій.
5 Основні поняття хімічної кінетики.
6 Швидкість хімічної реакції і чинники, що впливають на неї:
6.1 природа реагентів;
6.2 концентрація реагентів(тиск для реакцій у газовому стані);
6.3 температура;
6.4 каталізатор;
6.5 площа поверхні зіткнення (для гетерогенних
реакцій).
7 Хімічна рівновага, умови її зміщення.
8 Приклади розв’язання типових задач і виконання завдань.
9 Завдання для самоперевірки.
Приклади розв’язання типових задач і виконання завдань
Приклад 1Обчислити ентальпію конденсації водяної пари. Чи виділяється при цьому теплота?
Розв’язання. Під час конденсації водяної пари відбувається фазове перетворення газуватої води у рідку, тому можна записати термохімічне рівняння у вигляді

Взявши до уваги наслідок закону Гесса і використавши табличні дані ентальпій утворення рідкої та газуватої води (додаток Б), отримуємо такий вираз:


Оскільки  , то процес конденсації водяної пари є ендотермічним, теплота поглинається.
, то процес конденсації водяної пари є ендотермічним, теплота поглинається.
Приклад 2На підставі стандартних ентальпій утворення  і абсолютних ентропій утворення
і абсолютних ентропій утворення  речовин (додаток Б) визначте: а)
речовин (додаток Б) визначте: а)  ,
,  і
і  хімічної реакції. Зробіть висновок щодо термодинамічної ймовірності перебігу реакції за стандартних умов; б) температуру рівноваги реакції (впливом температури на
хімічної реакції. Зробіть висновок щодо термодинамічної ймовірності перебігу реакції за стандартних умов; б) температуру рівноваги реакції (впливом температури на  і
і  реакції знехтувати); В інтервал температур, в якому перебіг даної реакції термодинамічно ймовірний. Розрахунки провести за наведеним рівнянням хімічної реакції:
реакції знехтувати); В інтервал температур, в якому перебіг даної реакції термодинамічно ймовірний. Розрахунки провести за наведеним рівнянням хімічної реакції:
|
|
|
 .
.
Розв’язання. Спочатку виписуємо довідникові значення стандартних ентальпій утворення і абсолютних ентропій утворення взаємодіючих речовин:

| 
| 
| 
| |

| -813,99 | 0 | -241,81 | -296,9 |

| 156,90 | 31,92 | 188,72 | 248,07 |
а) на підставі наслідку закону Гесса розраховуємо тепловий ефект  хімічної реакції:
хімічної реакції:



Оскільки ентропія є функцією стану, то її змінення внаслідок реакції визначається різницею між сумами ентропій утворення продуктів реакції та сумами ентропій утворення реагентів з урахуванням стехіометричних коефіцієнтів. Розраховуємо  хімічної реакції:
хімічної реакції:



Змінення енергії Гіббса  хімічної реакції є критерієм можливості самочинного перебігу процесу і тому визначається різницею між тепловим ефектом реакції (
хімічної реакції є критерієм можливості самочинного перебігу процесу і тому визначається різницею між тепловим ефектом реакції (  ) та зв’язаною енергією
) та зв’язаною енергією  .
.
Розраховуємо  хімічної реакції, використовуючи отримані значення:
хімічної реакції, використовуючи отримані значення:  та
та  за формулою (під час цього розрахунку приведемо у відповідність розмірність вимірювання всіх термодинамічних функцій):
за формулою (під час цього розрахунку приведемо у відповідність розмірність вимірювання всіх термодинамічних функцій):
|
|
|


Від’ємне значення енергії Гіббса (  ) свідчить про термодинамічну можливість самочинного перебігу прямої реакції за стандартних умов.
) свідчить про термодинамічну можливість самочинного перебігу прямої реакції за стандартних умов.
б) у стані рівноваги
 (або
(або  ),
),
звідки температура рівноваги

в) термодинамічно можливим є самочинний перебіг реакції при температурах, для яких  . Для екзотермічних реакцій (
. Для екзотермічних реакцій (  ), що супроводжуються зменшенням ентропії (
), що супроводжуються зменшенням ентропії (  ), умова
), умова  виконується при
виконується при  Отже, при
Отже, при  можливий самочинний перебіг реакції.
можливий самочинний перебіг реакції.
Приклад 3 Тепловий ефект реакції горіння моля рідкого бензену з утворенням вуглекислого газу і водяної пари дорівнює –3135,58 кДж. Написати термохімічне рівняння і обчислити ентальпію утворення  .
.
Розв’язання. Термохімічне рівняння має вигляд

Згідно із законом Гесса тепловий ефект цієї реакції


 .
.
Користуючись довідковими даними щодо ентальпій утворення відповідних речовин, одержимо


Приклад 4 Визначити кількість теплоти, що поглинається при утворенні 11,2л  за стандартних умов, якщо реакція проходить відповідно до термохімічного рівняння
за стандартних умов, якщо реакція проходить відповідно до термохімічного рівняння

Розв’язання. Визначимо кількість моль газу в 11,2л  :
:
|
|
|

З термохімічного рівняння видно, що
при утворенні 2 моль  поглинається 182,52 кДж;
поглинається 182,52 кДж;
при утворенні 0,5 моль  поглинається х кДж.
поглинається х кДж.
З пропорції випливає:

Приклад 5 Скласти термохімічне рівняння реакції згоряння етанолу 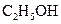 , якщо при спалюванні 4,6г
, якщо при спалюванні 4,6г 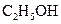 виділяється 136,7 кДж тепла.
виділяється 136,7 кДж тепла.
Розв’язання. Згоряння етанолу відбувається за рівнянням

Визначимо кількість речовини 

Складемо пропорцію.
при згорянні 1 моль 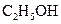 виділяється х кДж;
виділяється х кДж;
при згорянні 0,1 моль 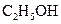 виділяється 136,7 кДж.
виділяється 136,7 кДж.

Термохімічне рівняння реакції має такий вигляд:

Приклад 6 Визначити інтервал температур, за яких реакція  відбувається у прямому напрямку, а за яких – у зворотному.
відбувається у прямому напрямку, а за яких – у зворотному.
Розв’язання. На основі довідкових даних щодо ентальпій та ентропій утворення відповідних речовин (додаток Б) обчислимо тепловий ефект реакції та змінення ентропії.
Згідно із законом Гесса тепловий ефект реакції дорівнює


Оскільки ентропія є функцією стану, її змінення внаслідок хімічної реакції дорівнює


За стандартних умов (  ) енергія Гіббса
) енергія Гіббса


 , тому за стандартних умов самочинно відбувається пряма реакція.
, тому за стандартних умов самочинно відбувається пряма реакція.
Для визначення рівноважної температури, при якій відбувається змінювання знака енергії Гіббса, скористуємося умовою
|
|
|


Отже, при температурах, нижче  K, самочинно буде відбуватися пряма реакція, а вище
K, самочинно буде відбуватися пряма реакція, а вище  K – зворотна.
K – зворотна.
Приклад 7 Визначити, як зміниться швидкість прямої та зворотної реакцій  , якщо загальний тиск у системі збільшити у 4 рази?
, якщо загальний тиск у системі збільшити у 4 рази?
Розв’язання. Збільшення тиску у 4 рази призводить до зменшення об’єму системи в 4 рази, і як наслідок, відбувається збільшення концентрації реагуючих речовин у 4рази. За законом діючих мас швидкість прямої характеризується виразом

а після збільшення тиску
 .
.
Швидкість зворотної реакції характеризується виразом
 ,
,
а після збільшення тиску
 .
.
Розрахунки доводять, що при зростанні тиску у 4 рази швидкість прямої реакції збільшилася у 64, а швидкість зворотної – у 16 разів.
Приклад 8 Температурний коефіцієнт реакції дорівнює 3. Як зміниться швидкість реакції при зниженні температури на 400?
Розв’язання. Перетворимо рівняння Вант-Гоффа, розділивши ліву і праву частини на  , і підставимо дані, вважаючи, що
, і підставимо дані, вважаючи, що  (оскільки температура знижується):
(оскільки температура знижується):


Розв'язок показує, що швидкість реакції зменшиться у 81 раз.
Приклад 9 Складіть вираз константи рівноваги таких оборотних процесів:
а)  ;
;
б) 
(воду взято у значному надлишку).
Розв’язання.У вираз константи рівноваги так само, як і у вираз швидкості реакції, не входять концентрації речовин, що утворюють конденсовані фази або наявні у значному надлишку, тому константи рівноваги мають такі вирази:
а)  ; б)
; б)  .
.
Приклад 10У який бік зміститься рівновага реакцій:
1 
2 
а) при підвищенні температури; б) при зниженні тиску?
Розв’язання: 1 а) У рівноважній системі

пряма реакція є ендотермічною, тому згідно з принципом Ле-Шательє при підвищенні температури рівновага зміститься у бік прямої реакції (ендотермічної);
б) при зниженні тиску рівновага в наведеній гетерогенній системі зміститься у бік прямої реакції, тобто в бік утворення більшої кількості газоподібних речовин.
2 а) У рівноважній системі

пряма реакція, навпаки, екзотермічна, тому при підвищенні температури рівновага зміститься у бік зворотної реакції (ендотермічної);
б) при зниженні тиску рівновага зміститься у бік зворотної реакції (у бік утворення більшої кількості газоподібних речовин).
Приклад 11Під час синтезу амоніаку рівновага встановилася при таких концентраціях (моль/л) речовин:  ,
,  ,
,  . Розрахуйте константу рівноваги
. Розрахуйте константу рівноваги  та вихідні концентрації азоту і водню.
та вихідні концентрації азоту і водню.
Розв’язання. Відповідно до коефіцієнтів у рівнянні хімічної реакції  встановлюємо кількісні відношення речовин:
встановлюємо кількісні відношення речовин:

Із зіставлення коефіцієнтів випливає, що для утворення  амоніаку необхідно, щоб азоту прореагувало вдвічі менше, тобто
амоніаку необхідно, щоб азоту прореагувало вдвічі менше, тобто  , а водню – у 1,5 раза більше:
, а водню – у 1,5 раза більше:  . Після встановлення кількості реагуючих речовин можна визначити вихідні концентрації реагентів як суму рівноважних і «витрачених внаслідок реакції» концентрацій:
. Після встановлення кількості реагуючих речовин можна визначити вихідні концентрації реагентів як суму рівноважних і «витрачених внаслідок реакції» концентрацій:


Для зручності під час розв’язання таких задач доцільно використовувати таблицю, в якій спочатку зазначити дані умови задачі, а потім зазначити отримані:
| Рівняння реакції | 
| 
| 
| 
| 
|
Вихідні концентрації

| 4,3 | 7,2 | 0 | ||
Прореагувало

| 1,8 | 5,4 | - | ||
Рівноважні концентрації 
| 2,5 | 1,8 | 3,6 |
Константу рівноваги обчислюємо за формулою
 .
.
Приклад 12 При деякій температурі константа швидкості реакції  дорівнює 0,16, а вихідні концентрації (моль/л):
дорівнює 0,16, а вихідні концентрації (моль/л):  ;
;  . Обчислити початкову швидкість реакції. Як зміниться швидкість реакції, коли концентрація водню зменшиться до 0,03 моль/л?
. Обчислити початкову швидкість реакції. Як зміниться швидкість реакції, коли концентрація водню зменшиться до 0,03 моль/л?
Розв’язання. Відповідно до закону діючих мас початкова швидкість реакції дорівнює

До певного часу прореагувало водню

Зіставляючи коефіцієнти у рівнянні реакції, робимо висновок, що і йоду прореагувала така ж кількість, тому його концентрація набула значення

При цьому швидкість реакції стала такою:

Порівняно із початковою швидкість реакції зменшиться у

Приклад 13. Обчислити рівноважні концентрації речовин у системі  при 1023 К, якщо константа рівноваги
при 1023 К, якщо константа рівноваги  , а початкові концентрації
, а початкові концентрації 

Розв’язання. Оскільки початкові концентрації продуктів не зазначені, то вважаємо, що вони дорівнювали нулю:
 ;
;  .
.
Припустимо, що концентрація  у ході реакції збільшилася на х моль/л, тоді рівноважна концентрація
у ході реакції збільшилася на х моль/л, тоді рівноважна концентрація  . За рівнянням реакції видно, що на стільки ж збільшилася концентрація водню
. За рівнянням реакції видно, що на стільки ж збільшилася концентрація водню  і зменшилися концентрації вихідних речовин, тобто
і зменшилися концентрації вихідних речовин, тобто
 і
і  .
.
Підставимо рівноважні концентрації у рівняння закону діючих мас:

Звідки

Отже, рівноважні концентрації речовин у системі є такими:
 ;
;  ;
;
 ;
; 
Завдання для самоперевірки
Дата добавления: 2019-02-13; просмотров: 141; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
