Металл иондары кофактор рет i нде 7 страница
- активті орталығының пiшiнi ойыс немесе саңылау сияқты болады.
Активті орталық фермент молекуласының ойық жерiнде орналасады. Активті орталықтың осындай пiшiнi микроортасын түзедi. Бұл ортада кейбiр полярлы аминқышқылының бүйiрлiк топтары катализге керек ерекше қасиеттерге ие болады;
- ферменттiң субстратпен байланысу ерекшелiгi актив ті орталығының атомдарының белгiлi конфигурацияда орналасуына тәуелдi. Егер субстраттың пiшiнi активті орталықтың пiшiніне сәйкес келсе, субстрат активті орталықтың қуысына енедi. Субстрат ферменттiң активті орталығымен ерекше нековаленттi байланыстар – электростатикалық тартылыс, гидрофобты әсер және сутектi байланыс арқылы байланысады.
Активті орталықпен жалғасқанда субстрат ферменттiң ерекше функционалды топтарына тiкелей жақын орналасады. Бұл топтардың бiрлескен әсерi субстраттың белгiлi байланыстарын тұрақсыздандырады да, реакцияға қабiлетi жоғары қосылысқа айналдырады.
Ферменттердiң қасиеттерi
Ферменттер – белоктық заттар, сондықтан белоктарға тән қасиеттер ферменттерге де тән болады. Бiрақ ферменттердiң өзiне ғана тән ерекше қасиеттерi бар. Ферменттердiң ең маңызды ерекше қасиеттерiн қарастырайық.
1. Ферменттердiң бiрiншi ерекше қасиетi – биологиялық катализдiң тиiмдiлiгi. Ферменттiң әсерiнiң тиiмдiлiгi өте жоғары. Ферменттiң бiр молекуласы 1 минутта субстраттың 102-106 молекуласын өзгерiске ұшырата алады. Ферменттер химиялық реакцияларды тездетедi, бiрақ реакция барысында ферменттердiң шығыны болмайды, яғни олар өзгерiске ұшырамайды.
|
|
|
 Мынадай химиялық реакцияны мысал ретiнде алайық: А + В С + D.
Мынадай химиялық реакцияны мысал ретiнде алайық: А + В С + D.
Тура реакцияның жылдамдығы А мен В заттардың концентрациясына пропорционал:
v1 = k1[A][В],
керi реакцияның жылдамдығы С мен D заттардың концентрациясына пропорционал:
v2 = k2[С][D].
Мұндағы k1 – тура реакцияның, k2 – керi реакцияның жылдамдығының константалары. Реакцияның тепе-теңдiгi болғанда, тура реакцияның және керi реакцияның жылдамдығы тең болады: v1 = v2, яғни
k1[A][В] = k2[С][D].
Бұл теңдеудiң өзгерген түрiн былай жазуға болады:
[A][В] k2
-------- = ------ = Кр.
[С][D] k1
Кр тепе-теңдiк константасы деп аталады.
Әр химиялық реакцияда тепе-теңдiк жағдайы болуы мүмкiн. Бұл жағдайда тура және керi реакциялардың жылдамдығы тең болады. Ферменттер реакцияның жылдамдығын тездетедi, бiрақ реакцияның тепе-теңдiгiн өзгертпейдi. Егер де фермент тура реакцияның жылдамдығын 1018 есе тездетсе, онда керi реакцияның жылдамдығы да 1018 есе жоғарылайды. Бiрақ тiрi организмдердiң клеткаларында химиялық реакциялар тепе-теңдiк жағдайға ұшырамайды, клеткаларда химиялық реакциялардың жүйелерi тепе-теңдiктен алыс тұрады. Себебi, әр реакцияның өнiмi тез жұмсалады, өйткенi реакцияда түзiлген өнiмдер келесi реакцияға түседi, басқа ферменттiң субстраты ретiнде қызмет атқарады.
|
|
|
Субстрат дегенiмiз – бұл ферменттiң әсерiне ұшырайтын қосылыс.
2. Ферменттердің екiншi ерекше қасиетi – фермен т тердiң ерекшелiгi . Ферменттердiң ерекшелiгi субстраттың табиғатына, реакцияның түрiне және ортаның жағдайына байланысты, яғни фермент белгiлi бiр субстратқа немесе арнайы реакция түрiне ерекше ортаның жағдайы болғанда ғана әсер етедi.
а) Ферменттiң субстрат ретіндегі ерекшелiгi субстраттың құрылымына байланысты.
Протеолиттiк ферменттер әр түрлi белоктардың гидролиз реакцияларын катализдейдi. Бiрақ бiр протеолиттiк фермент полипептидтiк тiзбектегi арнайы аминқышқылдары арасындағы пептидтiк байланыстарды үзедi. Мысалы, трипсин деген протеолиттiк фермент лизин мен аргининнiң карбоксил топтарының ғана қатысуымен түзiлген пептидтiк байланыстардың гидролизiн катализдейдi, химотрипсин фенилаланин, тирозин, триптофан карбоксил топтарының пептидтiк байланыстарының гидролизiн катализдейдi.
|
|
|
б) Ферменттердiң ерекшелiгi олар катализдейтiн химиялық реакция түрiне байланысты. Мысалы, фумараза гидратану және дегидратану реакцияларын катализдейдi, трипсин, пепсин пептидтiк байланыстардың гидролизiн катализдейдi.
Бiр ферменттiң субстраты басқа реакциялардың бiрнеше түрiне қатысуы мүмкiн, мысалы, гидролиздеу, трансаминдеу, декарбоксилдену, тотығу және тотықсыздану реакцияларына түсуi мүмкiн. Бiр субстрат болса да, реакцияның әрқайсысын ерекше фермент катализдейдi. Демек, бiр субстратқа ол қатысатын реакция түрiне қарай әр түрлi ферменттер әсер етедi. Мысалы, серин деген аминқышқылы келесi реакциялар арқылы өзгеруi мүмкiн:
Пируват
|
|
|
 Серин-треонин-
Серин-треонин-
дегидратаза
аминоациладенилатсинтаза

 Серин Басқа аминқышқылдарымен байланысады да, пептидтер
Серин Басқа аминқышқылдарымен байланысады да, пептидтер  түзiледi.
түзiледi.
Серин-трансоксиметилаза

Осы реакциялардың әр түрiн ерекше фермент катализдейдi.
Сериннiң пируватқа айналуын серин-треонин-дегидратаза катализдейдi.
Сериннiң глицинге айналуын серин-трансоксиметилаза катализдейдi.
Сериннiң басқа аминқышқылдарымен пептидтiк байланыс арқылы байланысу реакциясына аминоациладенилатсинтаза ферментi катысады.
в) Ферменттердiң әсер ету деңгейi, былайша активтiгi реакция жүретiн ортаға байланысты. Мысалы, трипсин өзiнiң жоғары активтiгiн ортаның рН мәні 7,5-7,8-ге тең болғанда көрсетедi, пепсин активтiгi ортаның рН мәні 1,5-2,5-ке тең болғанда байқалады. Ферменттiк реакцияларда қосымша реакция-лардың мөлшерi шамалы.
3. Ферменттердiң үшiншi ерекше қасиетi – ферменттер химиялық реакцияның активтену энергиясын төмендетедi.
Активтену энергиясы – өзара реакцияласатын заттарды актив күйге келтiру үшiн керек энергия. А ® В химиялық реакциясы өту үшiн А заттың молекулалары активтенген түрге көшедi. А заттың молекулаларының активтенген түрге көшуі үшiн қажет энергия активтену энергиясы болады (10-сурет).
Әрбiр реакцияның ауыспалы кезеңi бар. Осы кезеңде реакцияға қатысатын заттар жоғары бос энергияға ие болады. Химиялық реакцияның жылдамдығы ауыспалы күйдегi молекулалардың концентрациясына пропорционал. Фермент-тер активтену энергиясын төмендетедi, сондықтан реакцияны жылдамдатады.
Активті молекулалардың концентрациясы, реакция өтіп жатқан ортаның температурасы көтерiлсе, көбейедi. Тiрi организмдердегі метаболиттiк реакция-ларды реттеу үшiн температураның өзгерiсiн пайдаланбайды, себебi тiрi организм температурасы көтерiлсе, бұл өте зиянды. Сондықтан тiрi организмде өтетiн реакциялардың бәрi ферменттердiң әсерiмен жүзеге асырылады.
 1
1
Еа 2
10-сурет. Каталитикалық (1) және каталитикалық емес
химиялық реакциялардың энергетикалық схемасы
4. Ферменттердiң төртiншi ерекше қасиетi – кейбiр ферменттер биохимиялық жүйелердiң жылдамдығын реттейдi. Мысалы, фермент фосфофруктокиназа гликолиз деген көмiрсулар катаболизм жүйесiнiң реттегiшi болады.
55. ДНҚ молекуласының құрылысы. Уотсон-Крик моделі. Комплементарлық принцип пен Чаргафф ережесін көрсетіп жазыңыз.
ДНҚ тұқым қуалаудың химиялық негізі болып табылады. ДНҚ-ның негізгі құрылымдық элементтері – дезоксирибонуклеотидтер. ДНҚ-ның құрамына аденин, гуанин, цитозин және тимин кіреді. Нуклеотидтер бір-бірімен 3’,5’-дифосфоэфирлі байланыс арқылы жалғасады, яғни бір нуклеотидтегі 5’-көміртегі атомымен фосфат тобы келесі нуклеотидтің дезоксирибозасының 3’- гидроксил (-ОН) тобымен байланысады.
Сонымен, полинуклеотид тізбегінің бір ұшы 3’-ОН тобымен аяқталса, екінші ұшында 5’-фосфат тобы орналасады. Нуклеин қышқылдарының құрамындағы нуклеотидтердің тізбегін төрт нуклеотидтерден тұратын ДНҚ фрагментінің мысалынан көруге болады:
Негіздер А, Г, Ц және Т деп белгіленген, әрбір дезоксирибоза вертикал сызықпен, ал фосфатты топтар Р –символымен белгіленген. Цифрлармен дезоксирибоза қалдығындағы фосфат топтары байланысқан көміртегі атомдарының орны көрсетілген. Полинуклеотид тізбегі солдан оңға қарай жазылып-белгіленеді, яғни 5’-ұштан 3’-ұшқа (5’→3’) қарай.
ДНҚ молекуласының құрылымын анықтауда Э. Чаргафф нақтылаған заңдылықтың маңызы өте зор. Ол заңдылыққа сәйкес: 1) ДНҚ-ның құраындағы пуринді негіздік нуклеотидтердің жиынтық саны пиримидинді негіздік нуклеотидтердің жиынтық санына әрқашан тең болады, яғни А+Г = Т+Ц; 2) адениннің сандық мөлшері тиминдікіне, ал гуаниннің сандық мөлшері; 3) 6-жағдайындағы орында кето тобы бар негіз мөлшері 6-жағдайындағы орында амин тобы бар негіз мөлшеріне тең, яғни Г + Т = А + Ц; 4) ДНҚ құрылысын анықтауға М.Уилкинсон мен Р. Франклин 1953 ж жүргізген рентгенструктуралық зерттеулері үлкен үлес қосты. ДНҚ молекуласы бір-бірінен 0,34 нм қашықтықта орналасып, қайталанып отыратын элементтерден тұратындығы анықталды. Э.Чаргаффтың ережесіне және ДНҚ кристалдарының рентгенструктуралық талдамасына сүйене отырып Д. Уотсон мен Ф. Крик 1953 ж ДНҚ-ның құрылысына толық сипаттама берді.
ДНҚ-ның полиморфизмі.Уотсон-Крик ұсынған структура ДНҚ-ның В-формасы деп аталады. В-форма физиологиялық жағдайдағы тұрақты структура деп есептеледі. Сонымен қатар ДНҚ-ның А- және Z-формалары да болады. Ылғалдылық төмен болған кезде ДНҚ А-фоормасына енеді. ДНҚ-ның Z-формасы прокариоттар мен эукариоттарда кездеседі. Оның молекуласының қаңқасы зигзаг тәрізді болып келеді. Осы формадағы ДНҚ-бөлімдері гендердің жұмысын реттейді деген болжам бар.
56. Белок биосинтезінің негізгі сатылары: транскрипция және трансляция терминдеріне түсініктеме беріңіз. Белок биосинтезі процесіндегі нуклеин қышқылдарының рөлі мен клеткадағы шоғырлануын көрсетіңіз.
Белок биосинтезі. Бұл - өте маңызды үдеріс. Мұнда ДНҚ, РНҚ,АТФ және белоктардың қызметі бірігеді.
Транскрипция (лат. transcrіptіo – қайта көшіріп жазу) – тірі жасушалардағы рибонуклеин қышқылының биосинтез процесі. Ол дезоксирибонуклеин қышқылы (ДНҚ) матрицасында жүреді. Транскрипция аденин, гуанин, тимин және цитозиннің қайталанбалы тізбегінен тұратын ДНҚ молекуласындағы генетикалық ақпараттың іске асуының бірінші кезеңі. Транскрипция арнайы ДНҚ және РНҚ полимераза ферменті арқылы жүреді. Транскрипция нәтижесінде РНҚ молекуласының полимерлі тізбегі түзіледі. Бұл тізбек ДНҚ молекуласының көшірілген бөлігіне комплементарлы болады.
Транскрипция үш кезеңнен тұрады: инициация, элонгация жəне терминация.

Трансляция— полипептид тізбегінің гендегі аРНҚ негізінде ақпаратқа сай түзілуі. Трансляция болашақ белокқа тән аРНҚ-на жазылған нуклеотидтер кезегін түзілетін белоктардың амин қьішқылдарының кезегіне айналдырады. Бұл жұмысқа аРНҚ-нан басқа рибосомалар, тРНҚ, аминоацил синтетазалар, белоктан тұратын инициация, элонгация және терминация факторлары қосылған күрделі құрамдар қатынасады.
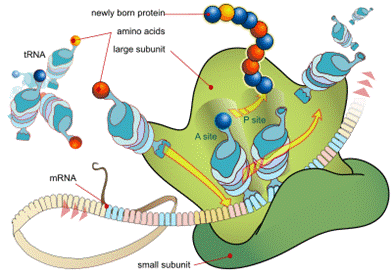
Белок биосинтезі процесіндегі нуклеин қышқылдарының рөлі мен клеткадағы шоғырлануы.Нуклеин қышқылдары биологиялық тұрғыдан маңызды рөл атқарады. Олар тірі организмдердегі генетикалық ақпаратты сақтайтын және тасымалдайтын жасушаның (жасушаның) маңызды кұрам бөліктері болып табылады. Нуклеин қышқылдары ақуыз биосинтезіне қатысады және тірі организмдерде тұқым қуалаушылықты сақтап, оның бір ұрпақтан екінші ұрпаққа берілуін қамтамасыз етеді. ДНҚ жасуша ядросының хромосомасында (99%), рибосомаларда және хлоропластарда, ал РНҚ ядрошықтарда, рибосомаларда, митохондрияда, пластидтер мен дитоплазмада кездеседі.
Олар жасушаның қай бөлігінде шоғырланса, соған байланысты қызмет атқарады. Жоғарыда айтылғандай, ДНҚ организмдегі тұқым қуалаушылық ақпаратты сақтайтын гендердің құрылыс материалы болып табылады. Ал РНҚ үш түрлі болғандықтан: рибосомдық (р-РНҚ); тасымалдаушы (т-РНҚ) және ақпараттық (а-РНҚ) әр түрлі қызметтер атқарады. ДНҚ мен РНҚ қызметтері 1940 жылдардан бастап анықталып, түрлі биологиялық тәжірибелер арқылы дәлелденген. Осы зерттеулер нәтижесінде молекулалық генетика ғылымы жедел дами бастады.

57. Тыныс алу процесіндегі гликолиздің, анаэробты және аэробты сатыларының ақырғы өнімдері мен түзілетін энергия мөлшеріне сипаттама беріңіз.
Тыныс алу туралы ілімнің негізін қалаушылар — М.В.Ломоносов (1757) және А.Л.Лавуазье (1777) болып саналады. Оттектің қатысында органикалық заттардың жануы табиғатта жүрсе, ал тірі организмдердегі тыныс алу процестері митохондрия органоидында жүзеге асады. Жану кезіндегі энергия жылу түрінде бөлінсе, ал тыныс алу кезіндегі бөлініп шыққан энергия организмдердің бүкіл тіршілік процестеріне және өзінің құрылымын белсенді күйде сақтауға жұмсалады. C6H12O6 + 6O2 = 6CO2 + 6H2O + 2881 кДж/моль
Бұл теңдеуден тыныс алу мен жану процестерінің ұқсастығын және тыныс алудың фотосинтезге қарама-қарсы процесс
Эукариоттар және көптеген прокариоттар (бактериялар) АТФ молекуласын синтездеуге қажетті энергияны глюкозаның ыдырауынан алады. Бұл процесс үш сатыға бөлінеді: 1) гликолиз; 2) лимон қышқылының айналымы; 3) электрон тасымалдау тізбегі.Гликолиздің дайындық кезеңі. Гликолиздің дайындық кезеңі ол клетканың цитоплазмасында жүреді. Мұнда арнайы ферменттердің әсерімен энергиясы мол органикалық заттар, энергиясы аз қарапайым заттарға дейін ыдырайды. Мысалы, көмірсулар — моносахаридтерге, майлар — май қышқылы мен глицеринге, нуклеин қышқылдары — нуклеотидтерге, белок — аминқышқылдарына ыдырайды. Бұл заттар келесі жүретін реакциялардың бастамасы ретінде қолданылады.
Гликолиздің оттексіз (анаэробты) ыдырауы. Бұл процесс жануарлар клеткасындағы митохондрияның ішкі мембранасында жүреді. Ол ферменттердің әсерімен бірінен кейін бірі кезектесіп жүретін 13 реакцияның жиынтығынан тұрады. Реакцияға бастапқы зат ретінде 1 моль C6H12O6 (глюкоза) қатысады. Реакция нәтижесінде 2 моль C3H6O3 (сүт қышқылы) және 2 моль АТФ түзіледі. Бұл реакцияға оттек мүлде қатыспайды, C6H12O6 + 2H3PO4 + 2АДФ = 2C3H6O3 + 2АТФ + 2H2O
Дата добавления: 2019-07-15; просмотров: 490; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
