Работа 3. Определение гемоглобина по Сали
Ход работы. В среднюю пробирку гемометра наливают 0,1 н р-р HCl до нижней метки. Пипеткой берут 20 мм3 крови и выдувают на дно пробирки, чтобы верхний слой остался неокрашенным. Не вынимая пипетки из кислоты, ополаскивают ее. Затем содержимое пробирки перемешивают, ударяя пальцем по дну пробирки, и оставляют на 5-10 минут. За это время образуется солянокислый гемин. В дальнейшем, добавляя по капле дистиллированной воды, доводят цвет содержимого пробирки до цвета жидкости в боковых пробирках гемометра. По нижнему мениску жидкости в средней пробирке отмечают содержание гемоглобина в г % или г/л.
Рекомендации к оформлению работы. В результатах работы запишите количество гемоглобина в исследуемой крови. В анализе сравните этот показатель с нормой и объясните, почему разбавление производят дистиллированной водой.
Работа 4. Расчет цветового показателя
Ход работы. Цветовой показатель вычисляют по формуле:

Рекомендации к оформлению работы. Подставьте в формулу полученные Вами в предыдущих работах показатели содержания гемоглобина и числа эритроцитов и сравните полученный ЦП с нормой.
Работа 5. Определение гематокритного числа
Ход работы. Гематокритные капилляры – это стеклянные трубочки, разделенные на 100 равных частей. Их промывают цитратом и заполняют кровью. Затем центрифугируют в клинической центрифуге при 3000 об/мин в течение 30 мин, а в угловой – при 8000 об/мин в течение 15 мин. После центрифугирования в 1-ом случае форменные элементы оседают на дно, а во втором – отбрасываются от центра на периферию капилляров.
|
|
|
Рекомендации к оформлению работы. В результатах укажите длину столбика форменных элементов, в анализе сравните полученное число с нормой.
Занятие 2
ФИЗИОЛОГИЯ ЛЕЙКОЦИТОВ
Цель занятия. Изучить функции лейкоцитов, их образование и регуляцию лейкопоэза.
Примерные вопросы для самоподготовки
1. Лейкоциты, их количество и основные группы. Методы определения числа лейкоцитов.
2. Лейкоформула и ее значение.
3. Лейкоцитоз и его виды. Лейкопения.
4. Функции гранулоцитов, регуляция их образования.
5. Функции агранулоцитов, регуляция их продукции. Мононуклеарно-фагоцитарная система.
6. Механизмы защиты клеточного гомеостаза. Неспецифическая резистентность, ее механизмы.
7. Иммунитет, его механизмы. Иммунный ответ.
8. Иммунологический надзор и иммунологическая толерантность.
9. Регуляция иммунитета. Иммунная регуляторная система.
10. Возрастные особенности физиологии лейкоцитов.
ЛЕЙКОЦИТЫ
Лейкоциты, или белые кровяные тельца, – истинные клетки крови. Они содержат ядро и органеллы.
|
|
|
По своему строению их делят на две группы: гранулоциты и агранулоциты.
Гранулоциты – лейкоциты, в цитоплазме которых содержится зернистость. К гранулоцитам относятся: нейтрофилы, эозинофилы и базофилы. Гранулоциты вырабатываются в красном костном мозге.
Агранулоциты – лейкоциты, цитоплазма которых гомогенна и не содержит зернистости. К агранулоцитам относятся: моноциты, лимфоциты, плазматические клетки. Продукция, дифференцировка и функционирование лимфоцитов происходит в лимфоидных органах: костном мозге, эмбриональной печени, вилочковой железе, лимфатических узлах, селезенке и крови. Моноциты образуются в красном костном мозге.
В кровотоке имеются два пула лейкоцитов: 1 – клетки, свободно циркулирующие в крови; 2 – клетки, занимающие краевое положение в сосудах и не участвующие в циркуляции (пристеночные, или депонированные). Это подразделение является функциональным, поскольку между циркулирующими и краевыми клетками существуют динамическое равновесие и постоянный обмен. При изменении физиологического состояния организма взаимоотношения между лейкоцитами этих пул изменяются.
В 1 л крови здорового человека содержится 4-9 ×109 лейкоцитов. Процентное соотношение отдельных форм лейкоцитов называют лейкоцитарной формулой, или лейкограммой.
|
|
|
Лейкоформула (в %)
| Число лейкоцитов в 1 л | Гранулоциты | Агранулоциты | |||||||
| Нейтрофилы | Эозино- филы | Базо- филы |
Лимфоциты |
Моноциты | |||||
| М | ю | п | с
| ||||||
| 4-9 ×109 | 0 | 0-1 | 1-5 | 45-70 | 1-5 | 0,5-1 | 25-38 | 2-9 | |
У здоровых людей она постоянна, а ее изменение – признак различных заболеваний.
Лейкоцитозы и лейкопении
Лейкоциты – одна из самых реактивных систем организма, поэтому их количество и качество изменяются при самых различных воздействиях. Общее увеличение числа лейкоцитов называют лейкоцитозом, а уменьшение – лейкопенией. Лейкоцитозы могут быть физиологическими и патологическими (истинными).
Физиологические лейкоцитозы развиваются у здоровых людей. Они имеют общие признаки:
1 – стабильность лейкоцитарной формулы;
2 – число лейкоцитов увеличивается не столь резко;
3 – имеют перераспределительный характер, обусловленный перераспределением лейкоцитов между сосудами разных органов и тканей, а также их раздепонированием;
4 – кратковременность;
5 – не изменяется функциональная активность лейкоцитов.
Различают несколько видов физиологических лейкоцитозов.
|
|
|
Пищеварительный. Он наблюдается после приема пищи и при этом число лейкоцитов увеличивается незначительно (в среднем на 1-3 тыс в 1 мкл). При этом лейкоцитозе большое число лейкоцитов скапливается в подслизистой основе тонкой кишки. Здесь они осуществляют защиту от попадания чужеродных агентов в кровь и лимфу. Увеличение числа лейкоцитов носит перераспределительный характер, а также обеспечивается поступлением белых клеток крови из депо в кровоток.
Миогенный. Наблюдается после выполнения мышечной работы. При этом число лейкоцитов в зависимости от интенсивности физического труда может возрастать в 3-5 раз. Они скапливаются в мышцах. Миогенный лейкоцитоз имеет как перераспределительный характер, так и истинный за счет усиления лейкопоэза.
Эмоциональный. Развивается при реакции “стресс”, при волнении.
Болевой. Наблюдается при болевых воздействиях.
При беременности лейкоциты скапливаются в подслизистой основе матки. Это местный лейкоцитоз. Его физиологическое назначение – предупреждение попадания инфекции в организм роженицы и стимулирование сократительной функции матки.
Истинные лейкоцитозы возникают при патологии: воспалительных процессах, инфекционных заболеваниях, лейкозах т.е. в ответ на болезнетворные воздействия.
Истинный лейкоцитоз отличается от физиологического. Главное различие – изменение лейкоцитарной формулы. Нередко наблюдается повышение индекса регенерации за счет увеличения числа молодых форм нейтрофилов. Механизм их – это усиление продукции лейкоцитов. Увеличение количества лейкоцитов при них намного больше, чем при физиологических. При истинном лейкоцитозе усиливается и функциональная активность белых кровяных телец.
В последние десятилетия у многих людей встречается стабильно низкий уровень лейкоцитов (2-3 ×109/л) без признаков поражения костного мозга или печени – доброкачественная лейкопения. Тенденция к лейкопении имеется у ваготоников (людей с повышенным тонусом парасимпатического отдела вегетативной нервной системы), у тренированных спортсменов. Умеренная лейкопения развивается при длительном пребывании (от 2 месяцев до 3 лет) на больших высотах (3960-4200 м).
Лейкопения встречается при острых вирусных инфекциях, малярии, тяжёлой пневмонии и т. д. Особенно тяжёлая лейкопения наблюдается при поражении костного мозга. При этом изменяется функциональная активность лейкоцитов, что приводит к нарушениям в специфической и неспецифической защите, попутным заболеваниям (инфекционным) и даже смерти.
Количественные изменения каждого вида лейкоцитов имеют соответствующие названия.
Вид лейкоцитов: Увеличение: Уменьшение:
нейтрофилы нейтрофилия нейтропения
эозинофилы эозинофилия эозинопения
базофилы базофилия базопения
лимфоциты лимфоцитоз лимфопения
моноциты моноцитоз монопения
НЕЙТРОФИЛЫ
Нейтрофилы – основная часть лейкоцитов периферической крови. В норме число сегментоядерных нейтрофилов в 1 мкл крови составляет 2250-6800. Снижение числа нейтрофилов у взрослых ниже 1550-2000 в 1 мкл крови – абсолютная нейтропения, увеличение их числа свыше 10000/мкл – абсолютный нейтрофильный гранулоцитоз (нейтрофилия).
Нейтрофилы – клетки округлой формы с диаметром около 12 мкм. Большую часть клетки занимает цитоплазма. В ней находятся органоиды и множество гранул, которые делят на 2 группы: первичные и вторичные. Первичные образуются на более ранних стадиях нейтропоэза, а вторичные – на стадии промиелоцита. В зрелых нейтрофилах превалируют вторичные гранулы. Первичные гранулы по набору ферментов – это типичные лизосомы. Вторичные гранулы – типичная специфическая зернистость нейтрофилов. Зернистость нейтрофилов одинаково хорошо окрашивается и кислыми, и основными красителями – отсюда и название этих лейкоцитов – нейтрофилы.
В целом в гранулах находятся различные факторы, определяющие функции нейтрофилов:
лизосомальные ферменты (это в основном гидролазы, используемые при фагоцитозе);
фибринолитические ферменты (активатор плазминогена, плазминоген);
лизоцим (бактерицидный агент);
супероксиддисмутаза (фермент, трансформирующий супероксид в пероксид водорода);
лейкотриены, которые, вероятно, выполняют роль хемоаттрактантов.
Ядро в нейтрофилах может быть круглым, бобовидным, вытянутым в виде палочки или состоять из нескольких сегментов. Это зависит от степени зрелости клетки. Благодаря этому различают миелоциты, юные (или метамиелоциты), палочкоядерные и сегментоядерные нейтрофилы.
В норме взаимоотношения между разными видами нейтрофилов выражены в форме индекса ядерного сдвига или регенерации:
ИЯС = 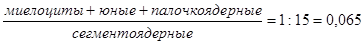
В норме ИЯС может колебаться от 0,05 до 0,1.
Индекс ядерного сдвига – отношение суммы процентного количества всех молодых форм нейтрофилов (миелоцитов, метамиелоцитов и палочкоядерных форм) к проценту сегментоядерных нейтрофилов. При увеличении количества молодых форм нейтрофилов этот индекс увеличивается. Это наблюдается при различных инфекциях (ангине, гнойном отите, аппендиците, холецистите, перитоните, пиелонефрите, туберкулезе и пр.). Увеличение индекса регенерации выше нормальных показателей – это так называемый сдвиг влево. Происхождение термина объясняется тем, что молодые формы нейтрофилов в лейкограмме располагаются слева. Левый сдвиг нередко является ранним признаком рака костного мозга. Резчайший сдвиг влево (до промиелоцитов) наблюдается при тяжелых лекарственных дерматитах.
Возможен и сдвиг вправо, например, при В12 – дефицитной анемии, тяжелом сепсисе. При этом количество молодых форм (палочкоядерных) нейтрофилов уменьшается.
Основные функции нейтрофилов
1 – фагоцитоз; 2 – внутриклеточное переваривание; 3 – цитотоксическое действие; 4 – дегрануляция с выделением лизосомальных ферментов.
В основе этих функций лежат такие свойства, как адгезия (прилипание), агрегация (скучивание), двигательная активность. Этому способствуют изменения физико-химических свойств, метаболизма и структуры клеток по мере их созревания. Так, на поверхности нейтрофилов увеличивается количество активных групп, несущих отрицательный заряд, образуется слой, который состоит из сиаловых кислот, рецепторной системы, обеспечивающей хемотаксис.
Увеличение объема цитоплазмы, изменения ее состава и физико-химических свойств, структуры ядра и другие факторы обусловливают деформабельность клетки, ее подвижность.
Для нейтрофилов характерны следующие виды движения:
1 – внутриклеточные – текучесть цитоплазмы, или циклоз, осцилляция центросом, ротация ядра, вращение клетки вокруг центросомы, сокращение вакуолей;
2 – движение клеточной поверхности (непрерывное, волнообразное);
3 – спонтанное распластывание на поверхности;
4 – цитоплазматическая экспансия – образование выростов, псевдоподий;
5 – хемотаксис – целенаправленное движение к объекту фагоцитирования (к микробу);
6 – движения, связанные с экзоцитозом и эндоцитозом.
Эндоцитоз – это проникновение в клетку различных субстанций при участии псевдоподий, инвагинаций и т.д. К эндоцитозу относятся фагоцитоз, пиноцитоз.
Экзоцитоз – выделение в окружающую клетку среду различных субстанций (продуктов фагоцитоза), которое происходит путем секреции. Все эти виды клеточного движения имеют существенное значение в фагоцитозе.
Различные функциональные свойства нейтрофилов (их двигательная активность, скорость изменения движения, адгезия и др.) изменяются по мере созревания клеток. Так, при этом усиливается адгезивная способность, броуновское движение зернистости. Чем более зрелой становится клетка нейтрофильного ряда, тем большей способностью она обладает к распластыванию, цитоплазматической экспансии, миграции. Если скорость движения метамиелоцита составляет 3-7 мкм/мин, то у сегментоядерного нейтрофила она в 4-7 раз выше (28 мкм/мин).
Именно благодаря способности лейкоцитов к движению, обеспечиваются многие их функции, прежде всего фагоцитоз. Нейтрофилы являются основной армией, ведущей борьбу с микробами.
Фагоцитоз и внутриклеточное переваривание чужеродных тел открыл в 1892 году наш великий соотечественник Илья Ильич Мечников. Он явился создателем фагоцитарной теории иммунитета, за что в 1908 году И.И. Мечников был удостоен звания Лауреата Нобелевской премии.
Фагоцитоз включает ряд последовательных этапов: распознавание объекта (микроба); целенаправленное движение к нему (хемотаксис); аттракция – прилипание объекта к поверхности фагоцита с постепенным погружением в клетку и образованием фагосомы; поглощение; ферментативное расщепление; переваривание.
Фагоцитоз может быть завершенным, когда объект практически растворяется и остатки переваренного материала выбрасываются из клетки, и незавершенным, когда размножающиеся микроорганизмы разрушают фагоцитирующую клетку.
Зрелый нейтрофил фагоцитирует до 20-30, юные и палочкоядерные – 10-15 микробов. Фагоцитирующую активность нейтрофилов усиливают антитела, пропердин, витамины (особенно аскорбиновая кислота), а ацетилхолин – тормозит.
Процесс фагоцитоза протекает со значительными биохимическими сдвигами в нейтрофилах. Бактерицидная система нейтрофилов может быть кислородзависимой и кислороднезависимой.
При участии кислородзависимой системы резко увеличивается потребление О2 (до 50 раз), что связано с активацией НАДФ-Н-оксидазы, которая находится в цитоплазматической мембране специфических гранул. До начала фагоцитоза этот фермент не активен. Он активируется при слиянии гранул с фагосомой, после чего под влиянием этого фермента происходит образование перекиси водорода. Перекисные радикалы играют важную роль в бактерицидной активности клетки, которая увеличивается под действием миелопероксидазы и радикала Cl-, так как под их влиянием перекись водорода преобразуется в хлорноватистую (гипохлорную) кислоту, обладающую высокой активностью в “убийстве” аэробных бактерий и грибов.
Кислороднезависимая бактерицидная система включает следующие агенты.
Катионный белок, который активен только в отношении грамотрицательных микробов. Действие белка основано на увеличении проницаемости мембраны бактерий для различных гидрофобных молекул.
Лизоцим (мурамидаза) вызывает гидролиз гликопротеидов оболочки.
Фагоцитин обладает антибактериальным действием и способен уничтожить грам- и грам+ микрофлору.
Амилолитические, протеолитические и липолитические ферменты гранул фагоцитов разрушают мембрану бактерий и вирусов.
После “убийства” микробов происходит их полное разрушение под действием различных протеаз и липаз, а затем – экзоцитоз. С момента поглощения микробов клетка изменяет форму, становится малоподвижной и при эффективном фагоцитозе сегментарный нейтрофил погибает. Этому могут способствовать и активные радикалы.
Наряду с основной функцией нейтрофилов – фагоцитозом, важными являются и другие, такие как внутриклеточное переваривание, дегрануляция с выделением лизосомальных ферментов и цитотоксическое действие. Цитотоксический эффект, или киллинг, открыт в 1968 году. Он заключается в том, что нейтрофилы в присутствии иммуноглобулинов JgG и при наличии комплемента подходят к клетке-мишени, но не фагоцитируют его, а повреждают на расстоянии. Это осуществляется за счет уже рассмотренных бактерицидных систем нейтрофилов (за счет выделения пероксида водорода и гипохлорной кислоты). Цитотоксический эффект активируется под влиянием фактора, вырабатываемого Т-лимфоцитами.
Перечисленные функции можно объединить как участие нейтрофилов в клеточном неспецифическом иммунитете. Вместе с тем, они участвуют и в механизме специфического иммунитета. Так, они усиливают продукцию антител В-лимфоцитами, вырабатывают модуляторы активности В- и Т- лимфоцитов, которые, в частности, влияют на функции Т-супрессоров: в малых концентрациях они ингибируют, а в больших стимулируют эти клетки.
И, наконец, нейтрофилы участвуют в свертывании крови и фибринолизе, влияют на реологические свойства крови, а, выделяя пироген, на терморегуляцию.
Кинетика нейтрофилов.Нейтрофилы образуются в красном костном мозге из стволовой кроветворной клетки. Она под влиянием интерлейкина-III дифференцируется в моноциты и нейтрофилы. Процесс дифференцировки стимулируют нейтрофилопоэтины, которые продуцируются распавшимися нейтрофилами, а тормозят – кейлоны.
Нейтрофилы созревают в красном костном мозге. Из него поступают в циркулирующую кровь. Проникновение гранулоцитов в сосудистое русло – это активный процесс. Он происходит благодаря их амебовидному движению, изменению формы и выделению протеолитических ферментов, уменьшающих вязкость основного вещества соединительной ткани.
Время циркуляции нейтрофилов в крови составляет 6-10 часов, а затем они переходят в ткани. В физиологических условиях из тканей в кровь они не возвращаются. В основном они депонируются в капиллярной сети легких, в меньшей степени – в печени и селезенке. Выходу клеток в ткани способствует присущее нейтрофилам функциональное свойство - двигательная активность. В тканях они участвуют в фагоцитозе, в процессе которого большинство погибает, а часть удаляется из организма через желудочно-кишечный тракт. Продолжительность жизни 13-14 дней.
В кровотоке имеется два пула нейтрофилов, как и других лейкоцитов: свободноциркулирующие и пристеночные (маргинальные, капиллярные). В нормальных условиях между обоими пулами происходит постоянный обмен. Число клеток, входящих в эти группы, не является постоянным. Так, при мышечной нагрузке, введении адреналина увеличивается число циркулирующих нейтрофилов за счет уменьшения числа пристеночных. При повышении содержания гистамина в крови, коллапсе увеличивается число пристеночных нейтрофилов. Следует учитывать, что в сосудистом русле нейтрофилов в 2 раза больше, чем в вытекающей из сосудов крови.
Регуляция продукции нейтрофилов. Специфическими регуляторами нейтропоэза являются нейтропоэтины и кейлоны, вырабатываемые самими нейтрофилами. Нейтропоэтины стимулируют процесс образования нейтрофилов, кейлоны – ингибиторы клеточного деления – тормозят его. Темпы гранулоцитопоэза определяются балансом лейкопоэтинов и кейлонов. Глюкокортикоиды стимулируют нейтропоэз. Они ускоряют выход нейтрофилов из костного мозга в кровь, дольше задерживают их в крови, ускоряют созревание молодых гранулоцитов. Созревание нейтрофилов стимулируют соматотропный гормон и андрогены (за счет действия на стволовые клетки и пролиферативную стадию). Считают, что нейтропоэз усиливают через нейтропоэтины и продукты распада самих клеток и тканей (при воспалении и повреждении), микробы и их токсины.
В клинической практике отмечается гипофункция нейтрофилов. Она бывает врождённой и приобретённой. Гипофункция проявляется в снижении миграционной и бактерицидной активности нейтрофилов. Её вызывают продукты жизнедеятельности микроорганизмов, подвергаемых фагоцитозу, высокая температура среды, фармакологические препараты (антибиотики, анестетики), избыток антител и иммунных комплексов, ингибиторы, выделяемые растущей опухолью, недостаток белка в организме. Поэтому в клинике необходимо исследовать не только количество нейтрофилов в периферической крови, но и их функциональную активность.
БАЗОФИЛЫ
Базофилы – это самая малочисленная группа лейкоцитов. В периферической крови их содержится 0,5-1% (22-95 в 1мкл). В базофилах имеется мелкая и крупная зернистость, причем последняя окрашивается основными красками, отсюда и название этих лейкоцитов. В различных тканях и органах локализованы тучные клетки (тканевые базофилы).
В базофилах и тучных клетках содержатся многие биологически активные вещества. Эти вещества делят на 2 группы: 1 – постоянно присутствующие в клетке и выделяемые в покое (гистамин, гепарин, серотонин, эозинофильный хемотаксический фактор) и 2 – образующиеся и выделяемые в период сенсибилизации, при взаимодействии базофилов и тучных клеток с антигеном (медленно реагирующее вещество анафилаксии; фактор, активирующий тромбоциты; простагландины; нейтрофильный хемотаксический фактор). При локальном выделении этих факторов возникает аллергическое воспаление, а при выделении в общий кровоток – анафилактический шок, обусловленный резким снижением артериального давления.
Гепарин – основной антикоагулянт (он препятствует свертыванию крови). Он ингибирует расщепление фибрина, гистаминазу (фермент, разрушающий гистамин), фагоцитоз и пролиферативные процессы.
Гистамин – повышает проницаемость тканей, расширяет артериолы, увеличивает число функционирующих капилляров, участвует в возникновении воспалительного отека.
Эозинофильный и нейтрофильный хемотаксические факторы способствуют движению эозинофилов и нейтрофилов к месту накопления базофилов.
В основе функционирования базофилов лежат 3 механизма: синтез и реабсорбция биологически активных веществ; образование гранул и дегрануляция – выделение этих активных веществ из базофилов с последующим развитием различных реакций, в частности, аллергических.
Участие базофилов и тучных клеток в аллергических реакциях – это главная их функция. Основным медиатором реакций гиперчувствительности является гистамин. На цитоплазматической мембране базофилов и тучных клеток имеются рецепторы для IgE, IgG, комплемента, гистамина (Н2-рецепторы). Наличие последних на тучных клетках имеет важное значение в механизме обратной связи, обеспечивающим самоограничение аллергической реакции немедленного типа. Когда антигены (аллергены) действуют на В-лимфоциты кожи, желудочно-кишечного тракта, легких, то образуется большое количество антител – иммуноглобулинов (JgE), которые, циркулируя в крови, связываются с соответствующими рецепторами названных клеток. В результате кооперирования 2-х молекул JgЕ с аллергеном в базофилах и тучных клетках происходит снижение уровня цАМФ и увеличение проницаемости мембраны для внеклеточных ионов кальция, которые необходимы для высвобождения гистамина и других медиаторов аллергической реакции. Биохимические сдвиги, происходящие в этих клетках, приводят к дестабилизации последних – наступает дегрануляция и высвобождение медиаторов. Выделению гистамина способствуют также лимфокины. Дегрануляция клеток и высвобождение из них медиаторов осуществляется также под влиянием иммунных комплексов, действие которых опосредуется путем активации комплемента, выработки анафилотоксинов и выделения катионных белков из нейтрофилов. Сам процесс дегрануляции – это изменение мембраны гранул, вытеснение их содержимого через поры мембраны клеток в окружающую их среду.
Медиаторы аллергической реакции вызывают повышение проницаемости сосудов и сокращение гладкой мускулатуры, индукцию хемотаксиса и активацию других клеток, принимающих участие в воспалении (эозинофилов, нейтрофилов, тромбоцитов), модуляцию высвобождения других медиаторов.
Быстрое выделение гистамина и других медиаторов клинически вызывает проявления реакции гиперчувствительности немедленного типа при бронхиальной астме, аллергическом рините и других заболеваниях.
В последнее время привлекает внимание участие базофилов и тучных клеток в реакциях гиперчувствительности замедленного типа. При этом клеточные инфильтраты могут включать моноциты, макрофаги, нейтрофилы, базофилы в различных соотношениях. Такие реакции наблюдаются при контакте с паразитами, белковыми и тканевыми аллергенами, при вирусных инфекциях и опухолях. Клинически у больных отмечаются эритематозные пятна, инфильтраты.
Базофилы могут вовлекаться в иммуноопосредованные процессы и через систему комплемента. Известно, что медиатором анафилактического шока являются анафилотоксины. Они образуются в процессе активации компонентов С3а, С5а системы комплемента. При их взаимодействии с соответствующими рецепторами на поверхности базофилов последние активируются, образуются анафилотоксины и под их влиянием высвобождаются гистамин, лейкотриены (С4 и Д4) – активные факторы медленно действующего вещества анафилаксии. Этот комплементзависимый механизм активации базофилов и тучных клеток может иметь значение в патогенезе воспаления, аллергических реакций, не связанных с накоплением IgG и IgE – реагиновых антител, псевдоаллергических реакциях, вызываемых различными химическими и биологическими агентами.
Базофилы и тучные клетки играют важную роль в системе местного иммунитета кожи и слизистых оболочек. Известно, что малые дозы антигена стимулируют выработку IgE – антител, которые в месте образования быстро фиксируются к рецепторам базофилов и тучных клеток и, таким образом, обеспечивают локальную иммунную защиту. Если же антиген действует повторно, то из сенсибилизированных тучных клеток высвобождаются вещества, активирующие локальную микроциркуляцию путем привлечения в это место различных защитных факторов плазмы и клеток. Следовательно, тучные клетки в комплексе с IgE участвуют в поддержании местного иммунитета кожи и слизистых оболочек, в профилактике генерализации инфекционного процесса.
Базофилы и тучные клетки вместе с эозинофилами участвуют в защите организма от гельминтных инвазий.
Базофилы и тучные клетки принимают участие в трофике тканей в норме и патологии, в интегральной деятельности иммунной системы. Это обеспечивается способностью этих клеток к миграции и хемотаксису, которую усиливают калликреин плазмы, компоненты комплемента, но основной стимулятор – это лимфокин, продуцируемый сенсибилизированными Т-лимфоцитами.
Базофилы и тучные клетки также способны к фагоцитозу различных частиц, сенсибилизированных эритроцитов, лейкоцитов и др. с формированием фагосомы. Но фагоцитоз остается незавершенным.
В процессе дегрануляции из базофилов и тучных клеток выделяются вещества (фактор, активирующий тромбоциты, вазоактивные амины, калликреин, простагландины, гепарин), которые влияют на систему гемокоагуляции.
Учитывая содержащиеся и синтезируемые при сенсибилизации биологически активные соединения и эффекты их действий, а также физиологические свойства самих клеток, можно суммировать функции базофилов и тучных клеток.
1 – участие в формировании аллергических реакций;
2 – очищение среды от биологически активных веществ путем их поглощения;
3 – синтез и выделение в среду биологически активных веществ;
4 – регуляция микроциркуляции;
5 – регуляция проницаемости капилляров;
6 – участие в процессах пролиферации клеток тканей;
7 – участие в механизмах иммунных реакций, в том числе в реакциях клеточного иммунитета совместно с макрофагами и нейтрофилами-фагоцитами.
8 - участие в свёртывании крови.
Кинетика базофилов и тучных клеток. Созревают в костном мозге 1,5-2,5 сутки. Несколько суток депонируются в синусах костного мозга и через 3-7 дней поступают в кровь, где находятся короткое время (8,3 ч). После дегрануляции они погибают. Тучные клетки происходят из гемопоэтических клеток, имеют общую клетку-предшественницу с базофилами. В норме тучные клетки в периферической крови не определяются, в костном мозге могут быть единичные клетки. Они определяются в соединительной ткани вблизи эпителиальных клеток, в окружности кровеносных сосудов, в серозных полостях. Длительность их жизни дольше базофилов и при отсутствии физиологических и патологических стимуляторов может доходить до 2 лет.
Регуляция продукции. Базофилопоэз стимулируют базофилопоэтины и эстрогены, угнетают стероидные гормоны, тироксин. Базофилия наблюдается во время регенеративной (заключительной) фазы острого воспаления, при аллергических реакциях. При стрессовых ситуациях, хроническом воспалении число базофилов увеличивается в небольшой степени.
ЭОЗИНОФИЛЫ
Эозинофилы крупнее нейтрофилов. Их количество в периферической крови колеблется в пределах 1-5% (45-70 в 1 мкл). Если содержание их числа более 0,5 ×109/л – это эозинофилия.
Характерным признаком эозинофилов является наличие специфических оксифильных гранул, содержащих большой основной белок, богатый аргинином. Этот белок обладает цитотоксичностью, повреждает некоторые личинки гельминтов, нейтрализует гепарин. Кроме этого имеются катионные белки, влияющие на течение воспалительных реакций и плазменно-коагуляционное звено гемостаза. Эти белки, полагают, разрушают эндотелий, способствуют развитию некоторых видов патологии сердца и сосудов через активацию калликреин-кининовой системы. Находится также и эозинофильный протеин-Х (идентичный нейротоксину, вырабатываемому эозинофилами).
В отличие от нейтрофилов в эозинофилах наблюдается высокий окислительный метаболизм и они образуют больше перекиси водорода. Арилсульфатаза эозинофилов ингибирует анафилактоидные вещества, тем самым подавляет реакции гиперчувствительности незамедленного типа. Простагландины, выделяемые эозинофилами, угнетают дегрануляцию тучных клеток. При участии ферментов (гистаминазы, арилсульфатазы, фосфолипазы) и большого основного белка эозинофилы инактивируют гистамин и гепарин. Они синтезируют плазминоген, поэтому при их разрушении нарушается фибринолиз.
Эозинофилы участвуют в регуляции гемопоэза, в частности, гранулопоэза. Полагают, что они через простагландины Е угнетают образование гранулоцитарно-микрофагальных колоний. Этим объясняется частое возникновение нейтропении при эозинофилиях.
Эозинофилы обладают, как и нейтрофилы, способностью к амебоидному движению, хемотаксису. Простагландины типа Д2 и Е2 стимулируют мембрану эозинофилов, вызывая их двигательную активность. Хемотаксическую активность этих лейкоцитов при аллергических реакциях вызывают эозинофильные хемотаксические факторы анафилаксии, лимфокины, монокины, иммунные комплексы, хемотаксический фактор эозинофилов (выделяемый сегментоядерными нейтрофилами, базофилами и тучными клетками), гистамин и др.
Эозинофилы обладают фагоцитарной активностью, но меньшей, чем нейтрофилы. Они фагоцитируют бактерии, грибы, микоплазму, иммунные комплексы, продукты распада тканей.
Установлено, что эозинофилы содержат стимуляторы синтеза ДНК в фибробластах, что обусловливает фиброз тканей при паразитарной их инфильтрации.
Основные функции эозинофилов
1. Уменьшение аллергической реакции гиперчувствительности немедленного типа. При этой реакции рецепторы базофилов и тучных клеток связываются с антителами-JgE, что вызывает дегрануляцию этих клеток с высвобождением биологически активных веществ, в том числе гистамина и эозинофильного хемотаксического фактора, это сигнал к движению в очаг аллергизации форменных элементов крови, в том числе и эозинофилов. Последние инактивируют гистамин. Причем это осуществляется двумя путями.
Первый способ инактивации гистамина происходит благодаря наличию на эозинофилах связывающих его гистаминовых рецепторов и за счет фагоцитоза ими гранул тучных клеток, гистамин которых разрушает гистаминаза эозинофилов.
Второй способ инактивации гистамина – это угнетение его высвобождения из базофилов и тучных клеток. Установлено, что в эозинофилах имеется фактор, тормозящий выделение гистамина (вероятно, простагландины Е1 и Е2). Этот фактор освобождается из эозинофилов при их разрушении и при контакте с антителами-JgE. Под влиянием этого агента в базофилах и тучных клетках активируется аденилатциклаза, что ведет к усилению синтеза цАМФ. Увеличение содержания цАМФ тормозит высвобождение не только гистамина, но и других биологически активных веществ из базофилов и тучных клеток. Кроме того, арилсульфатаза В эозинофилов инактивирует медленно реагирующее вещество анафилаксии; большой основной белок – гепарин; фосфолипаза Д – литический фактор тромбоцитов, препятствующий выходу их них серотонина. Эозинофильный фактор стимуляции фибробластов способствует фиброзированию местного очага, его ограничению и в сочетании с инактивацией гистамина значительному уменьшению выраженности местных реакций в тканях при аллергической реакции и воспалении.
2. Противоглистный иммунитет, или цитотоксический эффект. Этот эффект опосредован JgG-антителами и комплементом. Последний может активироваться как противоглистными JgG-антителами, так и наружными покровами гельминтов, которые покрываются активированными С3- и JgG-антителами. Киллерный эффект эозинофилов осуществляется следующим образом. При инвазии личинок гельминтов их антигены стимулируют выработку JgE, которые сенсибилизируют в этом месте базофилы и тучные клетки. В результате последние дегранулируют с высвобождением многих веществ, в том числе хемотаксического фактора эозинофилов, гистамина и др. К месту инвазии привлекаются эозинофилы, они активируются и их рецепторы соприкасаются с антителами-JgG и активированным С3 на поверхности личинок. Это приводит к дегрануляции эозинофилов с отложением большого основного белка и пероксидазы на поверхности личинок, что вызывает их повреждение, лизис и гибель.
3. Предупреждение проникновения антигена в сосудистое русло. Эта функция связана с тем, что эозинофилы тропны к поверхностным тканям: выйдя из капилляров, они встречают на пути антигены и связывают их. Этим самым они препятствуют попаданию антигенов в сосуды.
Кинетика эозинофилов. Около 9 дней они созревают в костном мозге. После этого они попадают в кровь, при этом 50% из них в течение 1 ч оседают в тканях. Период полужизни эозинофилов в крови составляет 3-8 ч. Из крови эозинофилы мигрируют в ткани, чаще в слизистую оболочку дыхательных путей, желудочно-кишечного тракта, мочеполовой системы, кожу и др. Обычно из тканей эозинофилы в кровь не возвращаются, лишь изредка возможна их рециркуляция. В тканях они живут несколько дней и затем погибают. Соотношение числа эозинофилов крови и ткани равно 1:300-1:500.
Регуляция продукции эозинофилов. Основные гуморальные стимуляторы эозинофилопоэза – эозинофилопоэтины. Усиливает продукцию этих клеток также эозинофилостимулирующий фактор (один из лимфокинов), выделяемый лимфоцитами. Эозинофилия отмечается при аллергии, при глистной инвазии, при антибактериальной терапии. Это увеличение числа эозинофилов вызвано усиленным поступлением гистамина в кровь и ткани.
Эозинопению вызывают АКТГ, глюкокортикоиды и адреналин. Так, механизм действия последних заключается в том, что они:
во-первых, угнетают деление и разрушают лимфоциты, что уменьшает выделение эозинофилстимулирующего фактора;
во-вторых, увеличивают содержание эозинофилов в тканях;
в-третьих, задерживают их в костном мозге;
в-четвертых, усиливают фагоцитарную активность элементов МФС в отношении эозинофилов.
Отсюда понятно развитие эозинопении при стрессе: активация симпатоадреналовой системы и глюкокортикоидной функции надпочечников. С этим связан суточный ритм эозинофилов (максимум - в утренние часы, минимум - в вечерние).
Эозинопения наблюдается при анафилактическом шоке, в острую фазу многих инфекционных процессов. При шоке уменьшение числа эозинофилов в крови обусловлено быстрым поступлением их из крови в ткани (тканевая эозинофилия).
МОНОЦИТЫ
Моноциты крови – это центральное звено мононуклеарной фагоцитарной системы (МФС), или системы мононуклеарных фагоцитов (СМФ). В эту систему входят моноциты, макрофаги и их предшественники.
Дата добавления: 2018-10-26; просмотров: 313; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
