Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Ну что ж, третья лекция ?
 Лекция 3
Лекция 3
Типы химической связи. Кристаллическая решетка.
Вещества молекулярного и немолекулярного строения.
 Образование химической связи
Образование химической связи
Атомы химических элементов практически всегда образуют соединения. Исключением являются благородные газы, принадлежащие главной подгруппе VIII группы Периодической таблицы. Почему они инертны? Их низкая активность объясняется заполненностью орбиталей внешнего энергетического уровня. Им просто не нужно отдавать свои или принимать чужие электроны.
Значит, соединения атомов различных элементов возможны только при наличии свободных орбиталей, с содержащимися в них валентными электронами на внешнем слое атома. Поведение химического элемента в реакциях зависит от валентных электронов, чем их меньше, тем активнее элемент отдает их и, наоборот, чем больше валентных электронов, тем неохотнее элемент разлучается с ними.
Запомните! Если элемент легко отдает свои электроны, то он проявляет восстановительные свойства, ну а если тяжело, то окислительные
Итак, чаще всего вещества состоят из групп атомов, насчитывающих несколько единиц или даже тысяч. А удерживает их особая сила - химическая связь.
Химическая связь – это взаимодействие, обеспечивающее связь между атомами, преобразуя их в сложные группы.
В основе химических связей лежат определенные электростатические силы притяжения и отталкивания, обуславливающие взаимодействие положительно заряженных ядер и отрицательно заряженных электронов. Электрон, двигаясь между ядрами, притягивает их к себе, что приводит к понижению полной энергии. Это и есть необходимое условие для того, чтобы атомы начали связываться между собой.
|
|
|
При образовании какой - либо химической связи, каждый отдельный атом выделяет энергию, необходимую для разъединения частиц на расстояние, при котором их взаимодействие стало бы невозможным. Эта энергия называется энергией связи. Валентные электроны имеют наименьшую энергию связи.
В процессе химической связи, отдельный атом стремится получить свою электронную конфигурацию близлежащих по таблице благородных газов. То есть атому необходимо приобрести на внешнем электронном слое 8 или 2 электрона и стать устойчивым и прочным.
Рассмотрим следующие типы связи:
- ковалентную,
- ионную,
- металлическую,
- водородную.
 Ковалентная связь
Ковалентная связь
Ковалентная связь – химическая связь, образованная перекрытием парой электронов, принадлежащих двум атомам.
Схематически этот процесс можно изобразить так: A· + ·В → А:В. В результате энергетический уровень заполняется.
|
|
|
На рисунке изображено как происходит перекрытие s- и р-орбиталей, а также уже смешанных орбиталей, которые называются гибридными:
Существуют два пути образования ковалентной связи. Перекрытием двух орбиталей атомов-соседей, имеющих по одному свободному электрону, либо перекрытием свободной орбитали атома с орбиталью другого атома, имеющего электронную пару. Второй путь называется донорно-акцепторным механизмом.

Тааак, вспоминаем , кто такой донор . Донор – тот кто отдает. А что может отдавать атом ? Что у него есть ? Правильно, электроны !
Донор – это определенный атом, который предоставляет неподелённую электронную пару.
Если донор дает, соответственно акцептор должен их принять ? Куда? Естественно, на орбиталь. Но она тогда должна быть свободна у него!
Акцептор - это атом, который содержит в себе свободную орбиталь.

Способность атомов притягивать электроны у разных элементов различна. Она обусловлена электроотрицательностью. Если электроотрицательность соединяющихся атомов не слишком различна, возникает полярная ковалентная связь. При одинаковой электроотрицательности, если соединяются атомы одного элемента - неметалла, образующаяся связь называется ковалентной неполярной. Ну, а если электроотрицательность различается сильно, то возникает ионная связь.
|
|
|
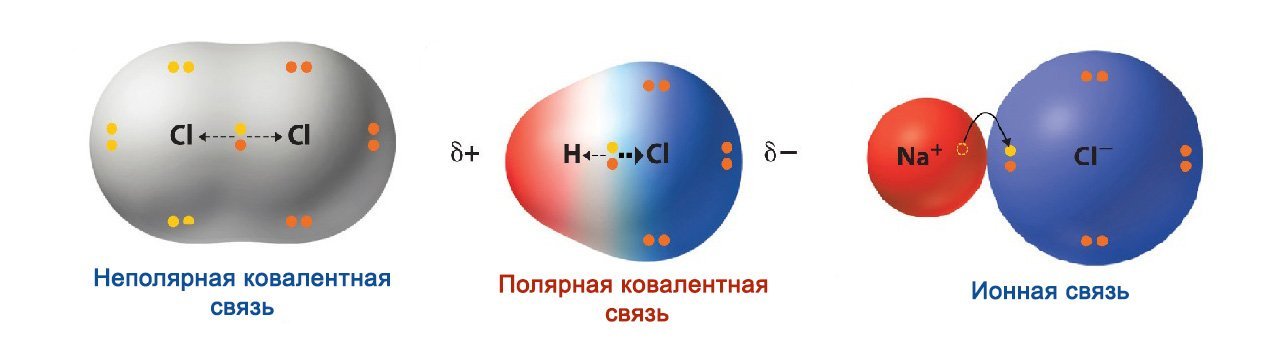
Рассмотрим пример соединения атомов водорода и фтора. Для начала вспомним их электронные конфигурации:
Н - 1s1
F - 1s1 2s2 2p5
Расположение электронов по орбиталям выглядит так:

Увидим на рисунке как s-электрон водорода перекроется с p-электроном фтора:

После чего орбитали фтора будут выглядеть так:

Если орбитали перекрываются вдоль линии связи, возникает σ-связь (сигма-связь):

Дополнительное перекрытие орбиталей перпендикулярно линии связи приводит к возникновению π-связь (пи-связи):


Межъядерное расстояние - длина связи, уменьшается с образованием кратных связей (двойных или тройных), которые образуются сочетанием σ+π и тройных σ+π+π. А σ связь называется одинарной.
В химии геометрическое изображение длины связи и валентных углов (между линиями связи атомов) называется гибридизацией - это уравнивание орбиталей по форме и энергии и образование одинаковых.
Гибридизация бывает следующих типов:

|
|
|
 Ионная связь
Ионная связь
Ионной связью считается предельный случай ковалентной полярной связи. В ковалентной - полярной связи общая электронная пара всегда перемещается к одному из пары атомов. В ионной связи электронная пара полностью принадлежит одному из атомов. Атом, который отдает электрон, впоследствии получает положительный заряд. После чего он становится катионом. Атом, который забирает электроны, приобретает отрицательный заряд, вследствие чего становится анионом. Из этого следует, что ионная связь — такая связь, которая образуется за счет электростатического притяжения, которое происходит между катионами и анионами.

 Металлическая связь
Металлическая связь
Данный тип связи образуется в металлах. У атомов всех металлических элементов на внешнем электронном слое содержатся электроны, которые имеют низкую энергию, связывающую с ядром атома. Энергетически выгодный процесс для металлов - потеря внешних электронов. Из – за достаточно слабого взаимодействия с ядром, электроны, содержащиеся в металлах, достаточно подвижны. В каждом кристалле металла происходит данный процесс – Ме0 — ne− = Mеn+ . В данной формуле Ме0 является нейтральным атомом металла. Mеn+ - это катион этого же металла.

 Водородная связь
Водородная связь
Если атом водорода в любом химическом веществе взаимосвязан с элементом, который имеет высокую электроотрицательность, например азот, кислород или фтор, для данного вещества характерна водородная связь. Атом водорода прочно взаимосвязан с атомом, имеющим электроотрицательный характер. Поэтому общая электронная пара будет смещена от водорода к электроотрицательному элементу.
 На атоме водорода образуется положительный заряд, на атоме электроотрицательного элемента — отрицательный. Благодаря наличию данных зарядов, становится возможным электростатическое притяжение, которое происходит между положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой.
На атоме водорода образуется положительный заряд, на атоме электроотрицательного элемента — отрицательный. Благодаря наличию данных зарядов, становится возможным электростатическое притяжение, которое происходит между положительно заряженным атомом водорода одной молекулы и электроотрицательным атомом другой.
Водородной связью так же объясняется достаточно высокая температура плавления воды. Прочные водородные связи образуются в следующих веществах: фтороводород, аммиак, кислородсодержащие кислоты.
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
 Молекулярные и немолекулярные вещества
Молекулярные и немолекулярные вещества
По строению химические вещества делятся на две группы: те, которые состоят из молекул называются молекулярными, а содержащие атомы и ионы – немолекулярными.
Молекулярные вещества имеют низкие t плавления/кипения. Они могут находится в трех агрегатных состояниях: жидком, твердом, газообразном. К этой группе относятся большинство простых веществ неметаллов, а также их соединений друг с другом. Связи между атомами молекулярных веществ являются ковалентными.
Немолекулярные вещества имеют высокие t плавления/кипения. Находятся в твердом состоянии. Это, как вы догадались, простые вещества металлы, их соединения с неметаллами, из неметаллов относятся бор, углерод – алмаз, фосфор (черный и красный), кремний.
 Типы кристаллических решеток
Типы кристаллических решеток
Существуют четыре типа кристаллических решеток, зависящих от располагающихся в узлах решетки типов частиц:
 1) Ионная кристаллическая решетка характерна для соединений с ионным типом химической связи. В узлах решетки располагаются катионы и анионы. Примерами веществ с данным типом кристаллической решетки являются соли, оксиды и гидроксиды типичных металлов. Это твердые, но хрупкие вещества. Им свойственна тугоплавкость. Растворяются в воде и обладают электропроводностью.
1) Ионная кристаллическая решетка характерна для соединений с ионным типом химической связи. В узлах решетки располагаются катионы и анионы. Примерами веществ с данным типом кристаллической решетки являются соли, оксиды и гидроксиды типичных металлов. Это твердые, но хрупкие вещества. Им свойственна тугоплавкость. Растворяются в воде и обладают электропроводностью.
 2) Атомная. В узлах атомы. Частицы образуют ковалентную неполярную и полярную связи. Данный тип принадлежит из простых веществ углероду в состоянии графита и алмаза, бору, кремнию, германию, а также сложным веществам, к примеру оксиду кремния (кварц, горный хрусталь). Это очень твердые тугоплавкие вещества, мало распространенные в природе. Не растворяются в воде.
2) Атомная. В узлах атомы. Частицы образуют ковалентную неполярную и полярную связи. Данный тип принадлежит из простых веществ углероду в состоянии графита и алмаза, бору, кремнию, германию, а также сложным веществам, к примеру оксиду кремния (кварц, горный хрусталь). Это очень твердые тугоплавкие вещества, мало распространенные в природе. Не растворяются в воде.

3) Молекулярная. Данный тип кристаллической решетки образуется молекулами, удерживаемые слабыми силами межмолекулярного притяжения. Поэтому вещества данного типа решетки отличаются малой твердостью, непрочностью и низкими t плавления. К примеру, это вода в ледяном состоянии. Большинство твердых органических соединений имеют этот тип решетки. Тип связи в соединении – ковалентная.
 4) Металлическая. В узлах расположены атомы и катионы металла. Это металлы и их сплавы, соединения с металлической связью. А, как известно, атомы металла легко расстаются своими электронами на внешнем уровне. Поэтому такой тип решетки определяет пластичность и ковкость веществ.
4) Металлическая. В узлах расположены атомы и катионы металла. Это металлы и их сплавы, соединения с металлической связью. А, как известно, атомы металла легко расстаются своими электронами на внешнем уровне. Поэтому такой тип решетки определяет пластичность и ковкость веществ.

Дата добавления: 2018-09-20; просмотров: 679; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
