Лечебное действие неорганических соединений молибдена
Проводятся исследования эффективности применения молибдата аммония для лечения новообразований головного мозга и мужского бесплодия.
Применение неорганических соединений хрома и молибдена
В медицине и фармации
В медицине в лечебных целях соединения хрома из-за высокой токсичности в настоящее время не используются. Для диагностики заболеваний крови и желудочно-кишечного тракта применяется pаствор Na2CrO4 меченый изотоп 51Сr для инъекций (Solutio Natrii chromatis chromo – 51 notati pro injectionibus).
Окислительные свойства хроматов и дихроматов широко используют в аналитической практике (хроматометрия). Метод основан на применении дихромата калия как сильного окислителя:
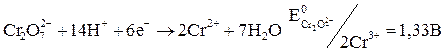
Хроматометрия используется для определения железа(II), урана(IV), меди(I), молибдена(III), некоторых органических веществ.
В санитарно-гигиенической практике применяют хроматометрию для анализа промышленных и сточных вод. В ходе анализа определяется так называемая окисляемость воды, которая характеризует общее содержание органических и неорганических восстановителей. В лабораторной практике для очистки химической посуды широко применяют хромовую смесь, состоящую из К2Сr2О7, Н20 и концентрированной Н2SО4 в соотношении 1:6:2 (по массе), которая обладает сильными окислительными свойствами.
Некоторые соединения молибдена применяются в анализе. Молибдат аммония (NH4)2MoO4∙4H2O используется как аналитический реактив на красный фосфор в присутствии концентрированной азотной кислоты, образуется осадок аммониевой соли гетерополифосформолибденовой кислоты: (NH4)3H4[P(Mo2O7)6].
|
|
|
4. Токсическое действие соединений хрома
Соединения хрома оказывают отрицательное воздействие на организм человека: общетоксическое, вызывают дерматиты и экземы при соприкосновении с кожей, аллергенное, канцерогенное. Причем соединения хрома(VI) значительно токсичнее, чем соединения хрома(III). Растворимые соединения хрома ядовиты: пары хромовой кислоты повреждают слизистые оболочки носа и дыхательных путей, хроматы и дихроматы разъедают кожу и вызывают экзему, а также повышают чувствительность к аллергенам. При приемах внутрь наблюдаются ожоги слизистой оболочки полости рта, ожоги пищевода и желудка, отечность. В литературных источниках имеются разноречивые данные о смертельной дозе хроматов 0,2-0,5-1 г и даже 8 г.
При содержании в водоемах соединения хрома(VI) могут вызвать поражение внутренних органов при потреблении с питьевой водой, а при купании – воспалительные изменения слизистых глаз, дерматиты и экземы, а также оказать канцерогенное действие. Предельно допустимая концентрация хрома в питьевой воде 0,05 мг/л. В аналитической практике используют способность ионов тяжелых металлов образовывать труднорастворимые хроматы:
|
|
|

кирпично-красный
Ag2CrO4 растворяется в растворе аммиака и азотной кислоте.
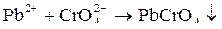
желтый
Реакцию проводят в уксуснокислой среде, в которой PbCrO4 нерастворим. В щелочной среде PbCrO4 растворяется с образованием плюмбитов:
PbCrO4 + 4OH- → PbO22- + CrO42- + 2H2O
Ba2+ + CrO42- → BaCrO4↓
желтый кристаллический
BaCrO4 растворяется в сильных кислотах. В присутствии Н2SO4 желтый BaCrO4 переходит в белый BaSO4.
2Ba2+ + Cr2O72- + H2O → 2BaCrO4↓ + 2H+
желтый
Дата добавления: 2018-09-20; просмотров: 315; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
