RESULTS OF THE EXPERIMENTS AND THEIR DISCUSSION
3. 3. 1 Hydrogenation of acetonitrile with various "H-5" -Ni-Nbsk (5% Nb) catalyst weighed under the hydrogen pressure in the liquid phase
Catalytic hydrogenation of acetonitrile to the primary - CH3CH2NH2, secondary - (CH3CH2) 2NH and tertiary - (CH3CH2) 3N amines is a model reaction reflecting the characteristic features of hydrogenation of the nitrile group, but belonging to the class of insufficiently studied compounds [50-52].
СН3–СºN + Н2®СН3–СH=NH + Н2®СН3–СН2–NH2 (1)
acetonitrile aldimine ethylamine
Promoted catalysts based on Ni-Raney (Ni50-x-Mex-50% Al) have been studied to intensify the catalytic synthesis of ethylamine. They are: N-5-Ni-Nbsk (5% Nb) catalysts.
[1, 2, 16, 17, 32], when studying the hydrogenation of decyloxypropionitrile and terephthalonitrile in the presence of promoted Ni-Raney-based catalysts under hydrogen pressure in the liquid phase, catalysts with Nb [ 1, 16, 17], so we found it expedient to use a Ni-Nbsk (5% Nb) catalyst in the hydrogenation of acetonitrile.
The rate of hydrogenation of nitriles and the direction of the reaction depend not only on the nature of the catalyst, the solvent, the process conditions, but also on the amount of ammonia introduced into the reaction medium [1-7, 14-20, 30, 32, 44]. On Ni-Ti (3 % Ti), Ni-Nb (2-5% Nb) catalysts, the maximum yield (98%) of γ-decyloxypropylamine and p-xylylenediamine corresponds to a weight ratio of nitrile: ammonia of 1: 3 [1, 15-17].
It is of great practical interest to find the optimal catalyst: nitrile (acetonitrile) ratio and change the amine yield from the amount of catalyst.
The change in the amount of catalyst during hydrogenation in the liquid phase naturally leads to a change in the ratio of the reacting substances on the surface, which sometimes leads to a change in the selectivity of the process.
The results of hydrogenation of acetonitrile in various portions of the H-5 catalyst are shown in Table 1.
The weight of the catalyst varies from 0.05 to 0.5 g. When the catalyst charge is increased by 10 times, the reaction rate increases accordingly from 32 to 127 cm3H2 / min (Table 1), the character of the kinetic curves is preserved.
Table 1 - Hydrogenation of acetonitrile with various portions of H-5 catalyst in ethanol (A4H2 = 1000 cm3 H2, nitrile: ammonia = 1: 3, g / g, 4.0 MPa, 313 K)
| Catalyst weighing, g | Initial hydrogenation rate, W cm3H2 / min | Yield of ethylamine, % |
| 0,05 | 37 | 92-94 |
| 0,1 | 68 | 97-98 |
| 0,3 | 99 | 98 |
| 0,5 | 132 | 96-98 |
|
|
|
It can be seen from Table 2 that at a ratio of nitrile: ammonia 1: 3, the rate of hydrogenation of benzonitrile at 293 K is 33 cm3H2/min, and a 4-fold increase in temperature to 353 K (from 20 to 80 ° C), respectively, the reaction rate increases to 128 cm3H2/min. At high temperatures, along with the growth rate of the hydrogenation reaction of acetonitrile to ethylamine, secondary and tertiary amines are formed [14-20].
1 - 293 K; 2 - 313 K; 3 - 333 K
Figure 4 - Hydrogenation of acetonitrile on an H-5 catalyst at different temperatures in ethanol (qcat = 0.1 g, A2H2 = 1000 cm3 H2, nitrile: ammonia = 1: 3, g / g).
Study of the effect of hydrogen pressure on the hydrogenation of acetonitrile
The hydrogen pressure plays an important role in the hydrogenation of nitriles [2, 5-9, 14, 30, 53, 56].
The study of the hydrogenation of a number of unsaturated organic compounds under hydrogen pressure showed that the reaction rate is most often directly proportional to pressure, in some cases it increases rapidly, in others it slows [1-5, 17, 53].
The ratio of adsorbed molecules of hydrogenated matter and hydrogen should largely determine the effect of hydrogen pressure, temperature and other factors on the reaction rate [5, 17, 24]. The pressure primarily affects the concentration of hydrogen on the surface of the catalyst.
Some papers [5, 24, 32] show that with increasing hydrogen pressure in the system, the hydrogenation rate increases proportionally to a certain limit, the latter depending on the nature of the catalyst and the hydrogenated compound and on the experimental condition.
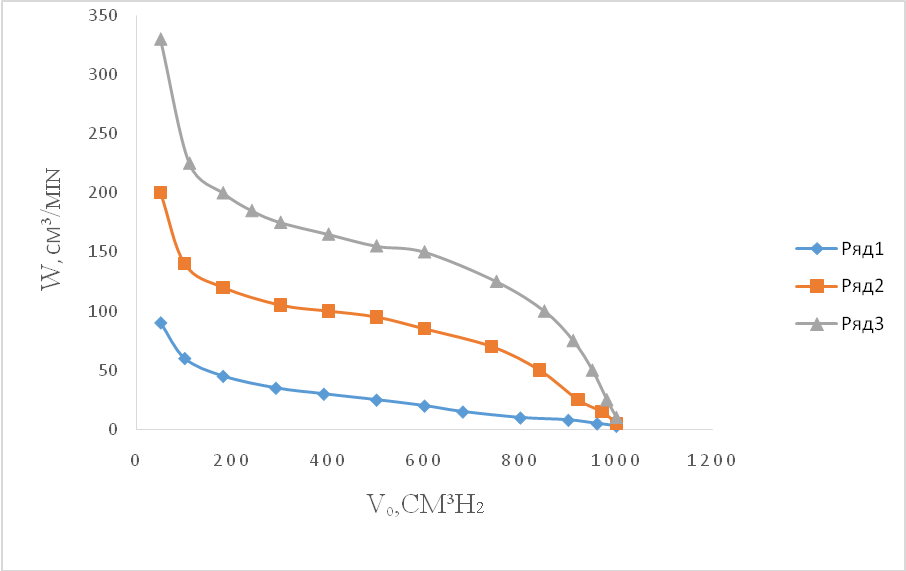
Hydrogenation of acetonitrile in alcohol on H-5 catalyst changed the hydrogen pressure in the range 0.5-7.0 MPa at a temperature of 313 K (Fig. 4). As the hydrogen pressure rises, the reaction rate increases monotonically to 6.0 MPa. At a pressure above 6.0 MPa, the velocity ceases to depend on the pressure, i.e. in this case, the increase in the reaction rate with increasing hydrogen pressure is observed up to a certain value of it, above which it does not change. In the case of acetonitrile, this value corresponds to 6.0 MPa.
|
|
|
The logarithmic dependence of the reaction rate on the hydrogen pressure, constructed on the basis of the kinetic curves of the measurements, is expressed by a broken line characterizing the change in the order of the reaction along hydrogen (Fig. 5). The order of the reaction was determined from the slope of the slope. In the pressure range 0.5-6.0 MPa, the reaction order for hydrogen is ~ 0.5. the reaction is due to atomically adsorbed hydrogen. At a pressure above 6.0 MPa, it goes to zero.
The results of hydrogenation of acetonitrile in the presence of an H-5 catalyst at various pressures in alcohol in the presence of ammonia are presented in Table 3 and Figure 4. Comparative results of hydrogenation of acetonitrile show (Table 3 and Figure 4) that in ammonia alcohol with an increase in hydrogen pressure from 0.5 to 6, 0 MPa yield of ethylamine rises from 84 to 98%, further increase to 6.0 MPa slightly affects the yield of benzylamine and the speed of the process.
It has been established that hydrogenation of acetonitrile with Ni-Nbsk catalyst proceeds with a gradually decreasing velocity, the calculated amount of hydrogen is absorbed. The decrease in speed during the experiment is due to the adsorption of reaction products on the catalyst surface.

Kinetic curves: 1 - 0.5; 2 -1.0; 3 -2.0; 4 -4.0; 5 -6.0; 6 -7.0 MPa
Figure 4 - Hydrogenation of acetonitrile on H-5 catalyst (0.1 g)
at various pressures in ethanol (nitrile: ammonia = 1: 3, g / g, 313K)
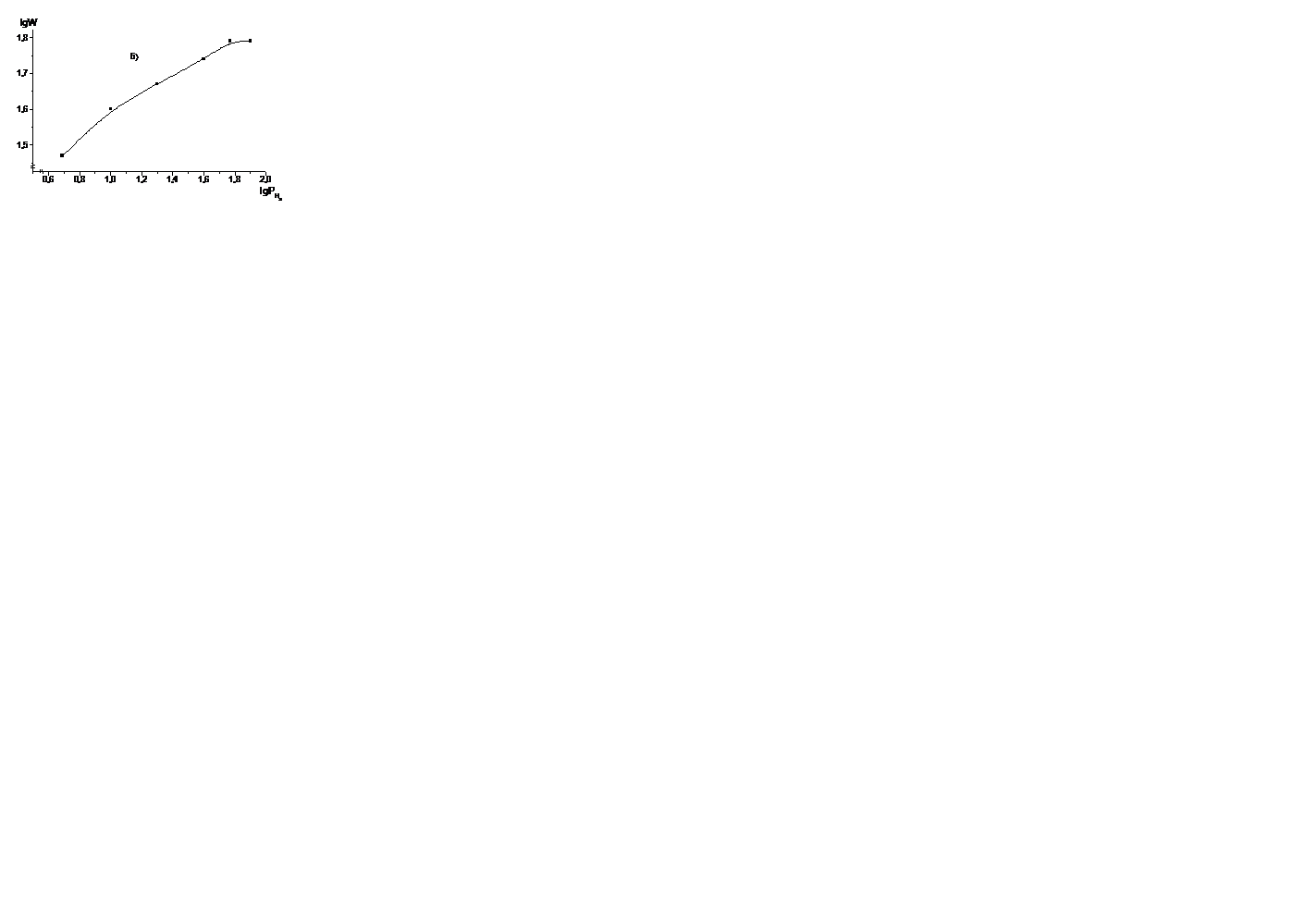
Figure 5-Dependency 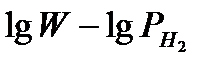
Table 3 - Hydrogenation of acetonitrile on H-5 catalyst at different pressures in ethanol (nitrile: ammonia = 1: 3, g / g, 313K)
| Рн2, MPa | Initial rate, cm3 / min | Yield of benzylamine,% | Duration of the process, min |
| 0,5 | 42 | 85–88 | 28 |
| 1,0 | 50 | 92–94 | 23 |
| 2,0 | 58 | 95–96 | 18 |
| 4,0 | 68 | 97–98 | 11 |
| 6,0 | 83 | 98 | 8 |
| 7,0 | 84 | 97–98 | 8 |
|
|
|
With an increase in hydrogen pressure from 0.5 to 6.0 MPa, the initial hydrogenation rate of acetonitrile increases monotonically from 42 to 84 cm3H2 / min, respectively (Table 4 and Figure 5). As the hydrogen pressure rises above 6.0 MPa, the reaction rate remains practically unchanged. As you can see from Table. 3 and Fig. 4 that the rate of the hydrogenation reaction of acetonitrile increases to 6.0 MPa of hydrogen, characterized as the limiting, above which the reaction rate does not change.
It follows from the literature [1-7, 14-20, 30, 32, 44, 56, 58] and the reaction scheme depicted below that the first intermediate compound formed on the surface of the catalyst during the hydrogenation of nitriles is aldimine:

To direct the reaction towards the formation of primary mono- and diamines, it is necessary to increase the hydrogen concentration on the surface of the catalyst, for example, using an increased hydrogen pressure and to strengthen the adsorption bond of hydrogen to the surface by promoting wirelet nickel or by selecting a solvent, in particular, by introducing it into ammonia [1- 7, 14-20, 26, 30, 32, 35, 43].
Reactive-active aldimine reacts with ammonia to form an unstable compound that readily converts to the primary amine, reacting with hydrogen and cleaving ammonia [1-7, 14-20]:

Ammonia prevents aldimine from reacting with the primary amine, in the interaction of which a Schiff base is formed and, upon further interaction with hydrogen, passes into the secondary amine.
If during the adsorption on the surface of the catalysts, the nitrile is coordinated with the π-bond catalyst, then upon the addition of hydrogen one or two nitrile-metal bonds are broken. After the addition of two hydrogen atoms, the intermediate for the hydrogenation of the nitrile is the reactive aldimine R-CH = NH [50-52, 59, 60].
Conclusion
-The kinetics of hydrogenation of the "H-5" -Ni-Nbsk (5% Nb) catalyst at various pressures and temperatures in alcohol in the presence of ammonia was studied. Hydrogenation of acetonitrile proceeds with a gradually decreasing in time rate.
|
|
|
- The kinetic regularities of hydrogenation of acetonitrile to ethylamine in the liquid phase are determined by varying the experimental condition (T,, catalyst: nitrile ratio).
- The influence of hydrogen pressure and temperature on the process of hydrogenation of acetonitrile in the presence of "H-5" -Ni-Nbsk (5% Nb) catalyst was studied. It is established that the reaction rate increases with increasing pressure and temperature.
- It is established that in ethanol in the presence of ammonia with increasing hydrogen pressure from 0.5 to 6.0 MPa, the reaction rate increases monotonically to 6.0 MPa.
- It is shown that in ethanol with a ratio of nitrile: ammonia = 1: 3 (g / g), at a hydrogen pressure of 4,0-6,0 MPa and a temperature of 313-333 K, the yield of ethylamine is on the "H-5" -Ni- Nbsk (5% Nb) catalyst 97-98%.
(cm3H2/min)
LIST OF USED LITERATURE
1. Abildin TS, Zhubanov KA, Bizhan NB Synthesis of polymers from products of aromatic oil compounds // Oil and gas.-2004.-No. 1.-P.53-58..
2. Абильдин Т.С., Кусепов А.К., ЖубановК.А. О некоторых
закономерностях реакции гидрирования нитрилов под давлением водорода//Изв. МОН РК, НАН РК. Сер.хим.-2002.- №2.-С. 43-63.
3.Зильберман Е.Н. Реакции нитрилов. – М.:Химия, 1972. - 345 с.
4.Фрейдлин Л.Х., Сладкова Т.А. Каталитическое восстановление динитрилов // Успехи химии. - 1964. - Т. 33,№ 6. - С. 664-686.
5. Кусепов А.К. Гидрогенизация алифатических нитрилов под давлением водорода: дис. … канд. хим. наук : 02.00.15. – Алма-Ата: ИОКЭ, 1983. - 114 с.
6. Бижанов Ф.Б. Гидрирование фталонитрилов на скелетном кобальтовом катализаторе: дис. … канд. хим. наук: 02.035. – Алма-Ата: ИХН, 1962. - 155 с.
7.Щеглов Н.И., Сокольский Д.В., Андреева А.А., Куйдина В.П., Ельчищев П.Н. Получение диаминов и полиаминов каталитическим восстановлением циан-групп // Катализаторы жидкофазной гидрогенизации: сб. науч. тр. / Ин-т хим. наук АН КазССР. − Алма-Ата: Наука, 1966. - Т.14. -С. 167-191.
8. Фрейдлин Л.Х., Баландин А.А., Сладкова Т.А. Получение n-ксилилендиамина каталитическим восстановлением динитрила терефталевой кислоты // Докл. АН СССР. - 1957.-Т. 112,№ 5. -С.880-881.
9.Пат. (Англия) №814631.The Production of CyanoBenzylamines/Denis CheseldenОuin-Complete Specification Published 1959.
10. Фрейндлин Л.Х., Сладков Т.А., Энглина Ф.Э. Альдиминный механизм гидрирования динитрила адипиновой кислоты и влияние природы носителей никелевых катализаторов на направление процесса// Кинетика и катализ.-1960.- Т.3,вып.3.- С. 417-420.
11. Фрейдлин Л.Х., Сладкова Т. А. О механизме образования вторичных и третичных аминов в процессе каталитического гидрирования адипонитрила в гексаметилендиамин//Изв. АН СССР.ОХН.-1962.-Вып.2.-С.336-341.
12. Фрейдлин Л.Х., Сладков Т.А. К механизму образования вторичных аминов при каталитическом гидрировании адипонитрила// В кн.: Синтез и свойства мономеров. − М.:Наука, 1964.-С.229-232.
13.Фрейндлин Л.Х., Сладков Т.А. Исследование зависимости направления процесса каталитического восстановления динитрилов от их структуры//Докл. АН СССР.:Химия.-1962.-Т.143,№3.-С.625-632.
14.Фрейдлин Л.Х., Баландин А.А., Руднева К.Г., Сладкова Т.А. Получение гексаметилендиамина гидрированием динитрила адипиновой кислоты на никелевом катализаторе в проточных условиях// Изв. АН СССР, ОХН.-1957.-№2.-С.166-174.
15. Абильдин Т.С., Жубанов К.А., Бижан Н.Б. Механизм гидрирования β-децилоксипропионитрила // Журн. физичес. химии.- 2004.- Т. 78,№ 10.- С. 1758-1763.
16. Абильдин Т.С. Каталитическое восстановление динитрила терефталевой кислоты // Промышленность Казахстана. - 2006. - №3(36). - С. 68-70.
17. Әбілдин Т.С. Алифаттыжәнеароматтыаминдердісутекқысымындакатализдіксинтездеу: химияғылымдарыныңдокт. … дис.: 02.00.15 -Алматы: ҚазҰУ, 2010. - 239 б.
18. Schwoegler E.J., Adkins H. Preparation of Certain Amines// J. Amer. Chem. Soc. - 1939.- Vol.61, №12. - P. 3499-3502.
19.Бижанова Н.Б., Кусепов А.К., Жубанов К.А., Сокольский Д.В. Сообщение I. Гидрирование ацетонитрила на никелевых катализаторах// Изв. АН КазССР. Сер. хим.- 1980.- №6.-С. 17-20;там же Сообщение II. Гидрирование акрилонитрила на никелевых катализаторах. -С. 20-23.
20. Зеленая Ш.А. Исследование метода получения алифатических аминов и разработка технологии их производства: автореф. …канд. хим. наук: 02.085.− Харьков: ХПИ, 1971. - 21 с.
21. Кагарлицкая Н.В. Каталитические превращения нитрилов пиридин-карбоновых кислот на некоторых металлах восьмой группы: автореф. … канд. хим. наук: 02.00.15. –Алма-Ата: ИОКЭ, 1975. -31 с.
22. Бижанов Ф.Б., Сокольский Д.В., Хисаметдинов A.M. и др. Исследование фазового состава и структуры сплавов никель-алюминиевых катализаторов с добавками титана и циркония//Каталитические реакции в жидкой фазе: сб. науч. тр./Ин-т хим. наук АН КазССР. − Алма-Ата:Наука, 1968.-Т.22.-С.127-137.
23.Мехтиев С.Д. Нитрилы. − Баку: АзерНЕШ0, 1966. - 466 с.
24.Бижанов Ф.Б. Влияние давления водорода на кинетику и механизм гидрогенизации органических соединений в жидкой фазе // Гидрирование и окисление на гетерогенных катализаторах: сб. науч. тр. / Ин-т орг. кат. и эл. химии АН КазССР. − Алма-Ата: Наука, I978. –Т.19.-C. 115-144.
25. Сокольский Д.В., Попов О.С. Гидрирование под постоянным давлением на платине, палладии и иридии //Докл. АН СССР . -1958. -Т.93. -С. 831-834.
26. Сокольский Д.В. Гидрирование в растворах. −Алма-Ата:Наука, 1979. - 360 с.
27. Волкова Л.Д. Гидрирование непредельных алифатических нитрилов с сопряженными связями в смешанных растворителях: автореф.…канд. хим. наук: 02.00.15. – Алма-Ата: КазГУ, 1967. - 18 с.
28.Волкова Л. Д., Кагарлицкая Н.В., Закумбаева Г.Д. К механизму гидрирования нитрильной группы. Гидрирование бензонитрила на никелевом, платиновом и палладиевом катализаторах // Изв. АН КазССР. Сер. хим. - 1973. - №4. - С. 70-72.
29. Бижанов Ф.Б, Сокольский Д.В., Влияние количества катализатора на процесс гидрирования изофталонитрила// Изв. АН КазССР. Сер. хим. -1966, №2.-С. 54-57.
30.Клюев М.В., Савватеев О.П., Ерыкалов Ю.Г. Катализаторы гидрогенизации нитрилов // Вопросы кинетики и катализа: межвуз. сб. науч. тр./ Хим. техн. ин-т.- Иваново, 1983. - С. 67-72.
31. Хисаметдинов A.M. Изучение фазового состава и структуры сплавных Ni-катализаторов и их влияния на каталитическую активность.: дис. ...канд. хим. наук: 02.073.−Алма-Ата; ИХН, 1970.- 220 с. (ДСП).
32. Абильдин Т.С. Каталитический синтез некоторых алифатических аминов: дис. … канд. хим. наук: 02.00.03; 02.00.15 − Алма-Ата: КазГУ, 1990.-165 с.
33. Зильберман Е. Н., Скорикова З. Д., Гетерогенный катализ в химической промышленности. – М.:Госхимздат, 1955. -471 с.
34. Бижанов Ф.Б. Исследование процесса гидрирования на никелевых катализаторах под давлением.: автореф. … докт. хим. наук:02.00.15 −Алма-Ата: ИОКЭ, 1977. - 51с.
35. Швец И.С. Исследование промотированных скелетных никелевых катализаторов в реакциях гидрирования: автореф. дисс. …канд. хим. наук:02.00.15− Алма-Ата:ИОКЭ, 1973.-27 с.
36. Сокольский Д.В., Бижанов Ф.Б., Гидрирование нитрилов. Сообщение 2. Гидрирование динитрила изофталевой кислоты на кобальтовом катализаторе // Кинетика и катализ. сб. науч. тр. Ин-т хим. наукАН КазССР. Алма-Ата, 1961.-Т.7.-с.68-74
37. Чеголя А.С. Исследование в области гидрирования органических соединений на рутения.: автореф. … докт. хим. наук:02.00.03 − М:МГУ, 1968. - 43 с.
38. Волкова Л. Д., Габдракипов В. З., Кагарлицкая Н. В. Связь реакционной способности моноцианпиридинов с их электронным строением при гидрировании на никеле, платине и паладии. – В кн.: Каталитическое гидрирование и окисление. Алма-Ата: Наука, 1974, с. 132-136.
39. Волкова Л. Д.,Кагарлицкая Н. В., Закумбаева Г. Д., Сокольский Д. З. Каталитическое присоединение водорода к изомерныммоноцианпиридинам на Pd-черни. – Кинетика и катализ, 1974, т. 15, №I, с. 239-241
40. Кагарлицкая Н. В.,Волкова Л. Д.,Закумбаева Г. Д. О поведении моноцианпиридинов при гидрогенизации на платиновом и палладиевом катализаторах в кислых растворах. – Изв. АН КазССР, сер.хим., 1975, № 2, с. 19-23.
41. Кагарлицкая Н. В.,Волкова Л. Д.,Закумбаева Г. Д. Родий в реакии каталитической гидрогенизации моноцианпиридинов и бензонитрила. – Изв. АН КазССР, сер.хим., 1976, № 4, с. 14-18.
42. А. с. 427008 (СССР). Способ получения пиридинметиламинов. /Д.В. Сокольский, Г. Д. Закумбаева, Л. Д. Волкова, Н. В. Кагарлицкая. – Опубл. в Б. И., 1974, № 17.
43. Пушкарева Г.А., Фасман А.Б. Активность и селективность многокомпонентных никелевых катализаторов Ренея.// Каталитические и адсорбционные свойства металлов VIII группы: сб. науч. тр./ ин-т органического катализа и электрохимии-Алма-Ата: Наука, 1980.-Т.20.-С.34-43.
44. Жубанов К.А., Абильдин Т.С, Бижанова Н.Б., Жубанов Б.А., Кравцова В.Д. n-Ксилилендиамин и новые полиимиды на его основе // Журн. приклад.химии. - 2003. – Т.76. - Вып. 8. - С. 1341-1345.
45. Гостикин В.П., Нищенкова Л.Г., Голубкова Г.В., Козлова Л.В. Активность скелетных катализаторов из Ni-Al-Тi-сплавов, полученных пирометаллургическим и механохимическим сплавлением, в процессах гидрирования.// Кинетика и катализ.-1995.-Т.36.-№1.-С.117-120.
46. Налибаев Т.Н. Структура и физико-химические свойства поверхности скелетных катализаторов никеля Ренея: дисс. …д-ра хим. наук. – Алматы, 2004.-50 с.
47.Сокольский Д. В., Закумбаева Г. Д., Попова Н. М., Сокольская А. М., Жубанов К. А. Катализаторы гидрогенизации. – Алма-Ата: Наука, 1975. – 305 с.
48. Сокольский Д. В., Электрохимические методы исследования механизма каталитической гидрогенизации в растворах. – Вестник АН КазССР, 1965, № 6, с. 3-21.
49. Сокольский Д. В. Основные проблемы катализа на примере каталитической гидрогенизации. – Кинетика и катализ, 1977, т. 18, № 5, с. 1223-1225.
50. Павленко Н.В., Трипольский A.M. .Голодец Г.И. Реакционная способность алифатических нитрилов в реакции гидрирования на никелевом катализаторе //Кинетика и катализ. - 1988. - Т.29,Вып.3. - С. 746-748.
51.Голодец Г.И., Павленко Н.В., Прохоренко Е.В. Влияние химического состава нанесенных металлических катализаторов на их активность и селективность в реакции гидрирования ацетонитрила //Кинетика и катализ.-1987.-Т.28,Вып.3.-С.625-632.
52. Павленко Н.В., Трипольский A.M., Прохоренко. Е.В. .Голодец Г.И. Механизм и кинетика селективного гидрирования ацетонитрила на некоторых переходных металлах //Кинетика и катализ. -1987. - Т.28, Вып.6. - С. 1382-1388.
53Cуднeкo В. В. Кaтaлитичecкoe гидрирoвaниe нeкoтoрых aлифaтичecких нитрилoв: диcc. …кaнд. хим. Нaук/ В. В. Cуднeкo– 02.00.15. − Aлмa-Aтa: ИOКЭ, 1985. – 22 c.
54 Әбілдин Т. С.Бензонитрилді спиртте Ni-Nb катализаторында сутек қысымында гидрогендеу / Т. С. Әбілдин/ҚазҰУХабаршысы. Химиясериясы. – 2011. – №1 (61). – 476–479 бб.
55 PlieningerH. Патент Германии/H. Plieninger– № 957029, от 31.01.57.
56 Абильдин Т.С., Василина Г.К. Елубай М.А., Сулейменов М.А. Мухитов К. Кажибаева М. Жаркенова Д.Гидрирование ароматических моно-, динитрилов на прмотированных никелевых катализаторах под давлением водорода // Изв. НАН РК. – Серия химии и технологии. – Алматы. – 2017. – С.29-36.
57 Бобков С. С., Смирнов С. К. Синильная кислота. – М.:Химия, 1970, - С. 141.; Справочник нефтсхимика. – Л.:Химия, 1978. - Т. 2. - С. 293-294.
58Абильдин Т.С. Жидкофазное гидрирование смесей изофтало-, терефталонитрилов на промотированных катализаторах / Т. С. Абильдин, К. А Жубанов, Е. А. Аубакиров, Г. К. Василина, К. E. Бурханбеков // Изв. НАН РК. Серия химии и технологии – 2016. – № 3 (417). – С. 27-33.
59Дорфман Я.A. Катализаторы и механизмы гидрирования и окисления. − Алма-Ата: Наука, 1984. - 352 с.
60Помбейро А. Новые в химической фиксации азота. − М.:Мир, 1983.-С.266.
Дата добавления: 2018-06-27; просмотров: 341; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
