Кескінді электронды микроскоп JSM-6490l V (Jeol, Япония)
Тұжырым Диплом алды іс-тәжірибені "Фотохимиялық алтындауда алмаз бөлшектерін енгізу технологиясын жасау" тақырыбында ХТ-14-1к2 тобының студенті М. Икият, аға оқытушы Сатаев М.С жетекшілігімен орындады. Диплом алды іс-тәжірибе 2018 жылы қорғалды. Диплом алды іс-тәжірибе келесі бөлімдерден тұрады; кіріспе, аналитикалық бөлім, тәжірибелік бөлім, еңбекті және қоршаған ортаны қорғау. Кіріспе тарауында фотохимиялық алтындау және алмаз бөлшектері туралы жалпы мәлімет көрсетілген. Аналитикалық бөлімде фотохимиялық алтындауда алмаз бөлшектерін енгізу технологиясы көрсетілген. Тәжірибелік бөлімде бастапқы шикізатымызбен өнімге жалпылама сипаттама берілген. Диплом алды іс-тәжірибеде жалпы тұжырымдар қорытындыға келтірілді. Диплом алды іс-тәжірибе түсіндірме жазбасы 49 беттен, 2 кестеден, 8 суреттен тұрады. Мазмұны Тұжырым............................................................................................................. 3 Мазмұны.............................................................................................................. 4 Нормативтік сілтемелер.................................................................................... 5 Анықтамалар........................................................................................................ 6 Белгілеулер мен сілтемелер............................................................................... 7 Кіріспе.................................................................................................................. 8 1 Әдебиеттік шолу. Патенттік ізденістер......................................................... 10 1.1Диэлектрлі беттерді металдандырудың заманауи жағдайы..................... 10 1.2 Диэлектрлібеттердеметаллқабықшасыналужолдары........................... 14 1.3 Химиялық және фотохимиялық ыдырату арқылы металдандыру........... 21 2 Тәжірибелік бөлім............................................................................................ 24 2.1 Шикізат және өнім сипаттамасы................................................................. 24 2.2 Диэлектрик беттердің фотохимиялық әсерлесуінің механизмі................ 27 2.3 Фотохимиялық әдіс үрдісінде жүретін реакциялар механизмі................ 29 2.4 Алтын қаптамасын фотохимиялық әдіспен құрамына алмаз бөлшектерін енгізу арқылы әртүрлі беттерге қондыру және зерттеу 30 2.5 Алынған нәтижелерді талдау..................................................................... 32 3 Тіршілік қауіпсіздігі және қоршаған ортаны қорғау.................................. 36 Қорытынды......................................................................................................... 48 Пайдаланылған әдебиеттер тізімі...................................................................... 47
|
|
|
Кіріспе
1.1 Диплом алды іс-тәжірибе жүргізілген зертхана
|
|
|
Жаңа болашағы бар ғылым бағыттарының, оның ішінде нанотехнология, биотехнологияның пайда болуына әсер еткен барлық маңызды әлемдік ғылыми ашулар мен табыстар көбіне зерттеу құралдарының жаңа заманауи үлгісі мен оның жіті және терең анализдер, сынақтар жасауымен байланысты. Көптеген отандық ҒЗИ мен жоғарғы оқу орындарындағы ғылыми зертханалар осы уақытқа дейін өткен ғасырдың 60-70 жылдарында шыққан приборлармен жұмыс істеп келді. Ал қазіргі заманауи құралдар өздерінің техникалық мүмкіндіктерімен, жұмыс жасай алу дәрежесімен, бағдарламалық қаматамасыз етілуімен алысқа ұзап кеткен болатын.
Елбасы – Ұлт қолбасшысы Н. Ә. Назарбаевтың бастауымен 2007 жылы заманауи аналитикалық құралдармен жабдықталған ашық типтегі ұлттық және инженерлік зертханалар құру шешімі қабылданды.
Мұндай зертханалардың бірі – М. Әуезов атындағы ОҚМУ-да ашылған «Конструкциялық және биохимиялық материалдар» Инженерлік бейіндегі аймақтық сынақ зертханасы. (Қазақстан Республикасының Білім және Ғылым Министрлігінің 15.03.2007 ж № 120 бұйрығымен).
|
|
|
Инженерлік бейіндегі зертхананың қызметі ғалымдар мен білім алушылар үшін заманауи құралдарда жіті және терең зерттеулер жасауға мүмкіндік туғызуды көздейді. Мұндай мүмкіндіктер тек университеттің ғалымдары мен мамандарына ғана емес, сол аймақтағы барлық меншік түріне қарамастан, кез келген ұйымдар мен жоғарғы оқу орындарының қызметкерлеріне қолжетімді болды.
Зертханада физика-химиялық анализ әдістерінің кешені дұрыс жолға қойылған:
- Жоғары нәтижелі сұйықтық хроматографиясы
- УФ-спектрофотометриясы;
- электронды микроскопия және энергодисперсионды анализ;
- масс-спектрометрия;
- газ хромато-масс-спектрометриясы;
- атом-абсорбционды спектрометриясы;
- флюориметрия;
- ИК-Фурье спектрометриясы.
Университетте болған физика-химиялық зерттеу әдістерінің зертханасымен қосыла келе Инженерлік бейіндегі зертхана материалтану, химиялық технология, биохимия және биотехнология, тамақ және фармахимия, мұнай химиясы және т.б. саласында жұмыс атқаруға мүмкіндік беретін заманауи зертханалық кешен құрды.
|
|
|
Зертханада келесі приборолар бар.
1.JEOL (Жапония) фирмасының кескінді электронды микроскопы JSM 6490LV INCA Energy-350 (OXFORD Instruments, Ұлыбритания) энергия дисперсиялы микроанализ жүйесі және HKL Basis (OXFORD Instruments, Ұлыбритания) поликристалды объектілердің құрылымдық анализ жүйесімен жұмыс жасай алу мүмкіндігімен. Мұндай кешен нанодәрежеде органикалық және бейорганикалық заттардың өте жұқа құрылымын зерттеуге мүмкіндік береді. Үлкейтілуі бес еседен бастап 300 000 есеге және 3 нанометрге (3·10-9м) дейін рұқсат етілуімен ерекшеленеді. Бұл - осы класстағы жүйелер үшін ең үлкен рұқсат етілу мүмкіндігі. Бір уақытта бордан уранға дейінгі химиялық элементтердің құрамын анализ жасай береді. Төменгі вакуумдық режимде биологиялық және полимерлік материалдарды, сонымен қатар құрамында мұнайы бар жыныстарды да зерттеу мүмкіндігіне ие.
2. Varian фирмасының (Австралия-АҚШ) Varian-820 MS Индуктивті-байланысқан плазмалық масс-спектрометрі. Бұл прибор 75 элемент бойынша заттардың элементті және изотопты құрамын бір минут ішінде ондаған пайыздардан 10-9 –не дейінгі сезгіштікпен анықтауға мүмкіндік береді.
3.Су, тамақ өнімдері, мұнай өнімдерінің, табиғи минералдардың, фармацевтикалық препараттардың және т.б. өнімдердің физика-химиялық анализдерін жасайтын тиімділігі жоғары Varian фирмасының (Австралия-АҚШ) жоғары сұйықтық хроматографы Varian-Pro.
4.Екісәулелі сканерлеуші УФ-спектрофотометр Varian «Cary-50» (Австралия-АҚШ). Тамақ өнімдері, су, сусын, фармпрепараттың анализін жасауға арналған прибор.
Сонымен зертхананың ары қарай дамуы және ғылыми бағыттарды кеңейту мақсатымен, тапсырыс берушілердің сұранысымен, аймақты дамыту басымдылығымен университеттің күшімен 2012 жылы хромат-масс-спектрометрі, сұйықтық спектрометрі, ИК-Фурье спектрофотометрі (Shimadzu, Жапония) алынды.
1. Газды хромато-масс-спектрометр GCMS-QP 2010Ultra (Shimadzu, Жапония), газды хроматограф пен масс-спектрометрдің комбинациясын береді. Тамақ, фармацевтикалық, ауылшаруашылық, және өнімдердің басқа да түрінің құрамына кіретін заттар мен байланыстарды, дәрілік, психотропты және есірткі заттарды, биологиялық жүйелерді анықтауға және табуға, экологиялық жағдайды бақылауға арналған.
2. IR Prestige-21 ИК-Фурье спектрометрі (Shimadzu, Жапония). Органикалық, элемент-органикалық, ерітінді немесе қатты фазадағы физикалық және бейорганикалық химиялық объектілердің құрылымын, оған қоса электронды құрылысын, ішкі және молекула аралық өзара әрекеттесудің ерекшеліктерін анықтауға арналған. Сонымен қатар жұтылу, өткізу, НПВО спектрлерін алу.
3. LC-20 Prominence сұйықтық хроматографы (Shimadzu, Жапония). Дәрілік препараттарды, жемді, витаминдерді, полимерлерді, тамақ өнімдері мен фармацевтикалық өнімдерді анализ жасауға және қоршаған орта объектілерін зерттеуге арналған.
4. «Наноэдюкатор 2» (НТ-МДТ, Ресей) – ғылыми-ағарту зерттеу кешені. Нанотехнологиялардың негіздерін зерттеуге арналған. Қолдану аймағы: материалтану (металдар, жартылай өткізгіштер, диэлектриктер, композициялық материалдар, полимерлер), биология (жасушалар, вирустер, бактериялар), сақтау орталары және сақтау құралдарын жинақтаушы, микро- және наноқұрылымдар (дифракционды жақтаулар, өзін ұйымдастыру жүйелері).
Сонымен қатар зертхананың алдына қойылған мақсаттар мен жүктемелердіатқару үшін зертхананың мүмкіндіктерін толық және тиімді пайдалануға септігін тигізетін приборлар мен құрылғылар орнатылды.
| 1 | Дозиметр-радиометр МКС-АТ 1117М, барометр-анероид М67 | 2009 |
| 2 | Ультрадыбыстық ванна | 2009 |
| 3 | рН-метр, колба қыздырғыштар, электр пештер | 2010 |
| 4 | Планетарлы диірмен Retch (1 дн.) | 2011 |
| 5 | Кептіргіш шкафтар (2 дн.) | 2011 |
| 6 | Муфель пештері (2 дн.) | 2011 |
| 7 | Аналитикалық таразылар (2 дн.) | 2011 |
Зертхана Қазақстан Республикасының аккредитация жүйесінде «Сынақ және калибрлік зертханалардың жұмыстарына жалпы талаптар» СТ ҚР ИСО/МЭК 17025-2007 талаптарына сәйкес аккредиттелген (аккредитация аттестаты № КZ.И.16.1048 2010 ж 25 қарашасынан). Аккредитация аумағы: микотосиндер мен бенз(а)пиренді анықтау бойынша тамақ өнеркәсібі мен ауылшаруашылық өнеркәсібінің өнімдерін сертификациялау сынақтары; алкогольсіз, әлсіз алкогольді сусындардағы тамақ қоспаларын; кофе идентификациясы; химиялық элементтері бойынша ас суы, табиғи, жерасты және жауын сулары.
2011 жылдан бастап инженерлік бейіндегі зертхана қоғамдық пайдаланудағы ғылыми зертхана ретінде базалық қаржыландырылатын субъект болып келетін ұйымдардың тізіміне кірді (ҚР Үкімет Қаулысы № 511 13.05.2011). Одан басқа, ҚР ғылым туралы Заңы бойынша, зертхана гранттық жобалар мен бағдарлама-нысаналық қаржыландыру субъектісі болып табылады..
Біз қызығушылық танытқын барлық ұйымдар мен ғалымдарды бірлесіп жұмыс істеуге шақырамыз.
1.2 Зертхананың бөлімшелері
«Концтрукциялық және биохимиялық материалдар» инженерлік бейінді аймақтық сынақ зертханасының жұмысын жаһандандыру үшін, ұйымның эффективтілігін жоғарлату және приоритетті ғылыми бағытта ғылыми-зерттеу жұмыстарын жүргізуге, материалды-техникалық базаны рационалды қолдану арқылы жүргізу мақсатында 2012 жылы келесідей бөлімдерді құру арқылы зертхана құрылымы үйлестірілді:
- «Заттардың және материалдардың физика-химиялық зерттеулері»
| - «Фармахимия және тағам химиясы» - «Биотехнология және биохимия» - «Материалға кіріспе және электрохимия» - «сирек кездесетін металлдардың химиясы және технологиясы» - «Су ресурстарының сапасын бақылау (мониторинг) және мембраналы технологиясы» | 
|

| 
|
1.3 Зертхананың материалды-техникалық базасы
Кескінді электронды микроскоп JSM-6490l V (Jeol, Япония)
o Жоғарғы және төменгі вакуум жағдайларында жұмыс істейді
o INCA Energy 350 энергодисперсті микроталдағыш жүйесімен және НКLBasic поликристалдар мен кристалдаудың текстурасы мен микроқұрылымын зерттейтін құрылысымен жабдықталған.
o Үлгідерді ток өткізгіш қабатымен жаппастан зерттейді.
1.3.2 Зерттеулердің басым бағыттары:
o Наноталшықтар мен нанотүтіктерді зерттеу
o Металлдар, құймалар, жартылай өткізгіштер, полимерлер, синтетикалық өнімдер және т.б. көптеген материалдардың микроқұрылымын зерттеу
o Биологиялық және полимер заттар, шыны, керамика секілді заттарды ток өткізгіш қабатымен жаппастан зерттеу
o Үлгідегі фазалар мен микроқоспаларды анықтау және энергодисперсті химиялық талдау
o Дендриттік ликвация мен сегрегацияларды және элементтердің таралуын зерделеу
o Әр алуан жаппалардың қалындығын анықтау және диффузиялық процесстерді зерделеу


Сурет Индуктивті-байланысқан плазманың массалық-спектралді анықтаушы (ИСП-МС) Varian-820MS спектрометрі
1.3.3 Жабдық сертификатталған.
Барлық заттардағы химиялық элементтер мен изотоптарды жоғары жылдамдықпен (минутына 75 элемент),
10-10 % -дан 10 %дейін жоғары дәлдікпен анықтайды.
Зерттеу объектілері:
o Металдар мен жартылай өткізгіштер
o Берилийден уранға дейінгі металдардан олардың изотоптары
o Кремний, Германий, Селен, Теллур сияқты жартылай өткізгіштерді, олардың тұздары, тотықтары, құймалары, технологиялық ерітінділері
o Қоршаған ортаның объектілері: сулар, өндірістік шайындылар, топырақтар, тұнбалар, өсімдіктер, биологиялық үлгілер, аэрозольдар
o Әр түрлі сулардың сертификаттық сынақтары
2.Әдебиеттік шолу және патенттік ізденістер
2.1 Диэлектрлі беттерді металдандырудың заманауи жағдайы
Заманауи өнеркәсіп гальванотехника саласынан металды емес материалдар, соның ішінде диэлектриктерге металл қаптамаларын төсеуді талап етуде. Мұндай материалдар қатарына соңғы кездері кең қолданысқа ие болған маталар, пластмассалар, шыны, кварц, керамика, слюда, ферриттер, графит және алмаздар,көміртекті талшықтар, белсендірілген көмірлер, жартылай өткізгіштер (Si, Ga, As, Se), сонымен қатар резеңке, ағаш, тері, гипс, балауыз, өсімдіктер жатады.
Металл емес заттарды металдандырудың басты мақсаты жаңа материалдар алу және бұйымдарға жаңа қасиеттер – функционалдылық (тоқ және жылу өткізгіштік, жарық немесе радио толқындарды сіңіру және шағылту, беріктік және тозуға төзімділік) немесе сәндік (металдың немесе конверсионды қаптамасы бар металдың түрі) беру болып табылады. Металл емес материалдарды металдандыру үрдісін бұйымдар (ерітіндіге батыру) немесе арнайы қондырғылар мен іс-әрекеттерді жүзеге асыруға қажетті тәсілдерді талап ететін ленталар, жіптер және ұнтақтар түрінде іске асырады.
Диэлектриктерді металдандыру үшін әртүрлі әдіс-тәсілдерді қолданады: соның ішінде келесілерін қарастыруға болады:
- механикалық – қаптаманы алдын-ала жұқалтыр немесе қажетті кескіндемеге ие қабат ретінде жасайды, мысалы, гальванопластикалық, және кейіннен оны диэлектриктің беткі қабатына бекітеді;
- физикалық – металды алдыменен буға (вакуумдық металдандыру) немесе сұйықтыққа (батыру немесе шашыратып металдандыру) айналдырады, содан кейін ғана қапталатын беткі қабатқа төсейді және мұнда шағын қабат түзіледі;
- химиялық – металл қапталушы беткі қабатта жүруші химиялық реакция нәтижесінде түзіледі.
Металдандырудың химиялық әдісі металдандыру реакциясы жүретін ортасына қарай (газ фазалы, ерітіндіде, қатты фазада) немесе металлогенді реакция түріне сай жіктеледі: ыдырау (термолиз, электролиз, фотолиз, радиолиз) және тотықсыздандыру (тотықсыздандырғышқа қарай бөлінеді – сутегі, гипофосфит, борогидрид, формальдегид және т.б.).
Әрбір металдандыру әдісі үшін қапталушы материалға, қондырғыға, технологиялық тәсілдерге қойылатын өзіндік талаптары бар. Осындай іс-әрекеттер нәтижесінде алынған қаптамалар мен қапталған бұйымдардың да қасиеттері әрқилы болып келеді (қалыңдығы, морфология, физикалық және химиялық қасиеттері, ұзақ мерзімділігі, жұмысқа жарамдылығы, беріктігі).
Химиялық әдіспен металдандыру кезінде әдетте металл емес заттарды күміспен, мыспен, алтынмен, никельмен, қалайымен, родиймен, кейде палладиймен, платинамен, қорғасынмен, сирек түрде алюминиймен, хроммен қаптайды. Химиялық-гальваникалық металдандыру кезінде тоқ өткізуші қабатшаға мыс, никель, хром, қалайы, мырыш, кейде алтын, күміс немесе композициондық қаптамалары бар жылтыр және күңгірт қабаттардан тұратын көп қабатты қаптамаларды төсейді.
Металл емес заттарды химиялық және химиялық-гальваникалық металдандыру үрдісі келесі негізгі кезеңдерді қамтиды:
- беткі қабатты дайындау – алдын-ала өңдеу (тазалау, майсыздандыру, өңдеу) және химиялық металдандыру жағдайында тоқ өткізуге қабатшаның түзілуі үшін активтендіру;
- химиялық металдандыру арқылы тоқ өткізуші қабатшаның түзілуі жартылай өткізгішті қабаттардың тұнуы немесе тоқ өткізугі лак, эмальді, т.б. енгізу арқылы жүзеге асады;
- металл қаптамаларды гальваникалық әдіспен төсеу;
- әрлеу – пассивтендіру, бояу, шаю, кептіру және қажет жағдайда консервациялау.
Металдандырылушы материалға байланысты бұл үрдістің әрбір сатысы өзіндік ерекшеліктерге ие.
Алтын және оның галогенидтерінің химиялық қасиеттері. Алтын- асыл металл, мыс пен күміске қарағанда ауыр, қиын балқиды және жұмсақ. Молекулалық массасы = 196,967; Тығыздығы (г/см3)= 19,29; Тбалқу = 1064,43 °С; Тқайнау = 2947°С. Алтын өзінің химиялық қосылыстарында +1 және +3 тотығу дәрежесін көрсетеді. Алтынның барлық қосылыстары тұрақсыз және оңай металға дейін тотықсызданады, тіпті қыздырғанда да.
Бұл металдың қасиетін оның төмен химиялық активтілігі көрсетеді. Ауада, тіпті ылғалда алтын өзінің қасиетін өзгертпейді. Тіпті жоғары температурада да алтын сутекпен, оттекпен, азотпен, күкіртпен және көміртекпен де әрекеттеспейді.
Алтын галогендермен қосылыс түзеді, броммен бөлме температурасында, ал фтор, хлор және иодпен қыздырғанда реакцияға түсу үрдісі жүреді.
Алтынның электродтық потенциалы сулы ерітіндіде өте жоғары:
Au =>Au+ + е, E0= + 1,88В (1)
Au=>Au3+ +3е, E0 = + 1,58В. (2)
Сондықтан алтын ешқандай сілтіде де, қышқылд ада, тіпті, күкірт, азот, тұз, балқытқыш, органикалық қышқылдарда да ерімейді.
Алайда, күшті тотықтырғыштардың қатысында алтын бірқатар минералды қышқылдарда ериді. Олиод қышқылы Н5IO6, марганец қостотығы, азот қышқылының қатысуымен концентрленген күкірт қышқылында ериді, сондай-ақ сусыз ыстық селен қышқылында да H2SeO4, бұлар өте күшті тотықтырғыштар болып табылады.
Алтын патша арағында, оттегі қатысындағы сілтілік және сілтілік жерметалдарының цианидті сулы ерітінділерінде, хлор мен қаныққан тұзқышқылында оңай ериді.
Темір (ІІІ) сульфаты немесе хлорид тотықтырғышы бар, тиомочевинаның сулы ерітіндісі алтынның жақсы еріткіші болыптабылады.
Алтынның әрекеттесу реакциялары:
| Au + HNО3(конц.) + 4HCl (конц.) = H[AuCl4] + NO + 2H2O. (3) |
| 2Au + 6H2SeO4= Au2(SeO4)3 + 3SeO2 + 6H2O (200°C). (4) |
| 2Au+ 3F2 = 2AuF3 (300 – 400°C). (5) |
| 2Au + 3Cl2 = 2AuCl3(150°C дейін). (6) |
| 2Au + Cl2 = 2AuCl (150 – 250°C). (7) |
| 2Au + 2Br2 (с) = АuBr3 + AuBr (20–35°C). (8) |
| 2Au + I2 = 2AuI (120 – 393°C). (9) |
| 2Au + 3Cl2 + 2H2O = 2H[AuCl3(OH)]. (10) |
| Au + 3E2 + 2HЕ(конц.) = 2H[AuE4] (E= Cl, Br, I). (11) |
| 4Au + 8MCN (конц.)+ O2 +2H2O = 4M[Au(CN)2] +4MOH (M=Na, K) (12) |
| Au + K[Ag(CN)2] = K[Au(CN)2] + Ag. (13) |
| Au + NaNO3 = NaAuO2 + NO (350–400°C) (14) |
| 2Au + 5KrF2 = 2AuF5+ 5Kr. (15) |
2.2 Алтынның галогенидтері. Алтын хлориді (I) ашық жасыл түсті, термиялықтұрақсыз, ыдырапбалқиды. Салқынсудаерімейді, кристаллогидраттартүзбейді. Ыстықсудаыдырайды, қышқылдармен, сілтілермен, аммиакгидратыменәрекеттеседі. Кешендітүзуреакциясынатүседі.
Алтын (І) хлоридін, Аu (III) хлоридін 180-190°Сдейінабайлапқызыдырыпалуғаболады:
АuСl3 = AuCl + Cl2 (16)
ал, 200°С-тан жоғары температурда элементке дейін ыдырайды және бұлынғыр-сары түсті ұнтақ болып табылады. Алтын (І) хлоридітіптібөлметемпературасындадаАu(III) хлоридіменметалдықАu дейінбаяудиспропорцияланады:
3AuCl = 2Au + AuCl3. (17)
Алтынхлоридінің (I) әрекеттесуреакциялары.
2AuCl = 2Au+ Сl2 (жоғары 289°С). (18)
3AuCl + H2O (ыстық) = H[AuCl3(OH)] + 2Au (19)
AuCl + МСl(конц.) = M[AuCl2] (M = Н, Na, K) (20)
2AuCl + 3NaOH (конц., ыстық.) = Na[Au(OH2)] + AuOH + NaCl (21)
AuCl + 2(NH3∙Н2O)[конц] = [Au(NH3)2]Cl + 2Н2O (22)
Алтын (І) бромиді өзінің қасиеті бойынша AuCl ұқсас. Алтын (І) бромидін AuBr3 200°С-тан жоғары температурада қыздырып алуға болады, бірақ 250°С-тан жоғары температурада бірден элементке дейін ыдырайды. Ылғалдың әсерінен AuBr, AuCl сияқты AuBr3 мен металдық Аu дейін диспропорцияланады. Сілтілі металдардың бромидті ерітіндісінде AuBr еріп кешенді анион [AuBr2] - түзеді.
2.3 Алтын (І) иодидінбөлме температурасында AuI3 ыдырату арқылы алады. Қыздырғанда AuI, AuCl және AuBr қарағанда оңай ыдырайды. Керісінше, басқа галогенидтерге қарағанда алтын (І) иодиді сумен баяу иод ерітіндісінің HI немесе KI сулы ерітіндісі әсерінен кешенді AuI2- анионы түзіліп, ұсақдисперсті алтын соңынан ериді.
\
2Au + I2 + 2I- = 2AuI2- (23)
Алтын (І) иодиді ерітіндісін алтынқұрамды қалдықтарды өңдегенде қолданады.
2.4 Алтын хлориді (III).Алтынның хлоридін 240°С температурада алтын ұнтағының үстінен газ түріндегі хлорды өткізу арқылы алады. Түзілген хлорид айдалады және тұндырғанда қызыл түске боялады. AuС13 суда ериді, бұл қоспаның сулы ерітіндісінің түсі қызыл-қоңыр түсті, бұл кешенді қосылыстың түзілуімен түсіндіріледі:
AuCl3 + Н O= Н2[AuОС13]. (24)
2.5 Алтын хлоридінің (III) әрекеттесу реакциялары. Алтын хлориді (III) жабық қызыл түсті, ұшқыш (AuСl3), қыздырғанда ыдырайды, хлордың артық қысымында балқиды. Сондай-ақ алтын (III) хлориді жарықтың әсерінен біртіндеп ыдырайды. 100°С-тан жоғары температурада алтын (III) хлориді хлор мен хлорлы алтынға дейін, ал 220°С-тан жоғары температурада хлор мен металдық алтынға ыдырайды. Сумен өңдегенде құрамын өзгертіп ерітіндіге өтеді. Қышқылдармен, сілтілермен әрекеттеседі. Сулы ерітіндідегі реакциясында Н[АuСl4] түрінде болады.
AuCl3 = AuCI + Cl2 (150 - 185°С). (25)
AuCI3·2H2O =AuCl3 + 2H2O (30°С жоғары) (26 )
AuCl3 + 2H2O= [АuСl3(ОН)]- + Н2O+. (27)
AuCl3 + HCl (конц.) = H[AuCl4]. (28)
2AuCl3 + 6NaOH (сұйылтылған) = Au2O3 + 6NaCl + 3H2O. (29)
2AuCI3 + 3F2 = 2AuF3 + 3C12 (200°С). (30)
2AuCl3 + 3H2S = Au2S3 + 6HCI (эфирде). (31)
2AuCl3 + 3H2O2 (конц.) = 2Au (коллоид) + 3O2 + 6HC1. (32)
AuCl3 + 3FeS04 = А11 + Fe2(S04)3 + FeCl3 (200°С). (33)
AuCl3+ 4Na2S03S (конц.) = Na3[Au(S03S)2] + 3NaCl + Na2SO6. (34)
Басқа Au(Ш) галогендерініңішінен AuI3 қызықтыболыптабылады. Оныңқосылыстарысудаерімейді, ұнтағыжабық-жасылтүсті. Алтын (ІІІ) иодидінтөртхлорлыалтынқышқылдыерітіндісінкалийиодидіерітіндісінеқосуарқылыбейтараптапалады:
AuСl4- + 3I- = AuI3 + 4Сl- (35)
Химиялық металдандырудың автокаталитикалық реакциясын инициирлеу үшін қапталушы беткі қабатты каталитикалық белсенді ету қажет. Кейбір электрөткізгіштікке ие материалдарда қысқа уақытты катод импульс беру арқылы химиялық металдандыру ерітіндісінде де активацияны жүргізу болады, осы кезде беткі қабатта химиялық металдандырудың автокаталитикалық реакциясын ұстап тұруға жеткілікті металл мөлшері тұнбаға түседі. Диэлектриктерді арнайы, кейде аса күрделі – активтендіру үрдісіне ұшырату қажет болады.
2.6 Активтендіру.Диэлектриктердің беткі қабатын физикалық және химиялық әдістермен активтендіруге болады. Физикалық әдістерге құрамында 1-5% каталитикалық белсенді металдың активаторы (Pd, Ag) немесе арнайы өңдеуден катализаторларға жеңіл айналушы заттары бар металдандыруға қажетті арнайы материалдарды дайындау жатады. Активатордың қабатшаның бүрку немесе вакуумда конденсациялау арқылы қалыптастырады, әрімен қарай акселерацияны қыздыру немесе сәулелендірумен жүзеге асырады.
Ыңғайлы болып келетін химиялық әдістерді беткі қабатты қалайы (ІІ) тұзының ерітіндісінде сенсибилизациялаудан, сумен шаю және палладий мен күміс ерітінділерінде активтендіруден тұратын классикалық әдіскежәне ерімтал қосылыстардың иондары немесе коллоидты бөлшектер түріндегі катализатор ерітіндісімен, сонымен қатар күміс пен палладий тұздарынан құралған.
Әртүрлі беткі қабаттар активацияға әртүрлі әсер етеді, себебі олардың активаторды сорбциялауға қабілеттері өзгеше. Сонымен бірге, олардың активтордың каталитикалық белсенділігін төмендету мен ұлғайту қабілеттері де әрқилы. Фторопласт пен сол тәріздес материалдардың тегіс гидрофобты қабаттарын активтендіру қиынға соғады, жеңіл болып келетіндеріне – ағаш, қағаз секілді материалдардың микробұдырлы және қуысты беткі қабаттары болып табылады. Үлкен көлемдегі кеуектілік те қажетсіз, себебі мұндай жағдайда активтендіру ерітінділерінің қалдықтарын шаю қиынға соғады, бұл өз кезегінде металдандыру үрдісіне кедергі келтіреді немесе химиялық металдандыру ерітінділерін ыдыратады.
Активтендіру әдістері активтендіру күшіне байланысты да жіктеледі, ал химиялық металдандыру ерітінділері активацияға сезімталдығымен ерекшеленеді. Соңғысы металл кез-келген қаптамаға тұнғанда шексіз үлкеннен химиялық металдандырудың аса күшті тұрақталған ерітіндісінде каталиктикалық белсенді беткі қабат металмен қапталмағанда нөлге дейінгі аралықта өзгеріп отырады.
Беттік қабаттың активтілігін өлшеу мәні ретінде химиялық металдану реакциясының индукциясы периодына кері болып келетін активация тиімділігін атауға болады. Кейде беттік қабаттың активтілігі онда қапталған металл мөлшерімен де анықталады.
Активация тиімділігі беттік қабаттағы активатордың санына тікелей байланысты. Химиялық металданудың тұрақты ерітінділерінде тек қажетті минималды активтілікке ие болатын беттік қабаттар ғана металмен қапталатын құбылыс байқалады, яғни жеткілік ұзақ уақыт аралығында беткі қабат металмен қапталмаса ол әрімен қарай да қапталуы екіталай.
Бұл құбылысты іріктеушілік металдануда қолданады, мысалы, пластмассалық бұйымдарды металдап, активатордың мөлшерін аз сорбциялайтын материалдан жасалған ілмектерді металдандырмайтын жағдайларда пайдаланады.
Беткі қабатты активтендіру үрдісі кезінде қолданылатын тағы бір үрдісті сенсибилизациялауда әдетте қалайы (ІІ) тұздарының сілтілі немесе қышқыл ерітінділеріне сенсибилизацияланатын беткі қабатты бірнеше минутқа батырады және кейіннен сумен шаяды. Сумен шаю кезінде қалайының тұздары гидролизденеді және беткі қабатта бірнеше қалың қабаттан тұратын 100 нм дейін жететін гидролиздің аз ерімтал өнімдерінің көп мөлшерін түзеді. Беткі қабат гидрофильді және каталитикалық белсенді металдардың иондарын байланыстыруға қабілетті болады, осы орайда олар тотықсызданады және сенсибилизацияланған беткі қабатқа бекітілетін аз ерімтал қосылыстарды түзеді.
Химиялық мыстау, никельдеу және басқа металдарды тұндыру үшін әдетте құрамы келесідей сенсибилизациялау ерітінділерін пайдаланады, г/л: SnCl2∙2H2O -40±20, HCl (конц) -40±20. Сенсибилизациялау тиімділігін арттыру үшін ерітіндіге қалайы (ІV) хлоридінің кейбір мөлшерін енгізеді, ыстық сумен немесе натрий карбонаты, аммиактың әлсіз сілтілі ерітінділерімен шаяды. Қалайы (ІІ) тұздарының беткі қабатта артық мөлшерде гидролиз өнімдерін түзуі борпылдақ, беріктігі төмен металл қаптамаларын төсеуге әкеп соғады.
Сенсибилизациялаудан кейінгі активтендіруге палладий және күміс тұздарының сұйытылған ерітінділерін қолданады. Әдетте палладий хлоридінің әлсізқышқылды ерітінділерін қолданады (0,01-5 г/л), себебі олар барлық ерітінділерде тұндырушы металл мен қолданылушы тотықсыздандырғыштардың табиғатына тәуелді емес түрде химиялық металдандыру реакцияларын инициирлеуге тура келеді. Сонымен қатар, активтендіру ерітіндісіндегі палладий тұздарының азғана концентрациясы олардың шығымын азайтады және басқа металл-активаторларға қарағанда палладийді қолдану экономикалық тұрғыдан тиімді.
Өзінің әмбебаптылығы мен активтендіру күшінің көптігіне қарамастан активтендірудің классикалық әдісі екі ерітіндімен жұмыс жасауға мәжбүр болатын технологиялық кемшілікке ие, оның бірі ауа оттегісімен тез тотықса, екіншісі қалайы қосылыстарымен ластанады; бұл ерітінділерді бақылау-түзету өте күрделі болып келеді. Сондықтан соңғы уақыттарда тура активтендіру әдісін жиі қолданады, мұнда өздігінен өңделген металл емес материалдың беткі қабаты каталитикалық активті металдың иондарының немесе оның коллоидты бөлшектерін сорбциялаушы ретінде әрекет етеді.
Сенсибилизацияланған беткі қабатты мыстаудан алдын активтендіруде хлорлы палладийдің сұйытылған ерітінділерін (0,1-1 г/л) немесе күміс тұздарының аммиакты ерітінділерін (1-2 г/л) қолданады. Бұйымдарды бөлме температурасында 1-2 мин аралығында өңдейді. Активтелген беткі қабат қара-қоңыр немесе сұр түске ие болады. Беткі қабаттағы палладийдің мөлшері шамамен 0,5-20 мг/м2, яғни сенсибилизациялаудан кейінгі беткі қабаттағы қалайы мөлшерінен 5-10 есеге төмен. Сенсибилизациялау-активтендіру үрдістерінің тиімділігін арттыру үшін оны бірнеше мәрте қайталайды. Есте қалар жәйт, бұл үрдіс қайталауда орнығу беріктігі төмендейді, себебі активациялық қабаттар механикалық тұрғыдан берік емес. Ылғал түрінде олар тез жойылады, тіптен азғана мөлшерде әсер еткенде де.
Металдың едәуір мөлшерін сорбциялауға қабілетті өңделген кейбір металл емес материалдарға тікелей иондық активтендіру үшін палладий хлоридінің әлсіз қышқылды ерітінділерін (рН=1-5, 2 г/л) немесе күміс нитраты ерітіндісін (10 г/л) пайдаланады. Беткі қабатта қалған белсенді каталитикалық металдың мөлшері оның ерітіндідегі концентрациясына, активтендіру ұзақтығы мен температурасына байланысты. Активтендіруді 40-80°С кезінде 3-30 мин аралығында палладийдің (1 г/л) сульфатты ерітінділерінде (30%) жүргізеді.
Өңдеу-активтендіру үшін 30% күкірт қышқылымен қаныққан хром үш оксидіне палладий сульфаты немесе хлоридінің 0,5 г қосады; өңдеу уақыты 60±50°С температурада 5-15 мин уақыт аралығында.
Иондық тікелей активтендіру немесе өңдеуден кейінгі активациялау тиімділігін арттыру үшін сумен шайылған беткі қабатты бөлме температурасы немесе кішкене жоғары температураларда (40-80°С) 2-5 мин аралығында тотықсыздандырғыш ерітіндісінде (натрий гипофосфитінің 5-15% ерітіндісі) акселерацияға ұшыратады. Сонымен қатар натрий боргидрінің (0,1-0,2%), диэтиламинборанның (0,05-0,2%), гидразиннің (0,1-5%) сілтілі ерітінділерін қолданады. Акселерация елеулі түрде индукция периодын қысқартады, металдық қаптаманың тұну жылдамдығын арттырады және химиялық металдандыру ерітінділерін активатор және ыдырау өнімдерімен ластанудан сақтайды.
Тура коллоидты активтендіру үшін келесі құрамдағы палладий хлориді мен қалайы хлориді ерітінділерін қоспасы қолданады, г/л:
PdCl2– 0,1-10;
SnCl2 – 10-100;
HCl (концентрленген) – 25-120;
KCl (NaCl) – 100-280.
Мұндай ерітіндіде өңдеу, суда және тұз қышқылында шаюдан кейін беткі қабатты бөлме температурасында 3-10 мин аралығында өңдейді. Шайғаннан кейін акселерацияны жүргізеді, сол уақыта беткі қабаттан қалайы қосылыстарының артық мөлшері жойылады. Бұл үрдісті орындау үшін күйдіргіш натрдың 2-4% ерітіндісі немесе тұз қышқылының 10% ерітіндісі қолданылады. Коллоидты ерітінділерімен активтелген беткі қабат құрамында 0,05-0,5 мг Pd/м2 болады.
Металды тұндыру. Металл емес материалдардың бетіне металл қаптамаларын химиялық тұндыруды металлдандыру ерітіндісіне батыру немесе беткі қабатты бүрку (аэрозольді металлдандыру) арқылы жүзеге асырылады. Батырылушы бұйымдарды ілмектерде бекітеді немесе барабанға, қорапшаға, арнайы ыдыстырға салады. Ілмекте металлизациялау кезінде қапталушы беткі қабаттың ерітінді көлеміне қатынасы шамамен 2-4дм2/л болуы қажет. Үйіндімен металлизациялау кезінде, әсіресе ұнтақты материалдарды, бұл қатынасты 100 дм2/л дейін ұлғайтады. Осы орайда металл толық тұндыратын бір рет қолдануға жарамды ерітінділерді қолданады және салдарынан ерітіндіні қайта қолдану мақсатында оны түзетуді жүзеге асырмайды. Өңдеу-активтендіру ерітінділерін оның таусылғанынша қолдану және акселерацияны химиялық металданумен біріктіру арқылы металл қаптамасын төсеу үрдісін екі сатыға дейін қысқартуға болады.
Аэрозольді металлдандыру кезінде ерітінділерді толық таусылғанынша түзетілімсіз қолданады. Аэрозольді әдісті қолдану ерітінділерді қысылған ауа арқылы шашу қондырғысымен жабдықталған арнайы құралдарды қажет етеді. Аэрозольді әдісті көбінесе үлкен көлемді беткі қабаттарды күмістеуде қолданады.
Тұрақты түзетілімі бар ерітінділермен жұмыс жасағанда рН (±0,1), температура (20С), құрамдастар концентрациясы (±20%) секілді параметрлерді реттеуден бөлек, ерітінділерді 1 мкм үлкен бөлшектерді ұстап қалушы сүзгілер арқылы 1 сағ 10 көлемге дейін сүзгілеу және ерітінділерді араластыру қажет. Ауамен араластыру қажетсіз, себебі металдарды тұндырудың бастапқы сатыларын күрделендіреді және қаптаманың пассивтелуіне әкеледі.
Химиялық металдануға арналған ванналар химиялық тұрақты және инертті қабатқа ие болуы қажет. Коррозияға тұрақты болаттардан жасалған ванналардың қабырғаларына металдың тұнуын алдын алу үшін азот қышқылымен пассивтендіру және анодтық қорғанысты қолданады, сонымен қатар бұйым қаптамасына тұну потенциалынан ванна қабырғаларының потенциалдарын ұстап тұрады.
Үлкен көлемді ыдыстарды химиялық никельдеу немесе күмістеу кезінде сол ыдыстарды металдандыру ерітіндісіне арналған ыдыс ретінде қолданады және металдандырудан алдын ыдыс қабырғаларын өңдейді және активтендіреді.
2.7 Алтындау үрдісіне шолу
Химиялық әдіспен алынған алтын қаптаулар радиоэлектрондық өндірісте аса кең қолданыста. Олардың гальваникалық қаптамалармен салыстырғандағы артықшылығы негіздеменің құрылымына қарамастан оның бетінде біркелкі қалыңдықта тараған қаптамаларды алу мүмкіндігі жатады. Бұл жәйтті жұқа қабатты алтын қаптамаларды алуда ерекше мәнге ие.
Алтыннан теріс электрлік мәні жоғары металдарда – темір, никельде алтын қаптамаларын келесі құрамдағы ерітіндіге батыру кезінде орын алатынконтактілі айырбастау кезінде алуға болады, г/л: 0,6 AuCl3, 10 KCN, 6 Na3PO4∙12H2O, 3Na2SO4, 1NaOH, t=98-100°C. Металл беткі қабаты алтынның жұқа қаптамасын төселгенде реакция тоқтатылады және тұнбаның әрі қарайғы өсімі тоқтатылады. Алынатын қаптама қалыңдығы 0,2-0,3 мкм аспайды. Осы себептен мұндай ерітінді кең қолданысқа ие емес. Аса ірі қалыңдықтағы қаптамаларды алу үшін құрамында тотықсыздандырғышы бар – гидразин, формальдегид, натрий және калий бораны бар ерітінділер жасалынған. Мұндай жағдайларда тұнба контактілі айырбастауда нәтижесінде ғана емес, сонымен бірге металдың химиялық тұнуы негізінде де қалыптасады. Бұл үрдістің негізінде алтын иондарын металға дейін электрохимиялық тотықсыздануы мен тотықтырғыштың тотықсыздануы орын алады. Аталмыш жолмен алынатын қаптамалардың қалыңдығы бірнеше микрометрге жетеді.
Алтынды химиялық тұндыру үшін сілтілі және қышқылды ерітінділер ұсынылған. Калий немесе натрий бораны бар сілтілі цианидті ерітіндісін тотықсыздандырғыш ретінде қолдану өте тұрқаты, алтын және тотықсыздандырғыш бойынша сәйкесінше түзетілімі болса көп реттік қолдануға жарамды. Мұндай ерітінділердің құрамы келесідей, г/л: 6KAu(CN)2, 6,5 KCN, 7NaOH, 0,4 NaBH4, үрдіс 750°С кезінде жүреді. Натрий боранын диметиламиноборанмен алмастыруға болады. Алтынға қарағанда никельді немесе кобальтті негізде тұнбаға түсу жылдамдығы жоғары, себебі натрий борогидратын тотықтыру үрдісіне әсер етуші олардың әртүрлі каталитикалық белсенділігімен түсіндіріледі. Гальванотехникадағыдай цианидті ерітінділерді темір-роданидті ерітінділерге алмастыру әрекеті көрсеткендей, оларда сапалы қаптамалар алуға болады, алайда қаптамалардың жарамдылық мерзімі аса көп емес.
Тотықсыздындырғыш ретінде қолданылушы натрий гипофосфиті, формальдегид немесе күкіртқышқылды гидразинде алтындаудың қышқылдық ерітінділерді улылық төмендеу. Цитратты-гипофосфитті ерітіндіде алтынды болатқа, никельге, пермаллойға тұндыруға болады, бірақ алтын, немесе қалайы секілді оң электрлі металдарда қаптама алу мүмкін емес. Осындай атаулы ерітінді құрамы мынадай, г/л: 1-10 KAu(CN)2, 45-50 лимон қышқылы, 70-75 NH4Cl, 10-25 NaH2PO2, pH 6,5-7,0, үрдісті 90-92°C жүргізеді. Ерітінді дицианаурат және гипофосфит бойынша периодты түрде түзеткенде оны айтарлық ұзақ уақыт аралығында пайдалануға болады.
Алтындаудың жылдамдығы негіздеме материалына байланысты өзгереді. Химиялық жолмен алынған Ni-P балқымасын алтындағанда жоғары жылдамдық – шамамен 0,7 мкм/сағ жетеді, ал одан төмені – гальваникалық никельді алтындағанда орын алса, пермаллойдың жағдайында – шамамен 0,4мкм/сағ.
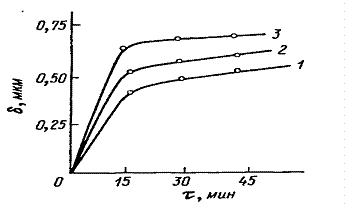
Белгіленуі: 1 - пермаллой, 2 - никель, 3 - химиялық әдіспен алынған Ni-P балқымасы.
1.1-сурет. Гипофосфитті ерітіндідегі алтындау ұзақтығы мен материал негізіне қаптаға қалыңдығының өзгеру тәуелдігі
Салыстырмалы қалың қаптамалар келесі құрамға ие гипофосфитті қышқыл электролитіндегі ерітіндісінде алынуы мүмкін, г/л: 10Au, 50 лимон қышқылы, 40CoCl2∙6H2O, 10 натрий гипофосфиті, 100-150 тиокарбамид, рН 5-6, температура шамамен 90-92°С. Тиокарбамидтің концентрациясын 150 г/л ұлғайту қаптама қалыңдығын 1.1-суретке сәйкес едәуір арттырады. Аталмыш қоспа концентрациясын арттыру тұздың тұнбаға түсуіне әкеп соғады.

Белгіленуі: С, г/л 1 - 0, 2 - 100, 3 - 150
Негізгі құрам, г/л: 10Au, 50 лимон қышқылы, 40CoCl2∙6H2O, рН-6, температура 92°С
1.2-сурет. Тиокарбамидтің цитратты ерітіндісіндегі С концентрациясы мен алтындау ұзақтығының қаптама қалыңдығының өзгеруіне тәуелділігі
Радиоэлектронды құрылғылардың бұйымдарын алтындауға мынадай құрамды цитратты-гидразинді ерітінді ұсынылған, г/л: 4,8 Au, 75күкіртқышқылды гидразин, 30 лимон қышқылы, 80 NH4Cl, 1 FeSO4, рН 5,7-5,9; температура 95±10°С. Теріс электрлік мәні аса жоғары металдардың бетіне алтынның бөлінуі алтын иондарының гидразинмен химиялық тотықсыздануы мен контактілі алмасуы нәтижесінде орын алады. Ерітіндіге бұйымдардың жүктеу тығыздығы 3 дм2/л болғандағы никельқұрамдас балқымалардағы алтын қаптамаларының қалыңдығы 3-5 мкм болса, химиялық тұрғыдан алынған Ni-P балқымаларда – 3-3,5 мкм/сағ, Ni-В -4-5 мкм/сағ. Тазалығы жоғары алтын тұнбалары (99,98%) дәнекерлеу мен біріктіруге икемді болып келеді. 400-450°С термоөңдеуден кейін металл қаптамасының негізбен орнығу беріктігі ұлғаяды. Аталмыш электролиттің оңтайлы қасиеттеріне пайдаланғандағы тұрақтылығын, алтын мен рН мәні бойынша түзетілім кезіндегі бұйымдардың жүктеудің көп реттілігін атауға болады.
Аса қолайлы жағдайлардың өзінде де химиялық алтындау ерітінділерінің жарамдылық мерзімі аса үлкен емес, әсіресе қолданылған ерітінділер мен шайынды сулардың қолданыстан кейінгі залалсыздандырылулары күрделі мәселе болып тұр. Олардың құрамында, негізгі компонент-алтыннан басқа қаптама төселген балқымалар, тотықсыздандырғыштардың қоспалары болуы мүмкін. Алтын бөліп алуда АВ-17 типтес ионалмасқыш шайырды қолдану тек негізгі металды сорбциялау ғана емес, сонымен бірге никель құрамдастарын да бөліп алуға мүмкіндік береді, сондықтан келесіде шайырды жаққанда құрамында 10% Ni бар балқыма алынады. Құрамында 2 г/л алтын және 1,7 г/л Ni бар 10 ерітіндіні регенерациялауға 67 г шайыр қажет. Алтынды бөліп алудың мәнін ұлғайту үшін ерітіндіні шайырмен толтырылған бағаналардан бірнеше мәрте өткізеді. Осы орайдағы алтынның қайтарымсыз шығымдары шамамен 0,1% құрайды. Алтыннан тазартылған ерітіндіде қалған күкірт қышқылды гидразинді ерітуді оған никель пластинасын салып 90-95°С жүргізеді. Тотықсыздандырғыштың ыдырау жылдамдығы шамамен 50 г/(м2∙сағ). Регенерациялау үрдісінің үнемділігін арттыру үшін алтынның никельге қарағандағы аса бір іріктемелігімен ерекшелінетін белсендірілген көмірлерді қолдану ұсынылады.
2.8 Химиялық және фотохимиялық ыдырату арқылы металдандыру
Фотохимиялық реакциялар химиялық реакцияға түсетін заттардың бірі сәуле квантын өзіне сіңіріп, нәтижесінде өзі активті бөлшекке айналып одан әрі жүретін реакциялар. Фотохимиялық реакциялар газдарда да, сұйықта да, қатты заттарда да жүре береді. Фотохимиялық рекцияның орындалуында қозған қалыптың өмір сүру уақытының маңызы аса зор, өйткені бұл уақыттың ішінде молекула артық энергияны сақтайды. Сондықтан көптеген фотохимиялық реакцияларға триплетті қозған қалыптағы молекулалар қатысады, өйткені мұндай молекулалардың синглетті қалыппен салыстырғанда өмір сүру уақыты анағұрлым көп болады.Күн сәулелері немесе жасанды жарық көздерімен жарықтың әсер ету барысында үлгінің беттігі қараяды. Үлгінің беттігінің қараюы оның кебуі барысында қарқынды болады. Сонымен бірге, егер үлгінің беттігінің жеке учаскелерін жарықтық жерден экрандалса, онда бұл учаскелер қараймайды немесе төменгі дәрежеде қараяды. Сонымен қатар, белгілі болғандай, егер үлгіні алдын ала қараңғы орында кептіріп, одан соң күнге қояр болса, үлгінің қараюы жүрмейді.
Фотохимиялық реакциялардың жүруі затқа сіңірілген жарық сәулелерінің әсерінен ғана болатынын алғаш орыс ғалымы Х.Гротгус дәлелдеген (1818 ж.). Ол “Химиялық қоспада тек жұтылатын сәулелер ғана химиялық активтіболады” - деп тұжырымдалатын фотохимияның бірінші заңын ашты. Фотохимия саласында жинақталған тәжірибелік материалдар мен оларды ғылыми жағынан түсіндіріп, бір жүйеге келтіру XX ғ-дың 1-жартысында кванттық механика, атомдық немесе молекулалық спектроскопия дамығаннан кейін мүмкін бола бастады. Фотохимияның екінші заңы - кванттық эквиваленттілік заңын А.Эйнштейн ашты (1912ж.). Бұл заң бойынша жұтылатын сәуленің әрбір кванты тек бір ғана молекуланы түрлендіруге қатысады. Фотохимиялық реакциялар кезінде химия жүйенің бос энергиясының азаюы немесе көбеюі мүмкін. Энергияның көбеюі сырттан сіңірілген жарық сәулелері энергиясының жүйе энергиясына қосылуынан болады. Фотохимиялық активтену процесінде жарық сәулелерін сіңірген молекула атомдарға немесе атомдар тобына ыдырайды, кейде молекула ыдырамай “қозған” молекула күйіне ауысады. Ыдыраудан пайда болған бөлшектердің немесе заттардың активтілігінің жоғары болуы ондағы бос валенттілікке байланысты. Фотохимиялық реакциялардың тиімділігі квант шығымымен анықталады. Ол реакция өніміндегі молекулалар санының жұтылған квант санына қатынасына тең. Фотохимиялық реакциялар: фотодимерлену, фотоконденсаттану, фотоиондану, фотототықтыру, фотогидролиз, т.б. болып бөлінеді.
Жарықтын әсерінен қозған молекуланың реакциялық қабілеттігіне бірқатар факторлар әсерлерін тигізеді. Реакцияға түсу қабілеті қозған электронның энергетикалық деңгейінің қалпына тәуелді. Бұл деңгей энергетикалық тосқауылдан өтуді 1.3 суретке сәйкес қамтамасыз етеді.

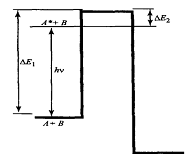
Белгіленуі: ΔE1 - көлеңкелік реакцияның активация энергиясы; А + В→Р; ΔE2- берілген: А*+В →Р (ΔE1>ΔE2) фотохимиялық реакцияның активация энергиясы
1.3-сурет А*+В→Р фотохимиялық процесінің энергетикалық сызбасы
Фотохимиялық рекцияның орындалуында қозған қалыптың өмір сүру уақытының маңызы аса зор, өйткені бұл уақыттың ішінде молекула артық энергияны сақтайды. Сондықтан көптеген фотохимиялық реакцияларға триплетті қозған қалыптағы молекулалар қатысады, өйткені мұндай молекулалардың синглетті қалыппен салыстырғанда өмір сүру уақыты анағұрлым көп болады. Оның үстіне мұндай молекула бирадикал болып табылады.Барлық фотохимиялық реакциялар біркванттық механизм бойынша жүреді (реакцияға түсетін молекула тек қана жарықтың бір квантын жұтады). Тек қана күшті лазерлі сәулеленудің әсерінен молекула екінші квантты жұтуға үлгере алады да бір молекуланың екіфотонды қозуы пайда болады және молекула жоғары қозған деңгейлерге көшеді.
Фотохимиялық реакция кезінде жартылай өткізгіштердегі жарықтың сіңірілуі салдарынан зарядты бос тасымалдаушылардың генерациясы байқалады - электрондар және тесіктер, соның салдарынан заттың электрөткізгіштігі артады. Бұл құбылыс ішкі фотоэффект немесе фотоөткізгіштік деп аталады.
Фотонды сіңіру нәтижесінде электрон қабылдаған қосымша энергия E2 – E1 = hνтүрінде жазылуы мүмкін, мұндағы Е1 және Е2 – қозғанға дейінгі және кейінгі электрон энергия, h - Планк тұрақтысы, ν- электрмагниттік толқулардың жиілігі.
Егер фотон энергиясы hνтаза жартылай өткізгіштің тыйым салынған аймағының ұзындығынан асса (hν>ΔE), онда фотонды сіңіруші электрон валенттік аймақтан өткізгіштік аймағына ауысады (өзіндік фотоөткізгіштік). Нәтижесінде зарядты тасымалдаушылардың тағы қосымша жұбы сәйкес түзіледі - электрон және тесік.
Қоспалы жартылай өткізгіштерде фотон энергиясы электронды донорлық деңгейден өткізгіштік аймағына тасымалдауға жұмсалады (hν>ΔED, сәйкес) (электронды қоспалы фотоөткізгіштік), немесе электронның валенттік аймақтан бос акцепторлы деңгейге тасымалдануына жұмсалады (hν>ΔEA, сәйкес), (тесікті қоспалы фотоөткізгіштік).
Түзілетін заряд тасымалдаушыларының саны түсуші жарық ағынына пропорционалды болғандықтан, ішкі фотоэффект құбылысын оптикалық сәулеленуді тіркеу үшін қолдануға болады. Ішкі фотоэффект фото-тартылыстар әрекетіне (фоторезисторлар) негізделген. Фоторезистор - жарықпен сәулелену кезінде өзіндік кедергісінің мөлшерін өлшеуші жартылайөткізгіштік қондырғы. Әдетте жартылайөткізгішті жұқа қабат ретінде шынылы яки кварцы бетке, немесе монокристалдан жасалған жұқа пластинаға қондырады. Жартылайөткізгіштің қабаты немесе пластинкасын екі электродпен жалғайды және қорғаушы корпусқа енгізеді.
Әдебиеттік шолудың қорытындысы.
Фотохимиялық алтындауда алмаз бөлшектерін енгізу диплом алды әс-тәжірибенің әдебиеттік шолу бөлімінде алтын маңызы бар қосылыстарының физика-химиялық қасиеттеріне шолу жасалынып,аталған металл қаптамасының қасиеттеріндегі ерекшеліктері көрсетілді, оларды алу жолдарының мәселелері анықталды.Металл емес заттарды металдандырудың әдіс-тәсілдері қарастырылды. Металдандырудың химиялық әдісінде жүретін ыдырау және тотықсыздандыру реакциялары қарастырылып, беткі қабатта жүретін негізгі үрдістер - химиялық алтындау үрдісінің ерекшеліктері айқындалды. Диэлектрлі беттерді заманауи химиялық және фотохимиялық жолмен металдандырудың белгілі әдістеріне шолу жасалынды.
1.1 Мыс және оның аналогтары құрамды қабықшалар туралы түсініктеме
Мыс жэне оның галогенидтерінің химиялық қасиеттері. Мыс, Си - элементтердің периодтық жүйесінің І-тобындағы химиялық элемент, атомдық нөмірі 29, атомдық массасы 63,546. Табиғатта тұрақты екі изотопы бар: 63Си жэне 65Си. Жер қыртысындагы массасы бойынша мөлшері 4,7- 10'3%. Негізгі минералдары: халькопирит, халькозин,ковелин, малахит, азурит. Пластикалық қызыл түсті металл, кристалл торы қырлары центрленген кубтық, тыгыздыгы 8,94 г/см3, балқу температурасы 1084,5°С, қайнау температурасы 2540°С, тотыгу дэрежесі +1, +2. Құргақ ауадағы бөлме температурасында тотықпайды. Қыздырганда ауада СиО жэне СщО-га дейін тотыгады, галогендермен, 8, 8е, НМОз, Н2804-пен эрекеттеседі. Аммиак, цианидтермен, т.б. кешенді қосылыстар түзеді. Сульфид концентратын балқытып, одан түзілген мыс штейнін қара мысқа дейін тотықтырып, оны жалынмен не электролиттік әдіспен тазарту арқылы; гидрометаллургиялық эдіс - құрамында мысы бар минералдарды күкірт қышқылымен (немесе ЫН3 ерітіндісімен) өңдеп, одан эрі электролиздеу арқылы алады. Мыс кабельдердің, электр қондырғылары мен жылу алмастыргыштардың ток өткізгіш бөлігін жасау үшін пайдаланылады; қорытпалардың (латунь, қола, мыс-никель, т.б.) кұраушысы ретінде қолданылады [2].
Мыс (I) хлориді - суда ерімейтін ақ түсті кристалды зат. Ол тұз қышқылында жэне аммиактың сулы ерітіндісінде түссіз кешенді ерітінді түзіп ериді. Мыстың басқа бір валентті қосылыстары сияқгы ол да тұрақсыз. Ылгалды күйінде ауада тотыгады, гидролиздену жэне диспропорциялану үрдісіне бейім. Әсіресе тотықсыздандыргыштың қатысында жарықгың әсерінен ыдырайды. Сондықтан оны таза күйінде алу өте қиын, әдетте алынған өнім эртүрлі жасыл түс береді, ақ түсті өнім алу үшін синтездеу кезінде оны тотығудан сақтау керек. Оны қараңғы салқын жерде сақтау керек, эсіресе ауа кірмейтін жэне ылғалдан.
Мыс (I) хлоридін екі әдіспен алуға болдаы [3]: Мыс (II) қосылыстарын тотықсыздандыру немесе мыс (I) оксидін тұз қышқылында еріту арқылы. Мыс (II) қосылыстарын эртүрлі тотықсыздандырғыштармен тотықтыруға болады. Мыс (I) оксидін түз қышқылында еріту аса ыңғайлы әдіс:
Си20 + 2НС1 -> 2СиС1 + Н20.(1.1)
Си20 + 4НС1 -> 2Н[СиС12] + Н20.(1.2)
Екінші реакция тұз қышқылының артық мөлшерінде жүреді, себебі мыс хлориді түнба түспей тұрақсыз түссіз хлорлы комплекс түзеді, ол сұйытылған ерітіндіде ыдырайды:
Н[СиС12] -> СиСІ + НСІ.(1.3)
Мұнда мыс (I) хлориді түнбаға түседі. Осы реакцияның нэтижесінде ерітіндіні сүзгілеу арқылы мыс хлоридін механикалық қоспадан тазартуға болады.
Өнеркәсіпте мыс (I) хлоридін бірнеше әдіспен алады [4]:
1 СиСІ балқымасының үсітінде ілініп тұрған мыстың артық мөлшерін хлорлау:
2Си + С12>2СиСІ (1.4)
2 Қышқылдандырылған ерітіндіде мыспен СиС12тотықсыздандыру:
Си + СиС12>2СиСІ і. (1.5)
Сондай-ақ зертханалық жағдайда ең көп тарағаны соңғы әдіс.
1 Өте таза препаратты мыс пен газ тэрізді хлор сутекті әрекеттестіру арқылы алуға болады:
2Си + 2НСІ> 2СиСІ + Н2. (1.6)
2 Осыған үқсас реакция ерітіндіде тотықтырғыштардың қатысында жүреді
(02, НЫОз, КСЮз):
4Си + 4НСІ + 02>4СиСІ + 2Н20. (1.7)
3 Мысты (II) күкірт қостотығымен тотықсыздандыру ыңғайлы эдіс:
20*504 + 2ЫаСІ+ 502+ 2Н20->2СиСІ і +2Я2504+ Ыа2504. (1.8)
4 Хлоридтің артық мөлшерін сульфитпен тотықсыздандыру:
2Си2++ ЗСГ + 350|" + Я20 ^ 2СиСІ і+250|" + 2Н50^. (1.9)
5 Кері диспропорциялану реакция арқылы:
Си504 + Си + 2ИаСІ>2СиСІ і +УУа2504 (1.10)
6 Дихлоридті термиялық ыдырату арқылы мыстың монохлоридін алу:
2СиС12>2СиСІ+ С12. (1.11)
Мыс (I) галогенидтерін зертханалық жағдайларда келесі реакциялар бойынша алады [4, б. 218]:
2Си8О4 5Н2О+2ЫаСІ+8О2+Н2О=2СиСІ+Ыа28О4+2Н28О4+10Н2О . (1.12)
2Си8О4 5Н2О+2КВг+8О2+2Н2О=2СиВг+2Н28О4+К28О4+10Н2О. (1.13)
2Си8О4 5Н2О+2КІ+8О2+2Н2О=2СиСІ+2Н28О4+К28О4+10Н2О. (1.14)
Мыс (II) галогенидтерін мынадай реакция бойынша алады:
Си(СН3СООН)2+2СН3СОСІ = Си02+2(СН3СО)20. (1.15)
СиО+2НВг=СиВг2+Н20. (1.16)
Химиялық қасиеттері:
1 Мыстың монохлорид суспензиясын қыздырған кезде диспропорциялану реакциясы жүреді [5]:
2СиСІ------ >СиС12 + Си. (117)
2 Мыс монохлориді тұз қышқылында еріп қайтымды кешенді қосьшыс түзеді
СиСІ+НСІ++Н[СиС12\ . (1.8)
3 Мыс монохлориді құрғақ ауада түрақты, бірақ ылғалда хлорид негіздеріне дейін тотығады (кристалдарға жасыл түс береді):
4СиСІ + 02 + 2Н20 ^ 4СиСІ(ОН) .
 4 Қышқылды ортада тотығып орта тұз түзеді:
4 Қышқылды ортада тотығып орта тұз түзеді:
АСиСІ+4НСІ02—►4СиС12+2Н20. (1.20)
5 Азот қыпщылының ыстық концентрациясында да тотығу реакциясы жүреді:
СиСІ+ЗНИ03ЛСи(Ң03)2+НСІ+И02Т+Н20 (1.21)
6 Мыс монохлоридінің аммиакты ерітіндісі ацетиленді жүгып қызыл түнба
түзеді:
2СиСІ+Н2С2+2ИН3->Си2С2і+2ЫН4С (1.22)
7 Мыс монохлоридінің қышқыл ерітіндісі көміртек тотығын жүтып қайтымды реакция түзеді:
СиСІ+СО^СиСІ■СО. (1.23)
3 Тәжірибелік бөлім
Зерттеу нысаны
Жұмыста зерттеу нысаны ретінде: полистирол, мыс пластинасы қолданылды.
Полистирол-пластикалық материалдар — құрамында бұйымдарды дайындау кезінде созылғыштық немесе жоғары иілгіштік, пайдалану барысында шыны тәріздес немесе кристалдық қалпын сақтайтын полимер бар материалдар. Пластмассалар шыны тәрізді немесе кристалды, диэлектрлік қасиеті жоғары, атмосфера әсеріне тұрақты, механикалық жағынан берік болады.
Пластмассалардың кез келгенінің (шайыр мен қарамай негізді пластмассаларды қоспағанда) түп негізін полимерлер құрайды. Мысалы, фенол-фармальдегидті пластмассалар, поливинилхлоридті пластмассалар, т. б. аталуы да пластмассаларға байланысты алынған.
Полимерлерден басқа пластмассалардың құрамына пластификаторлар,толықтырғыштар,стабилизаторлар, бояғыш заттар енеді. Макромолекуласы сызықтық, тармақталған немесе торланған құрылымды болады. Пластмассалар гомогенді (бір фазалы) немесе гетерогенді (көп фазалы) материалдар болуы мүмкін. Гомогенді пластмассалардаполимерматериалдың қасиетін анықтаса, гетерогенді пластмассаларда полимер байланыстырғыш қызметін атқарады, қалған құрам бөліктері өз бетінше жеке фазалар түзеді.
Пластмассалар 4 топқа бөлінеді:
1. полимерлену өнімдеріпластмассалар (полиэтилен, полистирол, т.б.) негізіндегі пластмассалар;
2. поликонденсациялану (полиамидтер, полиэфирлер, т.б.) негізіндегі пластмассалар;
3. химиялық модификацияланған табиғи полимерлер негізіндегіпластмассалар (протеин,целлюлоза,галалит);
4. табиғи және мұнай асфальттары мен шайыр негізіндегі пластмассалар.Сонымен қатар термопластикалық және термореактивті пластмассалар болады.
Термопластикалық пластмассалар қыздырғанда пластикалық күйге химиялық өзгеріссіз өтеді. Оларды бірнеше қайтара қыздырып, әр түрлі пішінге келтіруге болады. Термореактивті пластмассалар жылу әсерінен алғашқы кезде пластикалық, одан әрі қыздырғанда химиялық өзгеріске ұшырайды. Оларды алу үшін құрылысы торланған қосылыстарға тезөтетінполимерлер (эпоксид,анилин, фенол-альдегид, т.б.) қолданылады.
Пластмассалардың бұл түрінен жасалған бұйымдар шыны тәрізді, сол қалпын термиялық деструкция басталғанға дейін сақтайды. Олар 100 — 500oС аралығындағы температурада өзгеріске ұшырамайды.
Пластмассалар электртехника, машина жасау,құрылыс өнеркәсіптерінде, ауыл шаруашылығында, медицинада кеңінен қолданылады. Әр алуан материлдардың жақсы қасиеттері пластмассалардан табылады.
Сондықтан техникалық көптеген мәселелерді шешкенде, пластмассалар ең керекті, тіпті баламасы жоқ материал болып саналады. Мысалы, болатты алатын болсақ, ол өте берік, бірақ меншікті салмағы ауыр, мөлдір емес, электрден қорғай алмайды.Ағашты алсақ, ол жеңіл, бірақ берік емес, шіритін материал. Ал пластмассалар осы күрделі талаптардың барлығына жауап бере алады. Олардың арасынан берік те жеңіл, мөлдір және сынбайтын, электрден қорғағыш қасиеттері жоғары және басқа да сапалы қасиеттері бар түрлері кездеседі. Мысалы, химиялық төзімділігі алтын мен платинадан жоғары, үйкеліс коэффициенті өте төмен немесе өте жоғары, тағы басқа материалдар да бар.
Мыс пластинкасы - элементтердің периодтық жүйесінің І-тобындағы химиялық элемент, атомдық нөмірі 29, атомдық салмағы 63,546. Табиғатта түрақгы екі изотопы бар: 63Си жэне 65Си. Оның жер қыртысындағы массасы бойынша мөлшері 4,7.10-3%. Пластикалық қызыл түсті металл, кристалл торы қырлары куб тэрізді, тығыздығы 8,94 г/см3, балқу температурасы 1084,5°С, қайнау температурасы 2540°С, ал тотығу дәрежесі +1, +2.
Беткі қабатты дайындау. Беткі қабатты дайындау мен металдандыру әдістері бұйымның тағайындалуымен қатар материал түріне, өлшемі мен формасына да байланысты. Металдандыру үшін мүмкіндігінше монолитті және таза материалдарды қолданады. Кеуекті материалдарды кеуек толтырушы заттармен жабады немесе тоқ өткізуші эмальдармен металдайды. Химиялық-гальваникалық металдандыруға ұшырайтын бұйымның формасына оның толық ауданы бойында тоқ көзінің еркін таралуына мүмкіндік беретін жәнетұндырылушы қаптамалар қалыңдығын біркелкі болуын қамтамасыз ететін талаптар қойылады. Түйісулердің орындары бұйымдарды құрастырғанда қарастырылады.
Алдын-ала өңдеу.Механикалық дайындау. Беткі қабатты тазалау мен бөгде заттарды алу үшін металл емес заттарды кейде механикалық қырнауға – күңгірттеуге ұшыратады (жону, киізден жасалған немесе кенеп матамен өңдеу, крацерлеу, құрғақ немесе ылғалды жұмырлау, ағынды-абразивті өңдеу). Ол үшін гальванотехникадағы қарапайым заттарды қолданады.
Металл емес төсеменің бүдірлену деңгейі металданған бұйымның сапасына әсер етеді.
Майсыздандыру.Матаны майсыздандыру- оларды күйдіргіш сілтілермен химиялық өңдеуге ұшырату, кейіннен сумен шаю арқылы жүзеге асады, осы орайда майлы және тасты заттарды жою мен оларды ерімтал күйге келтіру мақсатындағы операция бірнеше мәрте қайталанады. Алайда, алдын-ала крахмалды бөлшектерді жоюшы ашыту үрдісін бастау үшін матаны тәулік бойын ылғалдандырады. Егер мата қатты желімделсе, онда ылғалдандыру қайталанады, кейіннен оны сумен шаяды және өңделуші затқа қатысты салыстырмалы массасы 5% әгі бар әк сүтінің ваннасынан өткізеді. Мұнда артық заттар толық шайылуы үшін матаны ісіндіру қазандықтарынан өткізеді. Ісіндіру кең, герметикалық тығыны бар қазандықтарда немесе көлемді ыдыстарда 2-3 атмосфералық қысымда жүргізіледі. Кейде бұл үрдіс ашық қазандықтарда жүргізіледі, бірақ осы орайда мата толықтай ерітіндіге батырылып тұруы қажет, себебі ауа қол жетімді болғанда күйдіргіш әк матаның құрылымын жойып жібереді. Ісіндіру 6-8 сағ жүргізіледі, кейіннен қоспа заттарды қазандықтан алынады, ал матаны әктен тазарту үшін арнайы машиналарда шаяды. Матадағы қоспа заттарды толықтай жою үшін матаны тұз қышқылының әлсіз ерітіндісінен өткізеді. Қышқыл ваннадан соң матаны жаңадан шайырлы суда қайта ісіндіреді. Шайырлы су 5-6 кг кальцийленген сода және матаның әрбір 100 кг үшін 1½-2 кг шайырдан тұрады. Кейбір фабрикаларда аталған қоспа күйдіргіш натрмен алмастырылады. Қайнатуды аяқтағаннан кейін суды төгеді және үрдісті құрамында 1% кальцийленген содасы бар ерітіндімен жалғастырады. Осыдан соң майсыздандыру үрдісі аяқталды деп есептеледі. Беткі қабаттан матрицамен әлсіз байланысқан бөгде заттарды (лас заттар – органикалық полярлы және полярлы емес заттар, оксидтер, тұздар, адсорбцияланған газдар және иондар) жою үшін механикалық әсер ету мен ультрадыбысты қолдана отырып органикалық еріткіштер және сілтілі ерітінділермен шаяды.
Пластмассалардың беткі қабаттарындағы лас заттардың көпшілігі май, пресс-форма жақпалары, тер, апреттер, еріткіш булары, шаң-тозаң, абразивтер, микроағзалар секілді сыртқы фактор ғана емес, сонымен қатар мономерлер, пластификаторлар, тұрақтандырғыштар, бояушы заттар, деструкциялану өнімдері мен басқа да қоспа заттардан құралатын пластмасса негізіне де байланысты. Бұйымдарды жасағаннан кейінгі оларды 2 тәулік бойы ұстау кейбір дәрежеде аталмыш ластаушы заттардың жойылуына ықпал етеді.
Пластмассаларды майсыздандыру үшін олардың өздерін ерітіп жібермейтін және ісіндермейтін органикалық еріткіштерді қолданады. Кейбір жағдайларда елеусіз ісіну (шамамен 1 мг/см2) кейінгі өңдеуге қажетті шара болып табылады. Майсыздандыру үшін қолданылатын кең тараған еріткіштерді пайдалану бойынша ұсынылымдар:
- этил спирті – полистирол мен оның сополимерлері, полиакрилметилакрилат үшін;
- метил спирті – поликарбонат, полистирол, поливинилхлорид, полиакрилат, эпоксидті шайырлар, аминопласттар, фенопласттар үшін;
- ацетон – полиолефиндер, поливинилхлорид, фторопласттар, полиэфирлер, полиформальдегидтер, фенопласттар үшін;
- трихлорэтилен – поликарбонат, полистирол мен оның сополимерлері, поливинилхлорид, полиамидтер мен фенопласттар үшін;
- ксилол – полиолефиндер, фторопласттар үшін;
- фреон 113 – көпшілік пластмассаларға арналған.
Пластмасса бұйымдарының беткі қабатынан прессформалардың бөлінуші жақпаларды (глицериннің спиртпен қоспасы, кастор майы немесе мырыш стеараты) жою үшін құрамыы келесідей болатын қоспаларды қолдануға болады, %: этанол - 50, этилацетат - 25, бутанол - 15, целлюлоза - 10.
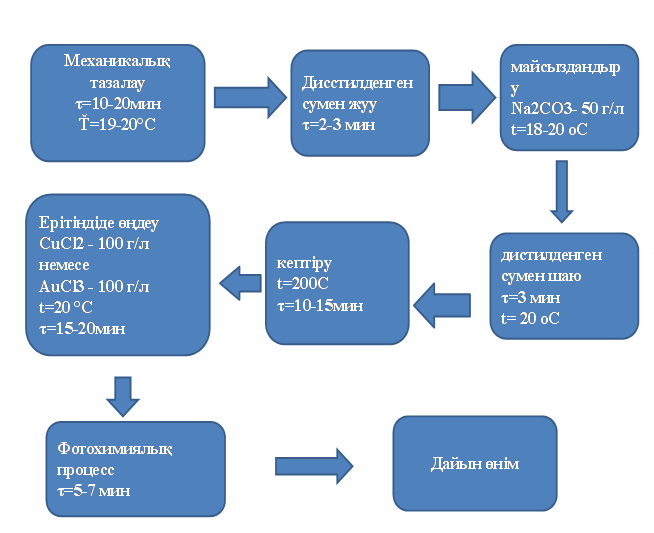
3.2 Алтын ерітіндісін дайындау. Ол үшін құм моншасында сыйымдылықта қыздырылған алтынның ұнтағына “Патша арағын” (1 көлем HNO3, 3 көлем HCl) дайындап құйып ерітіп, алтын тұзын аламыз. Ерітіндіні дайындау реті және дайын болған ерітіндінің суреті 2.1 суретке сәйкес келтірілген. Содан соң, материалдарды дайындалған алтынның хлориді ерітіндісіне концентрациясы 100 г/л батырамыз. Материалдардың барлық жері толық алтынның тұзымен қаныққанша ұстаймыз. Төмен концентрацияда өте жұқа қабықша түзіледі. Мұндай қабықшаларды металл емес материалдарға қондырғанда электр тогын жартылай өткізетін және ары қарай металл қаптамасын қондыру мүкіндігі төмен қаптама алынады.


а) б)
3.1-сурет. Алтын ұнтағынан алтынның тұзын дайындау және алынған ерітіндінің суреті
Алтын тұзына батырғаннан кейін фосфиндейміз.Фосфиндеу үшін фосфинді мына жолмен аламыз. Зерттеулер үшін фосфинқұрамды газды 2 г мырыш фосфидін 10% күкірт қышқылының ерітіндісімен әрекеттестіру нәтижесінде алдық. Сонда, мырыш фосфиді мен қышқыл әрекеттескенде келесі реакциялар жүреді:
Zn3P2+ 3H2SO4→ 2PH3↑+ 3ZnSO4 .(1)
2AuCI3 + PH3 + 3H2O → 2Au + H3PO3 + 6HCI. (2)
Осыреакциянәтижесіндедиэлектрикматериалыныңбетіндесарытүстіалтынтүзіледі. Реакциясоңындаүлгілердіқондырғыданалып, жуамыз.
3.2 Фотохимиялық әдіс үрдісінде жүретін реакциялар механизмі
Жарықтың әсерінен алтын галогенидтерінің (мысалы, хлориді) ыдырауы фотохимиялық әдіс болып табылады. Бұл ретте үлгінің өңдеуге ұшыраған бөлігі жарықтың әсерінен қараяды және беткі қабатта алтынның бөлшектері түзіледі.
Материалдың беткі қабатын CuCl ерітіндісімен күн сәулесінің әсерінде өңдеген кездесы мыс пластинасы кебуіне байланысты оның беткі қабатында бірте-бірте қара түсті қаптама түзіледі. Осы орайда орын алатын реакция келесі теңдеумен сипатталады:
Алтын хлоридтері үшін фотохимиялық реакцияның жүруін зерттеу AuCl3 тотықсыздандыру үрдісінің жүру ортасына байланысты нанобөлшектер түзілуінің бірнеше сызбаларын төмендегідей сипаттауға болады:
1 AuCl3 тотықсыздандырудың алғашқы механизмін көмірсутектерді фотохимиялық хлорлау кезіндегі үрдісті зерттеуші ШульпинГ.Б. және басқа авторлармен бірге ұсынған болатын. Бұл үрдістің алғашқы сатысында үшвалентті алтын кешені жарықпен қоздырылады:
𝐴𝑢𝐶𝑙3 ℎ𝜈→ 𝐴𝑢𝐶𝑙3. (3)
Au(ІІІ) қоздырылған кешенінің координациялық сферасында кейіннен еріткіш жасушасынан көлеміне өтетін хлор атомының түзілуіне әкеп соғатын СІ-дан Au-ға электрон тасымалдауы бар тотығу-тотықсыздану реакциясы жүруі мүмкін:
𝐴𝑢𝐶𝑙3 → 𝐴𝑢𝐶𝑙2+𝐶𝑙 (4)
2 жұмыста ұсынылған HАuCl4 УК-индуцирленген тотықсыздандыру механизміне сай, Au(ІІІ)Cl4 ионы диспропорциялану реакция нәтижесінде Au (ІІІ) және Au (І) ыдырайтын Au (ІІ) тұрақсыз бивалентті ионына дейін тотықсызданады:
2𝐴𝑢 (𝐼𝐼)→𝐴𝑢(𝐼𝐼𝐼)+𝐴𝑢(𝐼). (5)
Au(І) иондарының тотықсыздануы диспропорциялану реакциясына сай жүруі мүмкін:
3𝐴𝑢 (𝐼)→2𝐴𝑢(0)+𝐴𝑢3+ (6)
Алайда реакция өте баяу түрде жүреді, себебі Au3+ салыстырғанда Au+ иондары концентрациясының төмендігі мен қатар, тотығу-тотықсыздану потенциалының кері мәніменде (-1,4 В) байланысты. Осылайша, Au(І)Cl2 иондары жинақталады және нанобөлшектер кластерлерінің пайда болуынан алдын индукционды период орыналады.
Сипатталған фотохимиялық каталитикалық реакцияны қолдану ерітіндіде жеткілікті түрдегі моно дисперсті таралымы бар өлшемдері бақыланатын (20-80 нм) алтын нано бөлшектерін алуға мүмкіндік берді. Жұмысының авторлары Au (ІІІ) тотықсыздандыру реакциясы алмасу сатысы және кейіннен ОВ дейін өздігінен тотығатын В тотықсыздандырғышы бар кешендер түзу сатыларынан тұратындығын келтіруде:
𝐴𝑢𝐶𝑙4- +𝐵→ 𝐴𝑢𝐶𝑙𝑛𝐵→𝐴𝑢𝐶𝑙2+𝑂𝐵. (7)
AuСІ2 қосылыстарыалтын (І) жәнеалтын (ІІІ) қосылыстарының қоспасы сияқты.
3 Алтын нано бөлшектерінің түзілуіне әсер ететін фотохимиялық тотығу-тотықсыздану реакциялары еріткіштің қатысуынсыз да жүруі мүмкін:
𝐴𝑢𝐶𝑙4- +ℎ𝜈→ 𝐴𝑢𝐶𝑙3-+𝐶𝑙∙. (8)
2𝐴𝑢𝐶𝑙3-→ 𝐴𝑢𝐶𝑙4-+𝐴𝑢𝐶𝑙2- (9)
𝐴𝑢𝐶𝑙2-+ℎ𝜈→ 𝐴𝑢0+𝐶𝑙−+𝐶𝑙∙. (10)
.
2.3 Алтын қабықшаларын фотохимиялық әдіспен диэлектрлі беттерге қондыру және зерттеу
Фотохимиялық реакция диэлектриктің беткі қабатында хлорлы алтын ерітіндісінің сорбциялық қабатында жүреді. Аталмыш жүйеде мүмкін болатын реакцияға алтынның бір валентті иондарының түзілуі жатады.
2Au3+ + 2 H2O =2 Au+ + O2 + 4 H+ (12)
Термодинамикалық тұрғыдан бұр реакция мүмкін, себебі
Au3+ +2e = Au+ Eo = 1.401B, (13)
реакциясының стандартты потенциалы:
O2 + 4 H+ +4e = 2 H2O E0 = 1.229 B. (14)
мына реакцияның стандартты потенциалынан оң.
Қалыпта жағдайларда (1) реакцияның бағыты сол жаққа қарай ығысқан, сондықтан AuCI, оттегі және НCI бөлінуі байқалмайды.
Сорбциялық қабаттың кебуіне қарай AuCI3 концентрациясы ұлғаяды, бұл өз кезегінде үш валентті алтынның тотықтырғыштық қасиеттерін арттырады. Осы орайда аталмыш ортада аз еритін бір валентті алтынның түзілуіне әкелетін реакцияның жүру мүмкіншілігі артады.
Сонымен қатар, сорбциялық қабаттың кристалдану орталығы ретіндегі қатты фазалы беткі қабатпен түйісуі AuCI қатты фазалы қабаттың пайда болуын жеңілдетеді.
Алтынның (І) хлориді жартылай өткізгіштік қасиеттерге ие және сондықтан жарықпен әсер еткенде фотохимиялық реакцияның орын алуы мүмкін болады.
3AuCl →AuCl3 + 2Au(15)
Бұл фотохимиялық реакцияның жүруі 1 реакция тепе-теңдігін ығыстырады және реакцияның жалпы түрі келесідей:
2AuCl3 + 3H2O→ 2Au + 3/2О2 + 6НCl. (16)
2.4 Алтын қаптамасын фотохимиялық әдіспен құрамына алмаз бөлшектерін енгізу арқылы әртүрлі беттерге қондыру және зерттеу
Алмаз-жай заткөміртектіңаллотропиялық түрі, белгілі заттардың ішіндегі ең қаттысы.
19 ғасырдың70 жылдарына дейін ол тек кен қайраңдардан өндірілді. Табиғатта кездесетін алмаз түйіршіктерінің салмағы әдетте 0,1—1,0 караттан аспайды. Салмағы 100 караттан (20 г) астам ірі кристалдары өте сирек кездеседі және оларға жеке ат беріледі. Мысалы,1905ж. Оңтүстік Африкада табылған дүние жүзіндегі ең ірі “Куллинан” Алмасы кристалының массасы 3106 карат (621,2 г) болған. Кейін одан әр түрлі пішінді 105бриллианталынды.
2.2-сурет .Алмаздың кристалл торы

2.3-сурет. Алмаз ұнтағы
Алмазда көміртектің әрбіратомы,көміртектіңбасқа төрт атомымен байланысқан, барлық атомдардың арақашықтығы бірдей. Алмаз онша ірі емескристалдартүріндетау жыныстарынааралас шашыраңқы, кейде жиналыңқы болып кездеседі. Аса қатты болғандықтан түрлі қатты материалдардың бетін өңдеуге, шыныны кесуге, жербұрғылауғатегістегіштер, асыл бұйымдар, тағы басқа жасауға қолданылады. Алмазжарықсәулесін өте күшті сындыратындықтан, түрлі әдемі түс шығарып жарқырай алады, соны күшейту үшін, алмаздың таза дұрыс түзілгенкристалдарын, алмаздың өз ұнтағымен үйкеп өңдейді, мұндай алмаздыгауһардейді, бұл қымбат тастың бірі. Алмас кубтық сингонияда кристалданады.Куб,октаэдр, ромбододекаэдр, тетраэдр, сондай-ақ олардың араласқан түрінде кездеседі.
Алмаздың меншікті салмағы 3,5—4,0 г/см3 қаттылығы 10. Морт сынады, сынған жері бұдыр келеді, электр тогын нашар өткізеді. Түссіз, ақ, көгілдір, жасыл, сарғылт, қоңыр, қызғылт, қара сұр түсті болып келеді. Алмаздың түсі әр түрлі болуы құрамындағы қоспаларға (5%-ке дейін Sі,Al, Ca,Mg, Tі,Co, Cr,Feт.б) байланысты. Бұлардан басқа оның құрамында қатты (оливин, пироксен,гранаттар,хромшпинелидтер,графит,кварц, теміроксидтері т.б.), сұйық (су), газ (азот т.б.) күйіндегі қоспалар да болады. Алмаз қышқылдар мен сілтілер ерітіндісінің әсеріне берік, селитра мен соданың қоспасында 500°С-та ериді.
Алмаздың химиялық құрамы таза көміртегінен тұрады. Егер алмаздың түсі басқа болса, мысалы сары, қоңыр, қара, күңгірт болса, онда оның құрамыдда аралас қоспа тотықтар болғаны. Көбінесе онда кремний тотығы — кварц (Si02) , бірнеше процент, кальцийдің, темірдің және магнийдің тотықтары болады. Қосындысы бар алмазды борт,карбонадодейді.
Алмаз ауада 850—1000°С-та, оттекте 720—800°С-та жанады, вакуумм инертті газда 2000°С-та 15-20 минутта түгелдей графитке айналады. Графит немесе көмір сияқты жұмсақ тектестерімен салыстырғандағы алмастың орасан қаттылығына оны құрайтын көміртек атомдары арасындағы өте берік ковалентті байланыс себепші болады. Алмаз үлкен тереңдікте, жоғарғы мантия аумағындағы зор температура мен қысым әсерінен пайда болады. Ол қопарылыс түтіктерін толтыратын кимберлит құрамында кездеседі. Басқаша айтқанда қопарылыс түтіктері алмас кендерін іздестірудің негізгі сілтемесі болып табылады. Сапасына және нарықтық сұранысқа байланысты алмаз кристалдары зергерлік алмаз және техникалық алмаз болып ажыратылады. Зергерлік алмаз мөлдір, ақаусыз (қуыссыз, жарықшасыз, сызатсыз), қоспасыз, аса берік болуы шарт.Өйткені ол- әсемдік бұйымы болумен бірге капитал сақтаудың сенімді тәсілі. Техникалық алмаз ұнтақ немесе тиісті пішінге келтірілген кристалдар түрінде қолданылады.
1990-1995 жылдары дүние жүзінде 100 млн. карат алмас өндірілді. Оның ішіндегі жоғары сапалы зергерлік алмазтың үлесі 15%, жартылай асыл түрі 40%, абразив материал ретінде қолданылатын техникалық алмаз 45% болды. Жылдық тұтынудың үнемі 10%-ке өсіп отыруына байланысты 20ғ-дың 50-жылдарынан бастап жасанды (синтетикалық) алмаз өндірісі (жылына 250 млн. карат) жолға қойылған.
2.5 Алынған нәтижелерді талдау
Жұмыс химияның маңызды бағыттардың бірі болып саналатын алтын құрамды қаптамаларды фотохимиялық әдіспен алу үрдісін зерттеуге бағытталған. Фотохимиялық әдіс бойынша алынатын қаптаманың қабаты өте жұқа болғанымен, олар осы металдардың пайдалы қасиеттерін сақтай отырып, кейбір кезде күшейтуі де мүмкін. Осыған байланысты наноөлшемді қаптамаларын катализаторлар өндірісінде, бактерицидті бұйымдар алуға қолдануы ғылыми-техникалық әдебиеттерде жиі кездеседі.
4 Тіршілік қауіпсіздігі және қоршаған ортаны қорғау
Адам әр кезде де табиғатпен тығыз байланыста өмір сүреді, оның байлықтарын пайдаланады және өз қызметі арқылытабиғатқаәсер етеді. Адамның табиғатқа әсері зиянды салдар тудыруы мүмкін. Мемлекет әрқашандатабиғи ортаныосындай зиянды әрекеттерден қорғау үшін белгілі бір құқықтық ережелер шығарады. Табиғи ортаны адамның зиянды әрекеттерінен қорғауға бағытталған нормалардың (ережелердің) жиынтығы экологиялық құқықдеп аталады. Адамның табиғатқа зиянды әсерінің салдарынан XX ғасырдың ортасында әлемдегі экологиялық жағдай күрт төмендеп кетті. Экологиялық жағдайдың нашарлағаны соншалық, бүгінде ол әлемнің кейбір аймақтарында адамның тұрмыс тіршілігімен коса оның өмірі үшін де үлкен қатер тудырып отыр.
4.1 Гальваникалық цехтың ағызынды суларының құрамы.
Құрамында цианит пен хромит жоқ электролитті қаптамаларды қондыру процесінен, майсыздандыру, уландыру мен қышқылды белсендендіргеннен кейінгі өңделген электролиттер мен жуылған сулар тазалаудан алдын араласып, қышқылды, сілтілі, ауыр металл иондары бар ағызынды су болады. Гальваникалық цехтың ағызынды суларының құрамы келесі ауыр металл катиондары: Fe2+, Fe3+,Сu2+, Zn2+, Ni2+, Cd2+және т.б.
Сілтілі сулар жоғары рН 10-12 пен сипатталады. Қышқыл сулар қышқылмен ластанған ( рН 2-5). Ауыр металл иондарының концентрациясы Fe2+ және Fe3+үшін 1,5 г/л-ге дейін жетеді, Сu2+,Ni2+ үшін 100 мг/л- ге жетеді.
Түрлі технологиялық саланың ағынды араласқанда қосымша бөлшектенген бейтарапталуға дейін жетеді. Ағызынды суларды кәріздеріне төгу үшін рН ортаны рұқсат етілген нормативті- техникалық құжат бойынша 6,5-8,5 аралында етіп туралайды. Қышқыл- сілтілі ағызындарды тазалау және бейтараптау ауыр металл иондары реагенттерімен ионалмасу және электрохимиялық әдіспен жүзеге асырылады.
Электрохимиялықөңдеуден өткен ағызынды суларға сілті реагенттерін қосу арқылы хром (ІІІ) иондарын аз еритін хром(ІІІ) гидроксиді тұнбасына өткізу арқылы ерітінді құрамынан сүзгі қағазда бөліп алады.
Ағызынды суларды хром (VІ) иондарынан электрохимиялық тәсілмен тазалау кезінде, залалсыздандыру процесін анықтайтын тазалану дәрежесіне (a,%) негізгі электрохимиялық параметрлердің: ток тығыздығы (і, А/м2),электролиз ұзақтығы (t, сағ), ерітінді құрамының қышқылдылық ортасы (рН), ерітіндідегі хром иондары концентрациясының (C, г/л) әсерлері қарастырылған.
Өндірістерден шыққан оның ішінде гальваникалықөндіріс ағызынды сулары құрамында көптеген ауыр метал иондары кездеседі, соның ішінде хромның концентрациясы -0,2 г/л -ге дейін кездесетіндіктен, зерттеулерде хром ангидридінен CrO3 метал ионының концентрациясы -0,2 г/л ге тең мөлшерде болатын модельді жұмысшы ерітіндісі дайындалды.
Зерттелінетін модельденген ерітіндінің электрөкізгіштігін жоғарылату үшін және темір түйіршіктерінің пассивтенуін тежеу үшін электролитке 10 г/л Na2SO4 және 0,5 г/л KСl қосылды.
Тотықсыздануды жоғары дәрежеде жүргізу үшін ерітінді қышқыл ортасының рН мәнін 2,5-ге дейін күкірт қышқылы ертіндісін қосу арқылы жеткізілді.Электролизден кейін Cr(VІ) иондары Cr(ІІІ) иондарын тотықсызданғаннан соңерітіндіден оларды натрий гидроксидінің ерітіндісін қосу арқылы бейтараптап, электролит құрамынан гидроксид түрінде толық тұнбаға түсіріп, тұнбаны сүзу арқылы ерітіндіден бөліп алынды.Фильтрат құрамындағы тазаланбай қалған Cr(VІ) иондарының мөлшері фотоколориметрлік әдіс арқылы анықталынып, математикалық жолмен тазалану дәрежесі есептелінді.
a= 
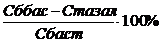 (1)
(1)
Зерттеу жұмысында түйіршікті электродтар қолданғандықтан, электродтардағы ток тығыздығын дәл өлшеп, есептеу біршама қиындықтар туғызды. Сондықтан, электрод ток тығыздығын анықтауда біз нақты ток тығыздығының орнына, салыстырмалы шама - келтірілген көлемдік ток тығыздығы қолданылды. Бұл шаманы қолдану, электрод бетіндегі жүріп жатқан процестердің кинетикасын анықтауда, классикалық жазық электродтармен салыстырғанда түйіршікті электродтардың беттік ауданынының жоғары болуымен сипатталады.
Біздің зерттеу жұмысында, жазық темір электродтарының орнына түйіршікті темір электродтарын тұрақты токпен поляризациялап тазалау процесін жүргізгенде жоғарғы айтылған жағдайларда(i=200А/м2,τ=0,5 сағ., CCr=0,2 г/л, рН=2,5) тазалану дәрежесі айтарлықтай жоғарылап 99,95% -ға жетті.
Бұл алынған мәліметтерден түйіршікті темір электродтарын электрокоагуляторларда қолдану ағызынды сулар мен қолданылған ерітінділер құрамындағы ауыр және түсті метал иондарын тазалауда қолдану жоғары тиімділікке жетуге болатындығын көреміз.
Электрокоагуляция процесі негізінен рН қышқыл мәндерінде жақсы жүретіндіктен ағызынды суларды арнай қышқылдауды қажет етеді. Ал әлсіз қышқыл және бейтарап орталарда темір электродының еру ток шығымы төмен болғандықтан электрокоагуляция процесі нашар жүреді.
Өндірістен шығатын сулардың рН мәндері бейтарап ортаға жақын болғандықтан, осы ағызынды суларды қосымша қышқыл қоспай ақ электрокоагуляция процесін жүргізу, қазіргі күннің ағызынды суларды залалсыздандыру тәсілдері бойынша негізгі мәселелерінің бірі болып табылады.
Айнымалы ток көмегімен бейтарап ортада темір электродын айтарлықтай жоғары ток бойынша шығыммен ерітуге болатындығын профессор Ә. Баешов пен оның қызметкерлерінің жұмыстарында зерттелген. Осы құбылысты құрамында ауыр метал иондары бар ағызынды суларды электрокоагуляция процесімен тазалауда қолдануға болады деп жорамалдауға болады.
4.1- суретте келтірілгенэлектрокоагулятор қондырғысын тұрақты ток көзінің орнына айнымалы ток көзіне жалғап, сол электролиз жағдайын сақтап ағызынды суларды залалсыздандырғанда, жоғарғы тазалану дәрежесін рН мәні 3,5-4,7 аралықтарына дейін алуға болатындығы анықталды.
Айнымалы токпен полияризцияланған түйіршікті темір электродтарының жұбының бірі ретінде титан сым электродын қолдану, ерітінді қышқыл ортасының рН мәнін 5,0-5,6-ға, яғыни әлсіз қышқыл және бейтарап ортаға жақын ағызынды суларды залалсыздандыруға болатындығын көрсетті.
Ағызынды суларды бұл электрокоагуляция процесімен бейтарап ортада залалсыздандыру процесін интенсивтендіру үшін, айнымалы және тұрақты токтарды бір мезгілде тазалау процесінде титан сым электродымен жұптастырып қолдану (3.1сурет) айтарлықтай дұрыс оң шешімін беретіндігін көрсетті.
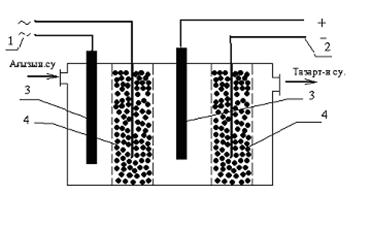
Белгіленуі: 1-Айнымалы ток; 2-тұрақты ток көзі; 3- электродтар; 4-тұйіршікті темір электроды.
4.1-сурет.Электрокоагулятор қондырғысы
4.2 Бейтараптау әдісімен сұйық қалдықтарды тазалау.
Құрамында қышқылдар немесе сілтілер бар ағынды суларды су сыйымдылықтарына лақтыру алдында немесе технологиялық процесстерде қолдану үшін нейтрализациялайды. Нейтралды рН = 6,5 – 8,5 не суларды айтады.
Нейтрализацияны әртүрлі жолдармен жүргізуге болады: қышқылды және сілтілі ағынды суларды араластырумен, реагенттер қосумен, нейтралдаушы материалдар арқылы, қышқылды суларды фильтрлеумен сілтілі сулар қышқылды газдар абсорбициясымен, немесе қышқылды суларды аммиак абсорбиясымен.
Бейтараптау әдісін таңдау ағынды сулардың көлеміне және концетрациясына, олардың келіп түсу режіміне және реагенттің бағасына байланысты. Бейтараптау процессі кезінде тұнба түзілуі мүмкін, оның мөлшері ағынды судың құрамына және концентрациясына байланысты, сонымен бірге қолданылатын реагенттердің түрі мен шығынына да байланысты.
4.3 Ағызынды суларды тотығу – тотықсыздану әдісімен тазалау.
Ағынды суларды тазалау үшін келесі тотықтар қолданылады: Газ тәріздес және сығылған хлор, диоксид, кальций хлораты, кальций және натрий гипохлориді, калий перманганаты, калий бихроматы, сутегі пероксиді, ауа оттегісі, пероксокүкіртті қышқыл, озон, пиролюзит және т.б.
Тотықтыру процессі кезінде ағынды сулардағы уландырғыш ластаушылар, химиялық реакция нәтижесінде аз уландырғышқа өтеді, сосын оларды судан алып тастайды.
Тотықтырғыштармен тазалау үлкен реагенттер шығынымен сипатталады, сондықтан оны басқа әдіспен алуға болмайтын жағдайда ғана қолданады.
Мысалыға цианидтерден тазалау, мышьяк, қосылыстарынан тазалау және т.б.
Тотықтырғыш есебіндегі активтілігі тотықтырғыш потенциалының шамасымен анықталады. Табиғаттағы барлық белгілі тотықтырғыштардың ішінен бірінші орынды фтор алады, бірақта ол өзінің агрессивтілігіне байланысты пратикадакөп қолданылмайды.
4.4 Ағызынды суларды хлормен тотықтыру.
Хлор және құрамында «активті» хлор бар заттар, ең көп тараған тотықтырғыштар болып келеді. Оларды, ағынды суды күкіртсутектен, гидросульфиттен, метилкүкіртті қосылыстардан, фенолдардан, цианидтерден және т.б. тазалау үшін қолданады.
Хлорды суға қосқанда хлорлылау [сутегі оксохлораты (І)] және тұз [хлорсутекті] қышқылы түзіледі:
Cl2 + H2O = HOCl + HCl (2)
Әрі қарай хлорлылау қышқылдың диссоциациясы жүреді, оның дәрежесі рН ортаға байланысты. рН = 4 кезде молекулярлы хлор болмайды:
HOCl ↔ H+ + OCl- (3)
Cl2 + HOCl + OCl- жиынтығы, бос «активті» хлор деп аталады. Егер суда аммоним қосылыстар болса хлорлылау қышқыл хлорамин NH2 Cl және дихлорамин NHCl2 пайда болады. Хлорамин түріндегі хлор, байланған «активті» хлор деп аталады.
Суларды цианидтерден тазалаған кезде процессті сілтілі ортада (рН=9) жүргізеді. Цианидтерді азотқа және көміртегі дейін келесі теңдік бойынша тотықтыруға болады:
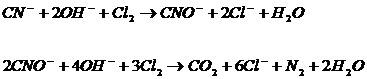 (4)
(4)
(5)
«Активті» хлордың (ретінде) қайнар көзі кальций хлораты, гипохлорий, хлораты, хлор диоксиді болуы мүмкін. Кальций хлоратын былай алады:
 (6)
(6)
Сілтілі ерітінді арқылы газ тәріздес хлорды өткізгенде натрий гипохлориті (оксохлорат) пайда болады.
Кальций гипохлоритин температура 25-300С кезінде кальций гидроксидін хлорлау арқылы дайындайды.
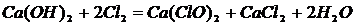 (7)
(7)
Өндіріс екі негізгі тұзды шығарады
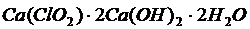 (8)
(8)
Натрий хлораты NaCl2 күшті толық болып табылады, ол ClO2-ң бөлінуінен ыдырап кетеді. Хлор диоксиді жасымдау сары ұлы газ, оның хлорға қарағанда иісі қанығырақ. Оны алу үшін келісі реакцияларды жүргізеді:
2NaCl2+4HCl→2ClO2+2NaCl (9)
5NaClO2+4HCl→5NaCl+4ClO2+2H2O (10)
Цианиттерді «активті» хлормен тотықтыру кезінде процессті бір санында цианаттарды алғанына жүргізуге болады:
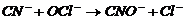 (11)
(11)
Цианиттердің цианаттарға дейін тотығыуы атомды оттегінің тотықтырғыштан бөліну кезінде жүзеге асады.
Пайда болған цианаттар карбанаттарға дейін жеңіл гидролизденеді:
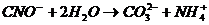 (12)
(12)
гидролиз жылдамдығы рН ортаға байланысты. рН = 5,3 кезде бір тәуілікте.
4.5 Ионалмасу әдісінің гальванотехника өндірісінің ағызынды суларын тазалауда қолданылуы.
Гальванотехника өндірісінде қолданылу аймағы. 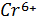 -ның концентрациясы 300г/л және хлорид иондары 50 г/л-дан аспайтын құрамында хромы бар ағызынды суларды тазалау үшін ион алмасу әдісі қолданылады. Сонымен қатар, жұмысқа жарамсыз құрамында хромы бар электролиттерді қайта қолдану мүмкіндігін туғызады.
-ның концентрациясы 300г/л және хлорид иондары 50 г/л-дан аспайтын құрамында хромы бар ағызынды суларды тазалау үшін ион алмасу әдісі қолданылады. Сонымен қатар, жұмысқа жарамсыз құрамында хромы бар электролиттерді қайта қолдану мүмкіндігін туғызады.
Негізгі процестер. Құрамында хромы бар ағызынды суды өңдеу схема бойынша жүзеге асады. Құрамында Cr6+, Cr3+, Fe2+ бар ерітіндіні иондау әдісімен тазалағанда, процесті катион арқылы Н-формада Н+ ионын сүзу арқылы жүзеге асырады.
Катиондардың ластануынан тазарған ағызынды су аниондауға жіберіледі. Элюаттан химиялық және физика-химиялық әдістермен, өнеркәсіпте оларды жою үшін, ауыр металдар қоспалары бөлініп алынады. Ауыр металдар ионынан тазартылған су ары қарай тазартылуға жіберіледі.
Катиониттер үздіксіз 5-10%-ті H2SO4 ерітіндісімен оларды Н-формасына өткізу үшін өңделеді, ал ауыр металдар иондары – тез еритін тұз ерітінділеріне ауысады.
H2CrO4 аниондарын иондау ОН-формада аниониттерді фильтрлеу арқылы жүзеге асады. Анионирленген ағызынды су гальваника өндірісінде қайталану циклдеуінде қолданылады.
Құрамында Na2CrO4 бар алюатты сілтілі ортада, катионитті Н-формада 4-6%-ті Н2CrO4 ерітіндісін өңдейді, бұл ерітіндіні қайтадан хромдау процесінде қолдануға болады. Аниониттер 4%-ті NaOH ерітіндісінде өңделеді, содан кейін хроматты сульфат ионының формасын өзгерту үшін ОН-формасының активтілігін жоғарылату мақсатында H2SO4 1-2% ерітіндісімен жуады.
Қышқыл және негіз ағызынды сулар иониттерден тазартылғаннан кейін, катиониттер H-формасына, аниониттер OH-формасына өтіп, минералдардан толық тазартылып қайта қолдануға жіберіледі.
4.6 Циян құрамды ағызынды суларды тазалау.
Циянқұрамды ағызынды суларды майсыздандыру үшін регагентті әдістің модификациясын қолданады, жоғары улылы цианиттердің усыздандыру тез жойылатын өнімдерді химиялық айналдыруға негізделген. Активті тотықтыру үшін мына әдіс қолданылады.Cl, KMnO4 H2O2, O3, O2. Активті хлоры бар реагенттермен тотықтыру.
Қолдану аймағы
Әртүрлі көлем мен концентрация арқылы цианқұрамды ағызынды суларды залалсыздандыру.
Негізгі процестер: Реагент құрамына қолданады: CaOCl2 гипохлорид, Ca(OCl)2 және NaOCl, сұйық Cl2. Жоғары улы цианиттер гипохлоридке айналып мың есе улылығы азайып корбанат және аммонийға дейін гидролизденеді.
CN-+OCl→CNO+Cl-(14)
[Zn(CN)4]2-+4OCl+H2O→4CNO+4Cl-+Zn(OH)2 (15)
2[Cu(CN)4+7OCl+H2O+2OH-→6CNO-+7Cl-+2Cu(OH)2(16)
 Сұйық хлормен тотыққанда келесі реакция жүреді.
Сұйық хлормен тотыққанда келесі реакция жүреді.
CN+Cl2+2OH→CNO+2Cl+H2O(17)
[Cu(CN)3]2-+4Cl2+8OH-→3CNO-+8Cl+Cu(OH)2↓+3H2O(18 )
Жай тотығу реакциясы және комплексті цианаттер активті хлормен сілтілі ортада өтеді. (pH 10,5-12,0). Цианат ионы CNO- гидролизденеді (pH£ 6,5).
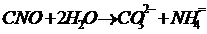 (19)
(19)
Реакция кезінде гипохлорид ионы артық мөлшерде өтеді:
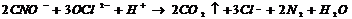 (20)
(20)
Улы хлор цианды жою үшін мына реакция жүреді
Сl2 +H2O®HCl + HOCl (21)
2CN + Cl2®2ClCN (22)
HCL жою үшін, сілтініжою үшін сілтінің қысымымен бейтараптау қажет. Ағызынды суды активті хлормен араластыру механикалық немесе гидравликалық жолымен 3-5мин құрайды.
Құрал жабдықтар. Тазартудың технологиялық схемасы периюдты немесе үздіксіз әрекеттік болуы мүмкін. Перюдты схема бойынша ағызынды суларды тазалау жинағышқа құйылады. Бұл жерден үздіксіз араласып, реакторға беріледі. Бұл араластырулардағы құрылғылар pH ортасына дейін талап ететін берілу реагенттерінің автоматты реттеуіне құрылған, залалсыздандырылғаннан кейін ағызынды суларды бейтараптандырумен тұндырып, тазаланатын құрылғыға алып келеді.
4.6 Ағызынды суды үздіксіздік схемасы бойынша тазалау.
Ағызынды суды үздіксіздік схемасы бойынша тазалау орталандырғыш арқылы реактордың камерасына түседі. Бұл жерге автоматты құрылғының көмегімен ортаның pH оптималды мәніне дейін қажетті реагенттер және активтелген хлор ерітіндісі беріледі. Ары қарай ағызынды су бейтараптандырылуға қышқыл сілтілі ағынмен қосарлана тазаланады.
Артықшылығы. ШМК ға дейін залалсыздандыру. Қолдауда қарапайымдылығы мен кемшіліктері.
Тұз құрамының жоғары болуына байланысты су қайта қолданысқа енбейді. Жоғары реагентті шаруашылық және үлкен көлемді жер қажет етіледі. Реактивтер үлкен шығынға ұшырайды.
Калий перманганатының тотығуы.
Қолдану аймағы. Кез келген концентрациядағы өңделген электролит кіші көлемде залалсыздандырады.
Негізгі процестер. Калий перманганаты цианиттерге дейін тотығады және соңғы есепте күкірт диоксиді және азотқа дейін.
3CN-+2MnO4-+H2O→3CNO+2MnO2↓+2OH- (23)
3[Cu(CN)3]2-+7MnO4+5H2O→9CNO+7MnO2↓+3Cu(OH)2↓+4OH- (24)
Оптималды рН ≥7 .
Реакцияның тура мәніндегі ортасы қажет емес.
Құрал жабдықтар. Реагентті әдістегі периодты қозғалыстағы қондырғы қолданылады.
Артықшылығы. Кез келген концентрациясы бар ағызынды суды жоғары дәрежеде тазалайды. Тазаланған суды қайта қолдану мүмкіндігі бар. Тұнбаның мөлшері көп емес.Кемшілігі, калий перманганаты бағасының қымбаттылығы. Судан улы марганец оксидін толық жою қажет.
Қорытынды
Фотохимиялық алтындаудаалмаз бөлшектерін енгізукурстық жұмыста алтын маңызы бар қосылыстарының физика-химиялық қасиеттеріне шолу жасалынып, аталған металл қаптамасының қасиеттеріндегі ерекшеліктері көрсетілді, оларды алу жолдарының мәселелері анықталды. Металл емес заттарды металдандырудың әдіс-тәсілдері қарастырылды. Металдандырудың химиялық әдісінде жүретін ыдырау және тотықсыздандыру реакциялары қарастырылып, беткі қабатта жүретін негізгі үрдістер - химиялық алтындау үрдісінің ерекшеліктері айқындалды. Диэлектрлі беттерді заманауи химиялық және фотохимиялық жолмен металдандырудың белгілі әдістеріне шолу жасалынды.
Металл емес заттарды металдандырудың басты мақсаты жаңа материалдар алу және бұйымдарға жаңа қасиеттер – функционалдылық (тоқ және жылу өткізгіштік, жарық немесе радио толқындарды сіңіру және шағылту, беріктік және тозуға төзімділік) немесе сәндік (металдың немесе конверсионды қаптамасы бар металдың түрі) беру болып табыладығын, металл емес материалдарды металдандыру үрдісін бұйымдар (ерітіндіге батыру) немесе арнайы қондырғылар мен іс-әрекеттерді жүзеге асыруға қажетті тәсілдерді талап ететін ленталар, жіптер және ұнтақтар түрінде іске асырадығын іс жүзінде байқап тәжірибелер арқылы көз жеткіздік.
Пайдаланылған әдебиеттер тізімі
1 Ажогин Ф.Ф., Беленький М.А., Галль И.Е. Гальванотехика. Справочник. - М.: Металлургия, 1987. - 736 с.
2 Утелбаева А., Утелбаев Б. Жалпы және бейорганикалық химия. - Алматы: Қазақ–Британ техникалық университеті, 2006. - 370 б.
3 Сыркин В.Г. Химическая парофазная металлизация. - М.: Наука, 2000. -496 с.
4 Kaim W., Schwederski B., Klein A. Bioinorganic Chemistry: Inorganic Elements in the Chemistry of Life. 2nd Edition. - Wiley, 2013. - 425 p.
5 Гринвуд Н., Эрншо А. Химия элементов: в 2 т. - М.: Бином, 2008. – Т. 1. - 607 с.
6 Третьяков Ю.Д. Неорганическая химия. Химия элементов. - М.: Химия, 2001. - 472 с.
7 Довбыш С.А., Оствальд Г.В. Химия элементов. Учебно-методическое пособие. - Барнаул: РИО Алтайского ГАУ, 2016. - 123 с.
8 Лебедева М.И., Анкудимова И.А., Свиряева М.А. Химия элементов. - Тамбов: Изд-во ФГБОУ ВПО «ТГТУ», 2014. -133 с.
9 Greenwood N.N., Earnshaw A. Chemistry of the Elements. Second Edition. - Butterworth-Heinemann, 1997. - 1359 p.
10 Буркат Г.К. Электроосаждение драгоценных металлов. - Санкт-Петербург: Политехника, 2009. - 188 с.
11 Шалкаускас М.И., Вашкялис А.И. Химическая металлизация пластмасс. - Л: Химия, 1985. - 144 с.
12 Мелащенко Н.Ф. Гальванические покрытия диэлектриков: справочник. - Минск: Изд-во "Беларусь", 1987. - 176 с.
13 Hajdu J., Kurlik G. // Plat and Surface Finish. - 1983. - Vol. 70, № 7. - P. 42-44.
14 Гамбург Ю.Д. Гальванические покрытия. Справочник по применении. - М.: Техносфера, 2006. – 216 с.
15 Грилихес С.Я., Тихонов К.И. Электролитические и химические покрытия. Теория и практика. - Л.: Химия, 1990. - 288 c.
16 Ямпольский А.М. Меднение и никелирование. - Изд. 4-е, доп. и перераб. - Л.: "Машиностроение" (Ленингр. отд-ние), 1977. - 112 с.
17 Вансовская К.М. Металлические покрытия, нанесенные химическим способом. - Л.: Машиностроение, 1985. - 103 с.
18 Никандрова Л.И. Химические способы получения металлических покрытий / под ред. Вячеславова П.М. - Л.: Машиностроение, 1971. - 104 с.
19 Кудрявцев Н.Т. Электролитические покрытия металлами. - М.: Химия, 1979. - 352 с.
20 Беленький М.А. Иванов А.Ф. Электроосаждение металлических покрытий. - М.: Металлургия, 1985. - 288 с.
Дата добавления: 2018-06-01; просмотров: 1142; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
