Принцип Паули. Распределение электронов по состояниям.
Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Отсюда следует, что два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, т.к. для фермионов волновая функция должна быть антисимметричной. Обобщая опытные данные, В. Паули сформировал принцип исключения, согласно которому системы фермионов встречаются в природе только в состояниях, описываемых антисимметричными волновыми функциями (квантово-механическая формулировка принципа Паули).
Паули Вольфганг (1900–1958) – физик-теоретик. Работы относятся ко многим разделам современной теоретической физики, в развитии которых он принимал непосредственное участие, в частности квантовой механике, квантовой электродинамике, теории относительности, квантовой теории поля, ядерной физике, физике элементарных частиц.
Из этого положения вытекает более простая формулировка принципа Паули, которая и была введена им в квантовую теорию (1925 г.) еще до построения квантовой механики: в системе одинаковых фермионов любые два из них не могут одновременно находиться в одном и том же состоянии. Отметим, что число одинаковых бозонов, находящихся в одном и том же состоянии, не лимитируется.
Напомним, что состояние электрона в атоме однозначно определяется набором четырех квантовых чисел:
· главного n (n = K, L, N, M);
|
|
|
· орбитального l(l=s, pd, f, …),обычно эти состояния обозначают 1s, 2d, 3f;
· магнитного m (m=0, ±1, ±2, … ±l);
· магнитного спинового  (
(  ).
).
Распределение электронов в атоме происходит по принципу Паули, который может быть сформулирован для атома в простейшем виде: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел: n, l, m,  :
:
Z (n, l,m,  ) = 0 или 1,
) = 0 или 1,
где Z (n, l,m,  ) - число электронов, находящихся в квантовом состоянии, описываемых набором четырех квантовых чисел: n, l,m,
) - число электронов, находящихся в квантовом состоянии, описываемых набором четырех квантовых чисел: n, l,m,  . Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме различаются значениями, по крайней мере, одного квантового числа.
. Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме различаются значениями, по крайней мере, одного квантового числа.
Максимальное число  (n, l,
(n, l,  ) электронов, находящихся в состояниях, описываемых набором трех квантовых чисел n, l,
) электронов, находящихся в состояниях, описываемых набором трех квантовых чисел n, l,  и отличающихся только ориентацией спинов электронов равно:
и отличающихся только ориентацией спинов электронов равно:
 (n, l,m) = 2, (8.2.1)
(n, l,m) = 2, (8.2.1)
ибо спиновое квантовое число может принимать лишь два значения 1/2 и –1/2.
Максимальное 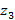 (n, l) числоэлектронов, находящихся в состояниях, определяемых двумя квантовыми числами n и l:
(n, l) числоэлектронов, находящихся в состояниях, определяемых двумя квантовыми числами n и l:
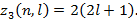 (8.2.2)
(8.2.2)
Максимальное число электронов, находящихся в состояниях, определяемых значением главного квантового числа n, равно:
|
|
|
 (8.2.3)
(8.2.3)
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называется электронной оболочкой или слоем.
В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l.
Область пространства, в которой высока вероятность обнаружить электрон, называют подоболочкой или орбиталью.
Обозначения оболочек, а также распределение электронов по оболочкам и подоболочкам приведено в табл.
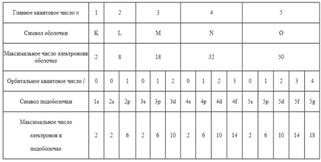
33.
Дата добавления: 2018-06-27; просмотров: 311; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
