Небілкові органічні сполуки плазми крові
РОЗДІЛ 12. БІОХІМІЯ КРОВІ
Функції крові
Кров – рідка спеціалізована тканина організму, що рухається в замкненій cистемі кровоносних судин, забезпечує в межах організму інтеграцію біохімічних процесів і разом з лімфою та міжклітинним простором становить внутрішнє середовище організму. Загальна кількість крові в організмі дорослої людини становить в середньому 7 % від маси тіла, тобто в людини масою 70 кг міститься приблизно 5 л крові.
При центрифугуванні кров розділяється на рідку частину — плазму (55 – 60 % від об'єму всієї крові) та формені елементи - еритроцити, лейкоцити, тромбоцити (40 – 45 %).
Завдяки скороченню серця кров циркулює по кровоносних судинах, виконуючи при цьому низку важливих функцій:
трофічна функція –плазма крові забезпечує міжорганне перенесення поживних речовин (вуглеводів, ліпідів, амінокислот, нуклеотидів, продуктів їх метаболізму, вітамінів) до клітин, де вони використовуються в катаболічних та анаболічних процесах;
видільна (екскреторна) функція – за допомогою плазми крові забезпечується транспортування до органів виділення (нирок, легенів, кишок, шкіри) кінцевих метаболітів обміну речовин (сечовини, сечової кислоти, амонійних солей, білірубіну тощо) і продуктів біотрансформації чужорідних органічних сполук (лікарських токсичних речовин та інших ксенобіотиків);
захисна функція – різні типи лейкоцитів, імуноглобуліни і плазма крові за допомогою складної системи ферментів та специфічних білків забезпечують широкий спектр захисних реакцій, протидіючи порушенню гомеостазу, зокрема проникненню у внутрішнє середовище організму чужорідних для нього білків та інших макромолекул. Особливе значення серед біохімічних компонентів, які реалізують захисну функцію крові, мають білки згортальної та фібринолітичної систем, що забезпечують як захист організму від крововтрат у випадку порушення цілісності судин, так і протидіють її коагуляції, тромбоутворенню всередині кров'яного русла;
|
|
|
регуляторна функція - реалізується за допомогою гормонів та інших біорегуляторів, які секретуються в кров ендокринними залозами та клітинами, і за допомогою специфічних транспортних білків плазми крові переносяться у відповідні органи-мішені. Регуляторна функція крові виявляється також у підтриманні кислотно-лужного та водно-сольового балансу, осмотичного тиску міжклітинної рідини та участі в регуляції температури тіла;
пластична функція крові - транспорт пластичних (амінокислот, нуклеозидів, вітамінів, мінеральних речовин) та енергетичних (глюкоза, жири) ресурсів до тканин;
секреторна функція - секреція клітинами крові біологічно активних речовин.
|
|
|
терморегуляторна функція – кров збільшує витрату тепла організмом у разі перегрівання та, навпаки, збереження тепла при зниженні температури навколишнього середовища, змінюючи інтенсивність кровоплину в шкірі, підшкірній жировій клітковині, м'язах і внутрішніх органах.
12.1.1. Дихальна функція еритроцитів. У стані спокою за 1 хвилину тканини та органи людини використовують приблизно 200 мл кисню, а під час фізичного навантаження потреба тканин у кисні зростає до 2 – 3 л/хв. Оскільки кисень погано розчиняється у воді та плазмі крові, то у вигляді газу він не може поступати в тканини та органи. Функцію переносника кисню в організмі виконує гемоглобін, який входить до складу еритроцитів.
Еритроцити – високоспеціалізовані клітини крові, які переносять кисень від легенів до тканин, а з тканин до альвеол легенів - діоксид вуглецю, який утворюється під час метаболізму. У нормі в 1 мкл крові чоловіків міститься 4,0 - 5,0 млн, у жінок - 3,9 - 4,7 млн еритроцитів (або 4,0 1012 – 5,0·1012 та 3,9·1012 – 4,7·1012 в 1 л крові відповідно), кожної доби оновлюється приблизно 1 % цієї кількості клітин. Це без'ядерні, дископодібні, з обох боків увігнуті клітини діаметром 7,2 – 7,5 мкм і площею поверхні – близько 145 мкм2. Мембрана еритроцита складається з двох шарів фосфоліпідів, ззовні та всередині яких розташовуються білки. Вона практично непроникна для катіонів і добре проникна для аніонів, газів, Н+ та ОН-. Еритроцити людини містять 57 – 68 % води і 32 – 43 % сухого залишку. З неорганічних речовин в еритроциті багато калію, переважно у вигляді КС1 і КНСОз і заліза. Основним білком еритроцита є гемоглобін, який становить 95,5 % від всіх органічних речовин цієї клітини, або 40 % її маси. Крім гемоглобіну, до складу еритроцита (до 5 %) входять негемінові білки, в тому числі ферменти, пептиди (глутатіон), вуглеводи (глюкоза) і ліпіди. З ліпідів переважають лецитин і холестерин.
|
|
|
Еритроцити характеризуються також високим умістом різних коферментів (НАД, НАДФ, ТПФ) і макроергічних сполук (АТФ), що свідчить про їх високу біологічну активність. Це підтверджується також наявністю в еритроцитах комплексу ферментів гліколізу, пентозофосфатного циклу і трансамінування, а також карбоангідрази, каталази, оксидоредуктаз, холінестерази, пептидгідролази та інших. Характерною особливістю еритроцитів є наявність 2,3-дифосфогліцеринової кислоти (2,3-ДФГК), що становить більше половини загальних фосфатів цих клітин. На її синтез і підтримку сталості концентрації витрачається приблизно 90 % глюкози клітини. Вважають, що функція 2,3-ДФГК полягає в регуляції спорідненості гемоглобіну до кисню, яка зменшується внаслідок з'єднання 2,3-ДФГК з трьома-ланцюгами оксигемоглобіну, завдяки чому полегшується вивільнення кисню з оксигемоглобіну (деоксигенація) і перехід його в тканини.
|
|
|
Гемоглобін
12.2.1. Будова гемоглобіну. Основною складовою еритроцита, що забезпечує дихальну функцію крові. є гемоглобін. (молекулярна маса - 66 000 – 68 000 Да). Він є сполукою гему з білком глобіном, який має чотири субодиниці. Кожен поліпептидний ланцюг (або субодиниця) позначаються літерами. У гемоглобіні дорослої людини (НbА) ці ланцюги називаються альфа (α) і бета (β). Кожна молекула НbА містить по два α- і два β-ланцюги. Вони відрізняються первинною структурою і довжиною поліпептидного ланцюга: α- ланцюг містить 141 амінокислотний залишок, β-ланцюг – 146. Їх вторинні структури представлені спіральними сегментами різної довжини: в α-ланцюгах сім спіральних сегментів; а у β – вісім. Спіральні сегменти позначені латинськими буквами (А, В, С, D, E, F, G, H). Третинні структури α- і β-ланцюгів подібні. Всередині кожного ланцюга є гідрофобна "кишеня", в якій розміщений гем. Останній міцно утримується в цій "кишені" за рахунок ван-дер-ваальсових зв'язків між неполярними ділянками гему і гідрофобними радикалами амінокислот (цих зв'язків біля 60). Залишки пропіонової кислоти гему утворюють один-два додаткові зв'язки з білком. Однак глобін зв'язаний не тільки з порфіриновим кільцем гему, але й з атомом заліза. Залізо зв'язується з імідазольним кільцем гістидину - це п'ятий координаційний зв'язок заліза з азотом бічного радикалу гістидину (чотири зв'язки заліза витрачаються на сполучення з пірольними кільцями протопорфірину ІХ). Шостий координаційний зв'язок заліза вільний і використовується для зв'язування кисню або інших лігандів (рис. 12.1).
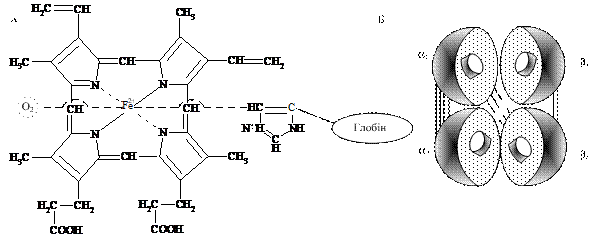
Рис. 12.1. Схема зв'язування гему з глобіном (А) та киснем у молекулі гемоглобіну і розташування субодиниць (Б) у четвертинній структурі гемоглобіну: субодиниці умовно позначені у вигляді півсфер, а гем - у вигляді дисків; суцільними лініями позначенні іонні, а пунктирними - ван-дер-ваальсові зв'язки
Четвертинна структура гемоглобіну подібна на тетраедр. Як видно з рис. 12.1 субодиниці розміщені попарно. У α-ланцюзі приєднання гему до глобіну відбулося за рахунок 87-го, а в β-ланцюзі – за рахунок 92-го залишків гістидину.
Різноіменні субодиниці утримуються завдяки ван-дер-ваальсових зв'язків, а субодиниці одного типу - іоннх і сольових, але їх кількість не постійна і залежить від числа приєднаних до гему молекул кисню. У безкисневому гемоглобіні (він називається дезоксигемоглобін) є чотири іонні зв'язки: два α1 – α2 і два β1 - β2.
За допомогою фізико-хімічних методів досліджень (електрофорез, хроматографія) встановлено неоднорідність гемоглобіну людини та такі його форми:
• гемоглобін дорослої людини НbА становить основну масу гемоглобіну дорослих і має кілька фракцій: НbА1 (основна фракція, що складається з 2α- і 2 β-ланцюгів, на її частку припадає 96 - 98 % усієї маси гемоглобіну), НbА2 (містить ααδδ-ланцюги, його частка становить 2 - 5 %), НbА3 (менше 1 %). НbА1 також неоднорідний - розрізняють НbА1α НbА1b, НbА1с. Фракція НbА1c утворює глікозильований гемоглобін.
• ембріональний гемоглобін (НbР) включає три фракції: Gower І, що складається з чотирьох ε-ланцюгів, Gower II (ααεε) і рortland І (ζζεε). НbР виявляють на ранніх стадіях розвитку ембріона;
• фетальний гемоглобін (НbF) -гемоглобін еритроцитів плода, що складається з 2α - і 2γ - ланцюгів. у нлвонароджених частка НbF становить близько 80 % , а в дорослої людини – 0,2 – 1,0 %.
Похідні гемоглобіну. Молекула гемоглобіну, взаємодіючи з різними лігандами, утворює похідні (рис. 12.2).
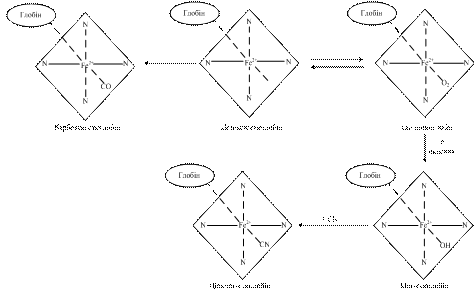
Рис.12.2. Схема утворення похідних гемоглобіну
Оксигемоглобін (HbО2)– сполука гемоглобіну з киснем. У ньому кисень, крім заліза, зв’язується слабким зв’язком з залишком другого гістидину молекули глобіну (рис. 12.1). Такий зв'язок легко руйнується сумішшю ацетону та хлоридної кислоти з утворенням денатурованого глобіну, який випадає в осад, та гему, в якому залізо окиснюється до тривалентного.
Метгемоглобін (МеtHb) містить іон Fе3+. У молекулі метгемоглобіну кисень замінений групою ОН-, тому метгемоглобін не може слугувати носієм кисню. У крові дорослої людини завжди є невелика кількість метгемоглобіну (0,3 - 3 г/л), однак його концентрація за умов норми не повинна перевищувати 20 г/л. За такої концентрації метгемоглобін відіграє захисну роль. Зокрема, (знешкоджує) ціаніди, перетворюючи їх на порівняно нешкідливий ціанметгемоглобін. Весь метгемоглобін крові людини може зв'язати до 1/3 смертельної дози ціанистих отрут (від 10 до 20 мг). Тому для лікування отруєнь ціанідами застосовують метгемоглобіноутворювачі (нітрит натрію).
Крім того, метгемоглобін знешкоджує гідрогенсульфід, масляну кислоту та інші речовини; проявляє більш виражену пероксидазну дію порівняно з гемоглобіном. Значення цього процесу полягає не тільки в руйнуванні токсичних для організму перекисів, але і в тому, що метгемоглобін при цьому відновлюється в гемоглобін.
Властивість відновлювати метгемоглобін має також аскорбінова кислота і глутатіон. В еритроцитах існує спеціальна ферментна система: НАДФН2-залежна метгемоглобінредуктаза (діафораза), яка каталізує відновлення метгемоглобіну на гемоглобін:
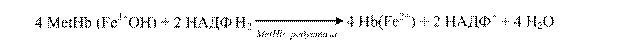
Патологічні метгемоглобінемії можуть бути природженими (первинними) і набутими (вторинними). Перші зумовлені, головним чином, атиповою будовою гемоглобіну (HbМ) або дефектами ферментних систем, що беруть участь у відновленні метгемоглобіну в гемоглобін. Набуті метгемоглобінемії виникають при отруєнні різними хімічними сполуками. Метгемоглобін має темніше забарвлення порівняно з гемоглобіном, тому при надмірній його концентрації в крові з'являється ціанотичне забарвлення шкіри.
Карбоксигемоглобін (HbCO) утворюється при отруєнні монооксидом вуглецю (чадним газом). Оскільки спорідненість монооксиду вуглецю до гемоглобіну значно вища, ніж у кисню (приблизно в 300 разів), то навіть при невеликих концентраціях його в крові він швидко сполучається з гемоглобіном. Так, при концентрації СО в повітрі 0,07 %, а О2 - 21 % вже 50 % гемоглобіну перетворюється на карбоксигемоглобін, а при наявності в повітрі 1 % СО фактично весь гемоглобін перетворюється на карбоксигемоглобін. Токсична дія моноксиду вуглецю виявляється при концентраціях його 0,11 мг/л. Моноксид вуглецю може сполучатися як з гемоглобіном, так і з оксигемоглобіном, в останньому випадку кисень витісняється.
Карбгемоглобін (HbCO2) – сполука гемоглобіну з СО2. Проте СО2 приєднується не до гему, а до NH2-груп глобіну: НbNH2 + СО2 → НbNНСОО- + H+. Дезоксигемоглобін зв'язує СО2 значно швидше, ніж оксигемоглобін. Шляхом утворення карбгемоглобіну виводиться 10 - 15 % СО2 з організму.
Сульфогемоглобін(HbSO) утворюється під час взаємодії оксигемоглобіну з сіркою або гідрогенсульфідом. Поява сульфогемоглобіну є наслідком тривалого зловживання медикаментами (наприклад, фенацетину) і називається сульфогемоглобінемією.
12.2.3. Механізм зв’язування гемоглобіном кисню. Як вже зазначалося, основна функція гемоглобіну полягає в зв’язуванні кисню та перенесенні його від легенів до тканин. Еритроцит містить біля 400 млн молекул гемоглобіну, кожна з яких може зв’язати 4 молекули О2, тобто по одній на субодиницю. Процес приєднання гемоглобіну до кисню називають оксигенацією.
Перша молекула О2 приєднується до α1-субодиниці гему (рис. 12.3).
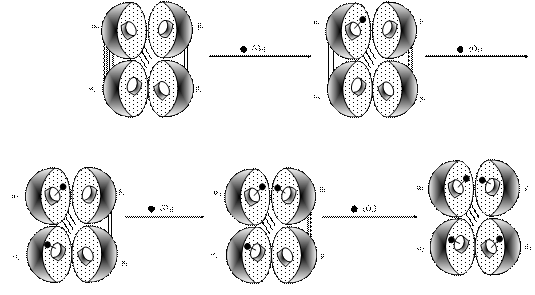
Рис. 12.3. Схема зв’язування кисню із гемоглобіном: послідовне приєднання до гему кисню і розрив іонних зв’язків між однаковими субодиницями
При цьому два іонні зв'язки α1 – α2 розриваються, що дає можливість іншим гемам прийняти вигідне положення для приєднання кисню. Третя молекула О2 приєднується до β1-субодиниці. Один із іонних зв'язків β1-β2 розривається, тим самим полегшує доступ кисню до останнього атома заліза β2-субодиниці гему. При цьому розривається останній іонний зв’язок β1 - β2. Найважче приєднується перша молекула кисню, а кожна наступна все легше (наприклад, четверта (остання) малекула кисню звя'зується у 300 разів швидше, ніж перша).
Зміна конформації всіх протомерів олігомерного білка при приєднанні ліганда лише до одного з них називається кооперативними змінами конформації протомерів і має важливе фізіологічне значення. Оксигемоглобін звільняється від кисню всього на 80 % при чотирикратному перепаді парціального тиску кисню з 10,6 до 2,6 кПа. Якби геми працювали автономно, то таке звільнення гемоглобіну від кисню вимагало б 90-кратного перепаду тиску. Оскільки це не можливо, то основна частина кисню не могла б відірватися від гемоглобіну і використовуватися тканинами. Людина задихнулася б навіть в атмосфері чистого кисню.
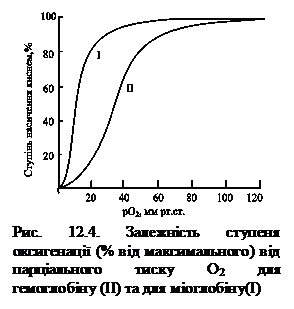 Маючи здатність приєднувати молекулу О2 при його високому парціальному тиску і віддавати — при низькому, тим самим молекула гемоглобіну виконує свою основну фізіологічну функцію транспортера кисню. Ефективність цього процесу відображає крива дисоціації оксигемоглобіну (характеризує ступінь насичення гемоглобіну киснем залежно від парціального тиску кисню, СО2, концентрації протонів (рН) крові та її температури), а також киснева ємність (максимальна кількість кисню, яку може зв'язати кров).
Маючи здатність приєднувати молекулу О2 при його високому парціальному тиску і віддавати — при низькому, тим самим молекула гемоглобіну виконує свою основну фізіологічну функцію транспортера кисню. Ефективність цього процесу відображає крива дисоціації оксигемоглобіну (характеризує ступінь насичення гемоглобіну киснем залежно від парціального тиску кисню, СО2, концентрації протонів (рН) крові та її температури), а також киснева ємність (максимальна кількість кисню, яку може зв'язати кров).
Крива зв'язування гемоглобіном кисню та, відповідно, дисоціації оксигемоглобіну, має S-подібну форму, що свідчить про кооперативний характер процесу, оскільки приєднання молекули О2 до першої субодиниці гемоглобіну внаслідок конформаційних змін, що відбуваються, підвищує здатність гемопротеїну до взаємодії з наступними трьома молекулами кисню (рис. 12.4). У капілярах м’язів у стані спокою тиск О2 становить ~ 40 мм рт.ст. і більша частина кисню повертається назад у легені в складі оксигемоглобіну. При фізичному навантаженні тиск О2 у капілярах м’язів падає до 10 – 20 мм рт.ст., тому саме в цій ділянці ( від 10 до 40 мм рт.ст.) розташовується «опукла частина» S-подібної кривої, де найбільшою мірою виражена кооперативна робота протомерів.
Завдяки своїй унікальній структурі міоглобін здатний приєднувати вивільнений гемоглобіном О2, накопичувати в клітинах і віддавати при потребі. Він має високу спорідненість до кисню, тому навіть при парціальному тиску 1 – 2 мм рт.ст. міоглобін залишається зв’язаним з киснем на 50 %.
На відміну від міоглобіну, гемоглобін має значну нижчу спорідненість з киснем, ступінь його оксигенації (утворення НbО2) залежить від низки чинників: парціального тиску кисню; значення рН; концентрації діоксиду вуглецю; концентрації 2,3-дифосфогліцерату.
Зазначимо також, що вивільненню кисню з оксигемоглобіну в периферичних тканинах значною мірою сприяє градієнт його парціального тиску в напрямку альвеоли (100 мм. рт. ст.) → артеріальна кров (90 мм.рт.ст.) → венозна кров (40 мм.рт.ст.) → мітохондрії клітин (0-5 мм.рт.ст.). Використання кисню в цитохромоксидазній реакції створює в мітохондріях "кисневий вакуум", завдяки якому в клітини дифундує кисень з еритроцитів.
12.2.4. Механізми транспорту діоксиду вуглецю від тканин до легенів.Крім транспорту молекул О2 від легенів до капілярів периферичних тканин, гемоглобін відіграє також суттєву роль у перенесенні від тканин до легенів СО2, який утворюється в клітинах у реакціях декарбоксилювання. У організмі людини, що не виконує фізичної роботи (стан спокою), від тканин до легенів кожну хвилину переноситься приблизно 180 мл вуглекислого газу. В організмі існує декілька механізмів перенесення СО2 від тканин до легенів. Частина його переноситься у розчиненому вигляді. Деяка кількість СО2 може переноситися у вигляді карбамінової форми. Виявилось, що СО2 може приєднуватися до гемоглобіну за допомогою карбамінового зв'язку, утворюючи карбгемоглобін або карбаміногемоглобін.
R – NH2 + CO2 → R – NHCOO- + H+
Гемоглобін Карбгемоглобін
Карбгемоглобін – дуже нестійка сполука, яка надзвичайно швидко дисоціює в легеневих капілярах з відщепленням СО2.
Кількість карбамінової форми невелика: у артеріальній крові становить 3 об %, у венозній - 3,8 об %. У вигляді карбамінової форми з тканини до легенів переноситься від 3 до 10 % всього вуглекислого газу, що поступає з тканин в кров. Основна кількість СО2 транспортується з кров'ю до легенів у формі бікарбонату (понад 80 % від всієї кількості вуглекислого газу), при цьому найважливішу роль відіграє гемоглобін еритроцитів.
Діоксид вуглецю, що надходить у кров, транспортується в еритроцити. Там під впливом карбоангідрази відбувається утворення карбонатної кислоти (Н2СО3), яка може дисоціювати на Н+ та НСО3-. надлишок водневих іонів зв'язується з гемоглобіном, що віддав кисень, а аніони НСО3 виходять з еритроцита в плазму:
КНb + Н2СО3 → К+ + НСО3- + ННb
В обмін на ці іони в еритроцит поступають аніони хлору, тоді як натрій - інший складовий елемент хлориду натрію, що міститься в крові, залишається в плазмі. У результаті в плазмі крові підвищується вміст бікарбонату натрію. Цей процес сприяє відновленню лужного резерву крові, тобто бікарбонатна буферна система знаходиться в досить тісних функціональних зв'язках з буферною системою еритроцитів.
Приєднання трьох пар протонів до гемоглобіну зменшує його спорідненість до кисню та посилює транспорт О2 у тканини, які його потребують. Збільшення вивільнення О2 гемоглобіном у залежності від концентрації Н+ називають ефектом Бора (Х.Бор – фізіолог, який відкрив це явище). У капілярах легенів високий парціальний тиск О2 спричинює оксигенацію гемоглобіну та видалення 6 протонів. Отже збільшення концентрації протонів у середовищі знижує спорідненість О2 до гемоглобіну і посилює його транспорт у тканини. Приєднання СО2 до гемоглобіну теж знижує його спорідненість до О2.
12.2.5. Деякі форми молекулярної патології гемоглобінів.Аномалії гемоглобінів (гемоглобінози) поділяють на гемоглобінопатії, в основі яких лежать спадкові зміни структури гемоглобіну і таласемії, що зумовлені порушенням синтезу одного з ланцюгів молекули гемоглобіну.
Гемоглобінопатії - це спадкові аномалії, пов’язані з порушенням глобіну за нормальної структури гему. Аномальні гемоглобіни різняться за своїми фізико-хімічними властивостями (електрофоретичною рухливістю, стійкістю до дії основ, розчинністю, ізоелектричною точкою).
Появу аномальних гемоглобінів пояснюють мутаційною теорією, а передавання нащадкам аномального гена здійснюється за законами спадковості. Встановлено понад 200 аномальних гемоглобінів: В (S), С, В, Е, К, L, М, N, О, Р, Q тощо, а також можливі їх комбінації (SС, SD тощо)
Гемоглобінопатії у гетерозиготній і гомозиготній формі поширені в Екваторіальній Африці, країнах Середземномор’я, на Аравійському півострові, у Південній Індії, на острові Шрі-Ланка, у Південному Китаї, південних районах США. Причину появи аномальних гемоглобінів пояснюють за допомогою малярійної гіпотези, згідно з якою мутації в гені, що контролює утворення гемоглобіну, виникли в країнах зі значним поширенням тропічної малярії. Було встановлено, що наявність аномального гена в гетерозиготній формі підвищує стійкість людей до захворювання, створює імунітет до малярії, оскільки зміни молекули гемоглобіну запобігають використанню його малярійним плазмодієм.
При гемоглобінопатіях молекулярний дефект полягає у змінах первинної структури поліпептидних ланцюгів, які формують а- або β-субодиниці молекул гемоглобіну (амінокислотні заміни, делеції або вставки) з утворенням аномальних форм гемоглобінів. Такі аномальні гемоглобіни позначають великими літерами латинського алфавіту, або за місцем, де був вперше виявлений даний дефект.
НbS — мутантний гемоглобін, відкритий в 1949 році Полінгом і Утано, відрізняється від нормального гемоглобіну А тим, що в шостому положенні двох β-ланцюгів місце глутамінової кислоти займає валін. Внаслідок таких відносно невеликих змін редукована форма гемоглобіну S слабкіше і повільніше зазнає оксигенації і гірше (майже в 25 разів) розчиняється, ніж НbА.
У капілярах під час віддавання кисню гемоглобін S випадає в осад у формі веретеноподібних кристалоїдів (тактоїдів). Це породжує осмотичну нестійкість еритроцитів, зміну їх форми з двоввігнутої в серпоподібну. Серпоподібні еритроцити легко гемолізуються вже в судинному руслі. Клінічні прояви цієї хвороби змінються від ледь помітних (гетерозиготна форма серпоподібноклітинної анемії) до тих, що спричинюють летальний кінець в ранньому віці (гомозиготні форми).
НbС — аномальний гемоглобін, у молекулі якого існує заміна залишку глутамінової кислоти в 6-му положенні β-ланцюга на лізин. Еритроцити, що містять такий аномальний гемоглобін, здатні до гемолізу, що також супроводжується розвитком анемії. Наявність гена С в гомозиготному стані призводить до розвитку вираженої спленомегалії, помірної мікроцитарної анемії. За наявності комбінації гемоглобінів С і S анемія вияляється в тяжчій формі.
НbМ — існує група гемоглобінів М, в поліпептидних ланцюгах яких залишок гістидину, який бере участь у зв'язуванні гему з залізом, заміщений на іншу амінокислоту.
У гемоглобінах, які містять такий молекулярний дефект, залізо (Fe3+) не може відновлюватися метгемоглобінредуктазою до Fe2+, у зв'язку з цим в еритроцитах накопичується метгемоглобін, якийне здатний до нормального транспорту кисню. Така метгемоглобінемія найбільш виражена в гомозиготному стані, внаслідок чого хворі гинуть в умовах тяжкої гіпоксії.
НbА1C — глікозильований гемоглобін, який з'являється в еритроцитах за умов некомпенсованого цукрового діабету. Цей гемоглобін — стабільний комплекс глюкози з мінорною А1C фракцією гемоглобіну, який утворюється між аміногрупою валіну - N-кінцевою амінокислотою β-глобіну і карбоксильною групою вуглеводу:
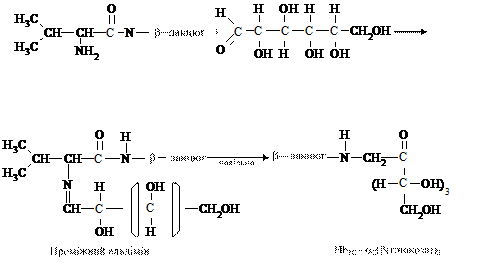
У нормі концентрація глікозильованого гемоглобіну становить 5 - 7 % від загальної кількості, тобто 8 - 10 г/л. Гіперглікемія впродовж 10 - 12 годин сприяє збільшенню кількості глікозильованого гемоглобіну. Глікозилювання гемоглобіну підвищує його спорідненність до кисню в тканинах, крім цього, утруднює приєднання 2,3 -дифосфогліцерату. У клініці показник рівня глікозильованого гемоглобіну використовують для діагностики цукрового діабету та інших порушень вуглеводного обміну.
HbD спричинює мікроцитоз, слабкий анізо - та пойкілоцитоз і зміну еритроцитів.
HbЕзумовлює мікроцитоз, який компенсується розвитком еритроцитозу (до7-8∙1012/л).
Інші гемоглобінози поширені значно менше, а їх клінічні прояви слабко виражені. У разі тяжких форм гемоглобінопатій морфологічні зміни в печінці, що виникають унаслідок гемохроматозу, можуть істотно впливати на кровоплин і супроводжуватися порушенням механізмів регуляції гемостазу.
Таласемія - спадкове захворювання, спричинене порушенням синтезу одного з ланцюгів гемоглобіну.
Якщо пригнічено синтез α-ланцюгів, то спостерігається α-таласемія, при генетичному дефекті синтезу β-ланцюгів - β-таласемія. При всіх видах таласемій порушується продукування еритроцитів кістковим мозком і насичення гемоглобіну киснем.
В основі α-таласемії лежать порушення синтезу α -ланцюга, що призводять до порушення утворення всіх фізіологічних видів гемоглобіну. Ланцюги β і γ, які з’являються в надлишку, не можуть взаємодіяти з α -ланцюгами, внаслідок виникає два види гемоглобінів — Нbβ4 (НbН) і Нbγ4 (Нb Бартса). Ці дві форми нестабільні й мають низьку спорідненість до кисню. У гомозигот гемоглобін представлений здебільшого Нb Бартса (загибель настає вже в період внутрішньоутробного розвитку). У гетерозигот наявна суміш Нb Бартса — НbН (прояви захворювання зводяться до незначного гемолізу без істотних наслідків для загального стану).
β-Таласемія зумовлюється порушенням синтезу β-ланцюгів, що призводить до відносного надлишку α-ланцюгів і посиленого утворення НbF (α2γ2) і HbA2 (α2δ2).
σ-Таласемія пов’язана з гальмуванням синтезу β- і σ-ланцюгів і підвищеним утворенням НbF.
Часто зустрічаються комбіновані форми гемоглобінозів, які можуть поєднуватися з дефіцитом глюкозо-6-фосфатдегідрогенази в еритроцитах, що ще більше посилює розвиток захворювання (анемії).
Буферні системи крові
Сталість рН внутрішнього середовища є обов'язковою умовою існування вищих організмів і забезпечується певним співвідношенням кислот і основ у біологічних середовищах, у разі порушення якого (вихід рН за межі 6,8 – 7,8) організм гине.
Кров відіграє значну роль у підтриманні кислотно-основного гомеостазу, який характеризується такими показниками:
1. постійна концентрація водневих іонів (рН), що становить 7,36 у венозній крові і 7,4 – в артеріальній;
2. парціальний тиск вуглекислого газу (рСО2) в артеріальній крові 35 - 45 мм.рт.ст.(в середньому 40 мм.рт.ст.), у венозній – вищий;
3. парціальний тиск кисню (рО2) в артеріальній крові становить 72 – 108 мм.рт.ст;
4. стандартний бікарбонат (SВ) - концентрація гідрокарбонату плазми крові, становить 24 – 27 ммоль/л;
5. актуальний (істинний) бікарбонат (АВ) - концентрація бікарбонату в плазмі крові за конкретних умов, становить 23 – 28 ммоль/л;
6. буферні основи (ВВ) - це сума аніонів буферних основ - гідрокарбонатів, білків, фосфатів, гемоглобіну (за умови повного насичення його О2). У нормі їх концентрація в крові становить 42 – 52 ммоль/л;
7. нормальні буферні основи (NВВ) цільної крові - сума всіх основних компонентів буферних систем крові при фізіологічних значеннях рН =7,38 і рСО2 = 40 мм.рт.ст. альвеолярного повітря.
Регуляція кислотно-основного стану в організмі здійснюється за участі буферних систем крові та функціонування легенів і нирок. Буферні системи — це суміш слабких кислот з солями цих кислот, що нейтралізують, відповідно, основи та кислоти, які можуть накопичуватися в організмі під час обміну речовин, протидіючи тим самим відхиленням рН від фізіологічного рівня.
До буферних систем організму належать бікарбонатна, фосфатна системи, гемоглобінові та білкова, серед яких найбільше значення для підтримання кислотно-лужного балансу крові та всього організму мають бікарбонатна та гемоглобінові.
12.3.1. Бікарбонатна буферна система складається з розчиненої в плазмі та еритроцитах вільної вугільної кислоти (у вигляді діоксиду вуглецю, донор протонів) та розчинених бікарбонатів — натрію (у плазмі) та калію (в еритроцитах) – акцептора протонів, її частка становить 10 % від усієї буферної ємності крові, вона найактивніше функціонує при рН 7,4.
При такому значенні рН вміст бікарбонатів перевищує вміст вільної вуглекислоти у 18 – 20 разів, що і зумовлює деяку лужність крові. Запас бікарбонатів у крові (тобто хімічно зв'язана вуглекислота) отримав назву лужного резерву крові, що є важливим біохімічним компонентом, який протидіє зсувам рН крові в кислий бік при накопиченні в організмі кислих продуктів, наприклад, молочної кислоти за умов важкої фізичної праці.
Механізм дії цієї системи полягає в тому, що при надходженні в кров великої кількості кислих продуктів іони Н+ взаємодіють з іонами бікарбонату НСО3- , що призводить до утворення вугільної кислоти Н2СО3-. Подальше зниження концентрації останньої досягається прискореним виділенням СО2 через легені внаслідок їх гіпервентиляції.
При надлишковій кількості основ відбувається їх взаємодія зі слабою вугільною кислотою з утворенням іонів бікарбонату та води. При цьому не відбувається помітного зсуву рН.
12.3.2. гемоглобінова буферна системамає найпотужніші буферні властивості, вона в 9 разів потужніша за бікарбонатну і складається з неіонізованого гемоглобіну ННb (слаба органічна кислота, донор протонів) та калієвої солі гемоглобіну КНb (основа, акцептор протонів). В окисненій формі гемоглобін виявляє свої кислотні властивості (дисоціює з віддачею іонів Н+). віддаючи іони водню він зв’язує іони калію (з КНСО3, який міститься в еритроцитах). Відновлений гемоглобін у тканинних капілярах може взаємодіяти з вугільною кислотою (а також іншими кислими метаболітами), утворюючи вільний гемоглобін (кислоту) та сіль відповідної кислоти.
Оксигемоглобін, присутній в артеріальній крові, є сильнішою кислотою порівняно з гемоглобіном, його калієва сіль може розкладати бікарбонати з утворенням вугільної кислоти, яка виділяється легенями у формі СО2. Гемоглобіновий буфер є найбільш ємним, на його частку припадає до 75 % усієї буферної ємності крові.
12.3.3. Фосфатна буферна системастановить всього 1 % від всієї буферної ємності крові. Роль кислоти в ній належить однозаміщеному фосфату Н2РО4 (донор протонів), а солі - двозаміщеному НРO4 (акцептор протонів). Буферна дія фосфатної системи реалізується при зміні рН в межах 6,1 – 7,7 і базується на можливості зв'язування іонів Н+ аніонами НРO42- (з утворенням Н2РO4-) та іонів ОН- іонами Н2РO4- (з утворенням НРO42-). Органічні фосфати теж володіють буферними властивостями, проте порівняно з неорганічними їх потужність менша.
Фосфатний буфер у крові знаходиться в тісному взаємозв'язку з бікарбонатною буферною системою.
12.3.4. Білкова буферна системаволодіє буферними властивостями за рахунок наявності в білках кислотно-основних груп: білок – Н+ (кислота, донор протонів) і білок (спряжена основа, акцептор протонів). Білкова буферна система плазми крові ефективна при рН 7,2-7,4.
Легені та нирки беруть участь у підтриманні КОС. регулюючи екскрецію або затримку в організмі надлишку кислих або основних продуктів метаболізму. Зокрема, виділення легенями діоксиду вуглецю під час дихання протидіє накопиченню в крові кислих еквівалентів. Нирки здатні як до екскреції кислих (кислі фосфати тощо) або лужних продуктів (Nа2НРО4, іони амонію), так і до затримання лужних еквівалентів шляхом реабсорбції бікарбонатів. Вони здійснюють регуляцію вмісту кислот і основ в організмі за рахунок трьох основних процесів: ацидогенезу (секреція іонів Н+ епітелієм нефронів і виведення їх із сечею шляхом перетворення основних фосфатів на кислі, а також екскреція слабких органічних кислот); амонійогенезу (утворення аміаку з глутаміну та інших амінокислот в епітелії канальців нефрона і наступному зв'язуванні ним іонів Н+); реабсорбції гідрокарбонату (гідрокарбонат при проходженні через канальці віддає катіон натрію замість секретованих іонів водню і перетворюється на карбонатну кислоту, яка розщеплюється до СО2 та води).
12.3.5.Порушення кислотно-основного стану.У випадку, якщо компенсаторні механізми організму не здатні попередити зсуви концентрації іонів Н+, виникає порушення КОС, яке проявляється ацидозом або алкалозом. При ацидозі концентрація іонів Н+ в крові перевищує нормальні величини (рН при цьому знижується), а при алкалозі - нижче нормальних значень (рН при цьому зростає). Межа сумісності з життям становить 6,8 та 8,0 відповідно.
У залежності від причини виникнення ацидоз чи алкалоз може бути респіраторним (дихальним) і нереспіраторним (метаболічним). а за ступенем компенсації порушення КОС – компенсованим, субкомпенсованим (або частково компенсованим) і декомпенсованим.
Дихальний (респіраторний) ацидоз виникає при порушенні дихання в результаті асфіксії або пригнічення дихання при травмі, бронхіальній астмі, набряку, емфіземі легенів, пухлині мозку, асфіксії механічного характеру, пригніченні дихального центра наркотичними засобами, отруєнні лікарськими препаратами; порушенні дифузії газів крізь альвеолярну мембрану внаслідок фіброзу, колагенозу, пневмоконіозу, легеневого саркоїдозу, гемосидерозу, пневмонії; при стазі кровоплину; збільшенні вмісту СО2 у навколишньому середовищі (замкнуті приміщення, шахти, підводні човни) тощо. Всі ці захворювання та перелічені фактори призводять до гіповентиляції й гіперкапнії, тобто підвищення рСО2 у крові. Гіперкапнія спричинює гіпоксію, що викликає недостатнє окиснення продуктів проміжного обміну в тканинах і накопичення кислих метаболітів. До респіраторного ацидозу приєднується метаболічний і розвивається змішаний ацидоз.
При накопиченні в організмі СО2 реакція дисоціації карбонатної кислоти у плазмі зміщується вправо:
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-,
що збільшує концентрацію Н+ і НСО3-.
Надлишок іонів Н+ значною мірою утримується в еритроцитах відновленим гемоглобіном, який виконує роль основи. Частина аніонів НСО3-, що звільнилася, зв'язується з катіоном К+ гемоглобіну, однак у більшій кількості він надходить у плазму, де сполучається з іонами натрію за рахунок цього підвищується вміст гідрокарбонату.
Роль нирок у компенсації газового ацидозу полягає у посиленні секреції іонів Н+. Кислотність сечі підвищується. Амоніогенез може бути дещо збільшеним.
Метаболічний (нереспіраторний) ацидоз – тяжка форма порушень КОС, в основі якого лежить первинне підвищення вмісту в організмі нелетких кислот або втрата основ. Він супроводжується нагромадженням в тканинах і крові органічних кислот.
Метаболічний ацидоз розвивається внаслідок посилення продукції, зниження окиснення і ресинтезу молочної кислоти (лактатацидоз) при шоку, гіпоксії, асфіксії, сепсисі, деяких отруєннях, порушенні функції печінки; збільшення продукції зниження окиснення і ресинтезу кетонових тіл (кетоацидоз) при цукровому діабеті, голодуванні тощо – власне метаболічний ацидоз; внаслідок затримки кислот, втрати основ, при порушенні функції нирок, а також при значних втратах лужних соків травного каналу – виділювальний ацидоз, надходження кислот і деяких ліків – екзогенний ацидоз. Особливо виразно метаболічний ацидоз проявляється у хворих на цукровий діабет: у відповідь на постійне утворення кетонових тіл в організмі компенсаторно, внаслідок прискореного виділення СО2 через легені, знижується концентрація Н2СО3 – донора протонів у бікарбонатній буферній системі. Однак, для досягнення повної компенсації ацидозу легені повинні виділяти настільки більшу кількість СО2, що концентрація Н2СО3 та НСО3- стає вкрай низькою і буферна ємність крові значно зменшується, що несприятливо впливає на організм.
Дихальний (респіраторний) алкалоз виникає при посиленій вентиляції легенів, що супроводжується швидким виділенням з організму СО2 і розвитком гіпокапнії (рСО2 менше 35 мм.рт.ст.).
Респіраторний алкалоз належить до порушень КОС, які найчастіше зустрічаються у клінічній практиці, він спостерігається при гіпервентиляції внаслідок гарячки, стресів, отруєння саліцилатами, ушкоджень та захворювань ЦНС (травми мозку, інсульт), застійної недостатності кровоплину, при пневмоніях, легеневій тромбоемболії, гострій недостатності печінки, фізіологічній вагітності, грамвід'ємному сепсисі.
Такий вид алкалозу може спостерігатися при вдиханні чистого кисню, компенсаторній задишці, яка супроводжує низку захворювань. При респіраторному алкалозі стан рівноваги реакції дисоціації карбонатної кислоти зміщується вліво:
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-
Вміст НСО3- знижується, підвищується концентрація негідрокарбонатних основ. Відбувається посилене виділення НСО3- нирками.
Метаболічний (нереспіраторний) алкалоз розвивається при втраті великої кількості кислот або первинному накопиченні основ. Він виникає при втраті шлункового вмісту внаслідок блювання або аспірації; надмірному введенні розчинів гідрокарбонату натрію, гіпервентиляції і швидкому зниженні рСО2, при дихальному ацидозі (гідрокарбонат, що накопичився в процесі компенсації дихального ацидозу, залишається в надлишку); первинному та вторинному гіперальдостеронізмі; у післяопераційний період, після крововтрат, дегідратацій (альдостерон блокує виведення НСО3- нирками); при збільшених втратах із сечею іонів СІ- і К+ при призначенні хлор- і калійуричних діуретиків.
Основною ознакою цього алкалозу є накопичення в плазмі переважно гідрокарбонату, зростання лужного резерву крові. Його компенсація здійснюється за рахунок зниження збудливості дихального центра при підвищенні рН, що призводить до зменшення частоти дихання та виникнення компенсаторної гіперкапнії. Алкалоз при ВЕ <10 ммоль/л вважають помірним, при ВЕ = 10-15 ммоль/л – середнім, при ВЕ > 15 ммоль/л - важким.
Комбінація метаболічного та респіраторного ацидозів спостерігається при набряку легенів, причому гіперкапнія за цих умов існує короткий час, зниження концентрації гідрокарбонату пов'язано з буферуванням існуючого одночасно лактатацидозу внаслідок гіпоксії.
Поєднання метаболічного алкалозу і респіраторного ацидозу спостерігають у хворих з тяжкими, часто хронічними захворюваннями легенів, у хворих, що страждають блюванням і приймають діуретики.
Комбінація респіраторного алкалозу і метаболічного ацидозу спостерігається при швидкій корекції метаболічного ацидозу, коли концентрація гідрокарбонату повертається до норми скоріше, ніж відбувається нормокапнія. Спостерігається при поєднанні печінкової та ниркової недостатності, при грамвід'ємному сепсисі.
Поєднання респіраторного та метаболічного алкалозу призводить до різкого зниження концентрації іонів Н+ і значного підвищення рН. Такий стан може спостерігатися при гострій недостатності печінки, емболії легеневих судин, сепсисі.
Білки плазми крові
У плазмі крові міститься декілька десятків різних білків, які відрізняються за фізико-хімічними та функціональними властивостями: ферменти, проферменти, інгібітори ферментів, транспортні білки, гормони, антитіла, антитоксини, фактори коагуляції та антикоагулянти тощо. Загальна концентрація білків у плазмі крові людини становить 65 – 85 г/л.
Вони виконують низку важливих функцій:
1. Білки підтримують колоїдно-осмотитичний (онкотичний) тиск, а, отже, постійний об'єм крові. Вони зв'язують воду і затримують її, не дозволяючи виходити за межі кров'яного русла.
2. Білки плазми беруть активну участь у згортанні крові. Низка білків крові, у тому числі фібриноген, є основними компонентами системи згортання крові.
3. Білки плазми певною мірою визначають в'язкість крові, яка в 4 – 5 разів перевищує в'язкість води і відіграє важливу роль у підтриманні гемодинаміки кровоносної системи.
4. Білки плазми, формуючи білкову буферну систему, беруть участь у підтриманні рН крові в межах 7,36 – 7,43.
5. транспортна функція білків плазми крові полягає в перенесенні ними низки речовин (холестерин, білірубін тощо), а також лікарських засобів (пеніцилін, саліцилати тощо).
6. Білки плазми крові відіграють важливу роль у процесах імунітету (імуноглобуліни).
7. У результаті утворення комплексів з білками плазми на належному рівні підтримується катіонний склад крові: наприклад, 40-50 % кальцію, залізо, магній та інші елементи сироватки крові зв'язані з білками.
8. Білки крові слугують резервом амінокислот.
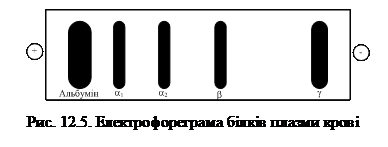 Шляхом електрофорезу на папері можна виділити п'ять фракцій білків плазми крові: альбуміни (55 – 65 %), a1-глобуліни (2 – 4 %), a2–глобуліни (6 – 12 %), β-глобуліни (8 – 12 %) та γ-глобуліни (12 – 22 %) (рис. 12.5). Електрофорез в поліакриламідному чи крохмаленому гелі дозволяє виділити 16 – 17 білкових фракцій, а метод імуноелектрофорезу – 30.
Шляхом електрофорезу на папері можна виділити п'ять фракцій білків плазми крові: альбуміни (55 – 65 %), a1-глобуліни (2 – 4 %), a2–глобуліни (6 – 12 %), β-глобуліни (8 – 12 %) та γ-глобуліни (12 – 22 %) (рис. 12.5). Електрофорез в поліакриламідному чи крохмаленому гелі дозволяє виділити 16 – 17 білкових фракцій, а метод імуноелектрофорезу – 30.
Альбуміни (сироваткові альбуміни) синтезуються в печінці, їх концентрація в плазмі крові становить 40 – 50 г/л. Цей білок складається з 585 амінокислотних залишків, має 17 дисульфідних зв’язків, його молекулярна маса – 69 000 да. Завдяки наявності в складі молекули великої кількості дикарбонових амінокислот, ці білки можуть утримувати катіони Са2+, Сu2+, Zn2+. Ця багатодисперсна фракція білків характеризуються високою електрофоретичною рухливістю та легкою розчинністю у воді та сольових розчинах. За рахунок високої гідрофільності альбуміни зв'язують значну кількість води, і об'єм їх молекули за умов гідратації збільшується вдвічі. Гідратаційний шар, який утворюється навколо молекул сироваткових альбумінів, забезпечує до 70-80 % онкотичного тиску білків плазми крові, що застосовується в клінічній практиці при переливанні розчинів альбуміну хворим із тканинними набряками. В свою чергу, зменшення концентрації альбумінів сироватки, наприклад за умов порушення їх синтезу в гепатоцитах при печінковій недостатності, може спричиняти перехід води із судинного русла до тканин і розвиток онкотичних набряків.
Альбуміни виконують також важливу фізіологічну функцію як транспортери багатьох метаболітів та інших низькомолекулярних сполук. вони переносять вільні жирні кислоти, некон’югований білірубін, триптофан, тироксин, аспірин, дикумарол, сульфаніламіди тощо.
Транстиретин (преальбумін) називають ще тироксинзв’язувальним преальбуміном. Це білок гострої фази, має тетрамірну молекулу. Він може приєднувати в одному центрі зв’язування ретинолзв’язувальний білок, а в другому – до двох молекул тироксину та трийодтироніну.
Глобуліни – гетерогенна фракція глікопротеїнів крові, які виконують транспортні та захисні функції (табл. 12.1).
Таблиця 12.1. Транспорт ендогенних метаболітів і вітамінів глобулінами плазми крові
| Глобуліни | Білок | Транспорт | |
| ендогенних метаболітів | Вітамінів | ||
| α1 | транскортин, транскобаламін, ретинол-, тироксинзв’язувальний | Тироксин, кортизол, ліпіди | |
| α2 | Церулоплазмін, гаптоглобін, ліпопротеїни | гемоглобін, жири,, холестерин, фосфатиди Са2+, Сu+ | Вітаміни D, K, E |
| β | Трансферин | Fe3+ | |
У клінічній практиці застосовується визначення співвідношення між концентрацією альбумінів і глобулінів у плазмі крові (так званого "білкового коефіцієнта"), який становить в середньому 1,5 - 2,0.
α1-Антитрипсин (α1-протеїназний інгібітор) - глікопротеїн з молекулярною масою 55 кД, належить до α1-глобулінів, його концентрація в плазмі крові становить 2 – 3 г/л. Основною біологічною властивістю цього інгібітора є його здатність утворювати комплекси з протеїназами, пригнічуючи при цьому протеолітичну активність таких ферментів, як трипсин, хімотрипсин, плазмін, тромбін та протеаз, які вивільняються при руйнуванні лейкоцитів або чужорідних клітин у вогнищах запалення.. В умовах запального процесу вміст α1-антитрипсину в крові значно збільшується за рахунок стимуляції його синтезу в гепатоцитах. оскільки за умов норми цей білок інгібує еластазу, яка руйнує еластин альвеол легенів, то при його недостатності може виникнути емфізема легенів, а також гепатит.
а2-Макроглобулін – глікопротеїн а2-глобулінової фракції з молекулярною масою 725 кДа. Універсальний сироватковий інгібітор протеїназ, вміст якого в крові найвищий порівняно з іншими протеїназними інгібіторами, і становить в середньому 2,5 г/л. α2-Макроглобулін знижує активність загортальної, фібринолітичної та калікреїнової системи крові, слугує також транспортером цинку в плазмі крові, а також може руйнувати низькомолекулярні токсичні пептиди бактеріального походження.
Церулоплазмін – глікопротеїн а2-глобулінової фракції, який зв'язує в плазмі крові іони міді. Молекула церулоплазміну містить 8 іонів Сu+ та 8 іонів Сu2+, його молекулярна маса - біля 150 кДа.
До складу церулоплазміну входить до 3 % всього вмісту міді в організмі та більше 90 % міді плазми. Церулоплазмін має властивості мідьвмісної фероксидази, окиснюючи залізо з феро- (Fe2+) до фери- (Fe3+) форми. Ця реакція є необхідною для перетворення заліза на іонну форму, яка може зв'язуватися феритином і використовуватися для синтезу залізовмісних білків (гемоглобіну, цитохромів).
Зниження вмісту церулоплазміну в плазмі крові (хвороба Вільсона) (норма 0,15 – 0,5 г/л) призводить до виходу іонів міді з судинного русла і його накопичення протеогліканами сполучної тканини, що проявляється патологічними змінами в печінці, головному мозку (гепатоцеребральна дегенерація), рогівці тощо. Підвищений рівень цього протеїну спостерігається у вагітних і жінок, що вживають оральні контрацептивні препарати.
Гаптоглобін — білок а2-глобулінової фракції плазми крові. Він має здатність зв'язувати вільний гемоглобін, утворюючи комплекс, що входить до електрофоретичної фракції β-глобулінів. Нормальна концентрація в плазмі крові — 0,10-0,35 г/л.
У складі гаптоглобін-гемоглобінового комплексу гемоглобін поглинається клітинами ретикулоендотеліальної системи, зокрема в печінці, та підлягає окисненню до жовчних пігментів. Така функція гаптоглобіну сприяє збереженню в організмі за умов фізіологічного та патологічного розпаду еритроцитів іонів заліза, що входять до складу гемоглобіну.
Цей білок належить до білків гострої фази, його концентрація зростає при гострих запальних процесах.
Трансферин (сидерофілін) — глікопротеїн β-глобулінової фракції, його молекулярна маса — 80 кДа. Білок має на своїй поверхні два центри зв'язування заліза, яке вступає в комплекс із трансферином разом з аніоном гідрокарбонату. Трансферин акцептує іони Fe3+, що надходять у кров після їх всмоктування в кишці, передає його на тканинний феритин, у складі якого залізо депонується в печінці, селезінці, кістковому мозку та інших органах. Концентрація трансферину в плазмі крові - близько 4 г/л.
Фібронектин — глікопротеїн β-глобулінової фракції, який синтезується та секретується в міжклітинний простір багатьма клітинами (у нормі його концентрація не перевищує 4 г/л). Фібронектин присутній на поверхні клітин, на базальних мембранах, у сполучній тканині та в крові. Він має властивості "липкого" білка, що зв'язується з вуглеводними компонентами сіалогліколіпідів (гангліозидів) на поверхні плазматичних мембран, виконуючи інтегруючу функцію у міжклітинній взаємодії. Крім цього, за рахунок утворення комплексів з колагеновими фібрилами, фібронектин відіграє значну роль в організації перицелюлярного матриксу. Фібронектин - білок зсідання крові, індикатор запальних станів.
С-реактивний білок (С-реактивний протеїн, СРП) – білок, що отримав свою назву внаслідок здатності реагувати з С-полісахаридом пневмокока, утворюючи при цьому преципітати. За хімічною природою є глікопротеїном. У сироватці крові здорової людини С-реактивний білок відсутній, та з'являється при патологічних станах, що супроводжуються запаленням і некрозом тканин, активуючи систему комплементу. Наявність СРП характерна для гострого періоду захворювань - "білок гострої фази". Визначення СРП має особливе діагностичне значення в гострій фазі ревматизму, при інфаркті міокарда, пневмококових, стрептококових, стафілококових інфекціях.
Імуноглобуліни крові (ІgА, IgG, IgE, IgM, ІgD) - білки γ-глобулінової фракції плазми крові, які виконують функцію антитіл, основних ефекторів гуморального імунітету.
Кріоглобулін — білок γ-глобулінової фракції, який, подібно до С-реактивного протеїну, відсутній у плазмі крові здорових людей і з'являється в ній при лейкозах, лімфосаркомі, мієломі, ревматизмі, цирозі печінки, нефрозах. Характерною фізико-хімічною ознакою кріоглобуліну є його розчинність при нормальній температурі тіла (37 °С) та здатність утворювати желеподібні осади при охолодженні плазми крові до 4 °С.
Ферменти плазми крові
Ферментний склад крові відносно постійний і має різноманітне походження. У сироватці крові виділяють три групи ензимів: клітинні, секреторні та екскреторні.
Клітинні ферменти в залежності від локалізації в тканинах поділяють на дві групи: одні каталізують неспецифічні (спільні для всіх тканин) реакції обміну і містяться в більшості органів та тканин; інші – органоспецифічні, їх ще називають індикаторними або маркерними (наприклад, аргіназа в паренхімі печінки, креатинфосфокіназа в м’язовій тканині). За умов норми їх концентрація в плазмі незначна, але ця група ферментів має суттєве клініко-діагностичне значення при патологічних процесах: ушкодженнях мембран гепатоцитів (АлАТ), міокарда (асАТ, КК) тощо, про що описано в розділі 1. Підвищення концентрації цих ферментів у плазмі пояснюється їх виходом з ушкоджених органів чи тканин на тлі продовження їх синтезу в цих тканинах, а також одночасним зростанням каталітичної активності деяких ферментів крові внаслідок припинення дії відповідних регуляторів (активаторів чи інгібіторів) ферментативних процесів.
Секреторні ферменти, іноді їх називають власне ензимами крові, синтезуються в печінці і звідти вивільняються в плазму, де виконують певні специфічні функції. Типовими представниками цієї групи є ферменти, що беруть участь у зсіданні крові, церулоплазмін, який забезпечує транспорт міді, сироваткова холінестераза тощо..
Інкреторні ферменти виділяються органами травної системи (шлунком, підшлунковою залозою, слизовою оболонкою кишок, ендотелієм жовчних шляхів). Появу цих ензимів (лужної фосфатази, амілази, трипсину тощо) у сироватці крові пояснюють природним руйнуванням клітинних структур, а також підвищенням проникності мембран секреторних клітин.
Різниця активності певних ензимів у плазмі та клітинах тканин може бути значною і залежить від швидкості, з якою вони виходять з клітин, а також від швидкості їх виведення з кровоплину. Так, активність амінотрансфераз у еритроцитах в кілька десятків разів перевищує активність цих ензимів у плазмі крові. Активність ЛДГ у клітинах скелетних м’язів у 1 000 разів, а активність креатинкінази – майже в 1 000 000 разів перевищує активність у плазмі крові. Виведення клітинних ензимів з кровоплину здійснюється шляхом їх поглинання та метаболізму, головним чином, у паренхіматозних органах. Ферменти як і білки, причому переважно високомолекулярні, підлягають клубочковій фільтрації в нирках і не виділяються з сечею, проте існують і певні винятки. Наприклад, амілаза, маючи малу молекулярну масу (менше 50 000 Да) надходить у сечу в нативному стані. Порушення функціонування нирок і погіршення їх видільної функції може призвести до підвищення активності цього ензиму в плазмі крові.
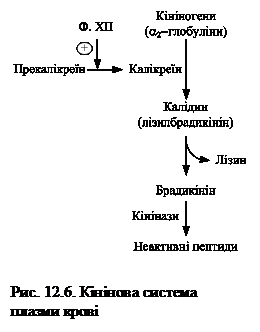
Калікреїн-кінінова система.Кініни –низькомолекулярні пептиди, які містяться в крові та інших біологічних рідинах і тканинах. Основними кінінами крові є нонапептид брадикінін (Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg) та декапептид калідин (Lys-Arg-Pro-Pro-Gly-Phe-ser-Pro-Phe-Arg).
Кініни синтезуються з білків кініногенів за участю протеїназ калікреїнів, що вирізають у молекулах кініногенів специфічні нона- або декапептидні фрагменти (рис.12.6). Своєю чергою, калікреїн плазми крові знаходиться в неактивному стані у формі прекалікреїну, який перетворюється на активний фермент за участі серинової протеїнази – фактора XII згортальної системи крові.
 Період піврозпаду кінінів плазми крові незначний (20 – 30 c). Руйнування кінінів здійснюється за рахунок дії ферментів кіназ, які розщеплюють пептидні зв’язки в молекулах кінінів, спричинюючи втрату їх біологічної активності.
Період піврозпаду кінінів плазми крові незначний (20 – 30 c). Руйнування кінінів здійснюється за рахунок дії ферментів кіназ, які розщеплюють пептидні зв’язки в молекулах кінінів, спричинюючи втрату їх біологічної активності.
Кініни функціонують переважно в місці утворення, швидко інактивуються. Вони володіють вираженим вазоактивним впливом: розширюють дрібні кровоносні судини, сприяючи покращенню мікроциркуляції, викликають гіпотензію, підвищують проникність судин, поліпшують живлення тканин, сприяючи ексудації плазми та речовин, що містяться в ній, в тканини, стимулюють поділ фібробластів, регенерацію тканин, посилюють секрецію слинних і потових залоз, сечовиділення. Крім цього, внутрішньотканинне утворення кінінів у місці запалення спричинює підвищення проникності судинних стінок, відчуття болю.
У зв'язку з участю кінінів у патогенезі запальних процесів, в клінічній практиці широко застосовуються лікарські засоби, які є інгібіторами кініноутворення. Так, гордокс – антиферментний препарат, який отримують із підшлункової залози забійної худоби, інгібує дію калікреїну, трипсину та інших ферментів. Його застосовують при гострому панкреатиті та панкреонекрозі, післяопераційному паротиті, тиреотоксичному кризі, у гострому періоді інфаркту міокарда, у комплексній терапії ішемічної хвороби серця. Для лікування панкреатиту застосовують також пантрипін і контрикал. Згідно сучасних даних при цьому захворюванні процес активування протеолітичних ферментів відбувається в підшлунковій залозі (тоді як за умов норми – в тонкій кишці), що спричинює самоперетравлення тканин залози, появу внутрішньотканинних крововиливів, ділянок некрозу, набряку тощо і, як наслідок, до втрати функціональної активності цього органа, а згодом - порушення метаболічних процесів у організмі.
Небілкові органічні сполуки плазми крові
12.6.1. Азотовмісні сполуки.Органічний азот біохімічних сполук, який можна визначити в надосадовій рідині після осадження білків плазми або сироватки крові, отримав у клінічній біохімії назву залишкового або рест-азоту. Цей небілковий азот складається з азоту таких кінцевих продуктів білкового і нуклеїнового катаболізмів як сечовина (50 % усього небілкового азоту крові), сечова кислота (4 %), креатин (5 %), креатинін (2,5), амінокислоти (25 %), вільні нуклеотиди, аміак, індикан та деякі інші сполуки. Вміст небілкового азоту в крові становить 15-25 ммоль/л.
Сечовина – діамід карбонатної кислоти, який утворюється в печінці в результаті знешкодження аміаку й екскретується з організму нирками.Сечовина – основний кінцевий продукт обміну білків, за умов норми її концентрація в плазмі крові становить 3,3 – 6,6 ммоль/л (при гострій нирковій недостатності досягає 50 – 83 ммоль/л). Клініко-діагностичне значення має коефіцієнт або відношення азоту сечовини до залишкового азоту (сечовина ´ 100 % / залишковий азот), у нормі коефіцієнт становить приблизно 48 %. При нирковій недостатності це значення підвищується і може досягти 90,4 %, а при порушенні сечовиноутворювальної функції печінки коефіцієнт знижується до 45 % і нижче.
Підвищення рівня сечовини в крові супроводжується проникненням цього метаболіту через мембрани клітин разом з водою, що спричинює набряк тканин паренхіматозних органів, міокарда, центральної нервової системи. Виведення сечовини з організму зменшує пастозність шкіри, набряк підшкірної жирової клітковини, зумовлює поліпшення функціонування міокарда. При патології зсув рівня сечовини у сироватці крові залежить від співвідношення процесів її утворення та виведення.
Сечова кислота(2,6,8-тріоксипурин) є кінцевим продуктом катаболізму пуринових основ у людини. За відсутності в їжі пуринів утворення та екскреція сечової кислоти в людини відбувається з однаковою швидкістю. Норма сечової кислоти в крові у чоловіків 0,24-0,46 ммоль/л, у жінок 0,16-0,38 ммоль/л. Гіперурикемія — підвищення рівня сечової кислоти в крові – має місце при природжених порушеннях пуринового обміну, порушенні виділення сечової кислоти з організму (захворювання нирок, пов’язані з ураженням ниркових клубочків (гострі та хронічні нефрити, уремія), ацидоз, гестоз, серцева декомпенсація, діабетична кома), порушенні обміну нуклеопротеїнів на тлі первинної та вторинної подагри, гематологічних (таласемія, перніціозна анемія, лейкози), серцево-судинних (інфаркт міокарда, атеросклероз, гіпертонічна хвороба), ендокринних захворюваннях (акромегалії, гіпопаратиреоз, цукровий діабет), тощо.
Гіпоурикеміярозвивається внаслідок споживання їжі, багатої на вуглеводи та жири, при дефіциті білків, м’язовій атрофії, після лікування препаратами, що сприяють екскреції сечової кислоти з сечею, алопуринолом, пробенецидом, хініном, дефекті механізму реабсорбції сечової кислоти в ниркових канальцях тощо.
Креатин — важливий компонент залишкового азоту. Екзогенний креатин надходить з продуктами харчування (м’ясо, печінка), а ендогенний - утворюється переважно в печінці та нирках із трьох амінокислот — аргініну, гліцину та метіоніну. У нирках за участі трансамідинази (каталізує перенесення амідинового залишку аргініну на гліцин) утворюється попередник креатину — гуанідинацетатна кислота, яка метилюється в печінці під впливом S-аденозилметіоніну та метилтрансферази. З плином крові креатин переноситься в м’язову тканину, де відбувається його фосфорилювання за допомогою креатинкінази з утворенням креатинфосфату. Вміст креатину в крові за умов норми становить 15,25 - 45,75 мкмоль/л у чоловіків і 45,75—76,25 мкмоль/л у жінок. Підвищення цього показника в сироватці крові спостерігають при: некрозі й атрофії скелетних м’язів (поліомієліт, травми, м’язова дистрофія, міастенія, голодування); ендокринних захворюваннях (цукровий діабет, гіпертиреоз, акромегалія); лейкозах, інфекціях, опіках, ревматоїдному артриті, системному червоному вовчаку.
Креатинін. Креатинфосфат, утворений у мітохондріях міоцитів, у міофібрилах розпадається з утворенням креатиніну, залишку неорганічного фосфату, молекули води та вивільненням енергії. Креатинін не підлягає реабсорбції у канальцях нирок. У нормі концентрація креатиніну в крові у чоловіків становить 53 -106 мкмоль/л, у жінок – 44-97 мкмоль/л. Креатинемія є характерною для ретенційної азотемії, яку спостерігають при гострій та хронічній нирковій недостатності, порушенні відтоку сечі внаслідок закупорки сечовивідних шляхів; опіків, м’язових дистрофій, непрохідності кишок, печінки, тяжкої форми цукрового діабету, гіпертиреозу, гіпофункції кіркової речовини надниркових залоз, акромегалії тощо. Зниження вмісту креатиніну спостерігають при зменшенні м’язової маси, у період вагітності (І і II триместри).
У крові постійно міститься деяка кількість амінокислот (3,5 – 6,5 г/л). Частина з них екзогенного походження, тобто поступає в кров при всмоктуванні з травного тракту, друга частина утворюється внаслідок розпаду білків тканин. Зміни вмісту загального амінного азоту в сироватці та сечі можуть служити показником переважання катаболічних чи анаболічних процесів в організмі. Кількість амінокислот у крові збільшується при захворюваннях печінки, діатезі, спазмофілії, фенілкетонурії, інфекційних захворюваннях, пухлинах, при деяких оперативних втручаннях тощо.
У склад залишкового азоту входить азот деяких середніх молекул (СМ або молекул середньої маси). Поняття СМ охоплює гетерогенну групу речовин різноманітної хімічної природи з молекулярною масою від 300 до 5000 Да: прості і складні пептиди, що є продуктами деградації білків сироватки (β-ланцюги-фібриногену і β2-мікроглобуліну), глікопротеїнів, нуклеопротеїнів, гуморальні речовини і гормони (інсулін, глюкагон); речовини вуглеводної природи (олігосахариди); похідні глюкуронових кислот, деяких спиртів тощо.
Залежно від виду патології та характеру ускладнень склад СМ різний. Для прояву клінічних симптомів ендогенної інтоксикації необхідне підвищення рівня середніх молекул у понад 3-5 разів. Особливо токсичними є речовини з M.м. 1 000 – 1 100 Да. Молекули середньої маси впливають на процеси життєдіяльності: різні ланки метаболізму, транспорт речовин, клітинний імунітет. Вони гальмують гліколіз, глюконеогенез, пригнічують синтез нуклеїнових кислот, гемоглобіну і еритропоез, порушують тканинне дихання; мають імунодепресивну, цитотоксичну, нейро- і психотропну дії, антиагрегаційні та антикоагулянтні властивості.
Виведення СМ з організму здійснюється нирками і не підлягає реабсорбції в канальцях нирок, тому їх кліренс наближається до кліренсу інуліну і креатиніну.
Білірубін — це продукт розпаду гему, найважливіший пігмент жовчі жовто-червоного кольору, який є нормальним компонентом плазми крові (1,7 – 20,5 мкмоль/л) (табл. 14.2). У результаті розпаду 1 г гемоглобіну утворюється 34 мг білірубіну. Вільний (непрямий) білірубін є водо нерозчинним, токсичним і з’єднується з альбуміном плазми крові. Комплекс альбумін-білірубін надходить в печінку, і на поверхні плазматичної мембрани гепатоцита він підлягає дисоціації. При цьому звільнений білірубін потрапляє в гепатоцити. У печінці білірубін кон’югує з глюкуроновою кислотою за допомогою глюкуронілтрансферази. Глюкуронілбілірубін дістав назву прямого, зв’язаного білірубіну. Він розчинний у воді, малотоксичний і дає пряму реакцію з діазореактивом. Уміст прямого білірубіну в крові підвищується внаслідок зниженого синтезу та секреції жовчі, руйнування гепатоцитів при жировому гепатозі (стеатозі), гепатитах (вірусних, токсичних), цирозах печінки, паренхіматозній та обтураційній жовтяниці, раку печінки, синдромах Дабіна-Джонсона і Ротора, абсцесі печінки, жовтяницях вагітних; холециститі, холангіті, холестазі; хронічному панкреатиті; гіпотиреозі в новонароджених.
Індикан — це калієва чи натрієва сіль індоксилсульфатної кислоти. Він утворюється в печінці в результаті естерифікації індолу, який, як і деякі інші токсичні сполуки (фенол, крезол, скатол) є наслідком гниття білків. Потрапляючи з плином крові ворітною веною в печінку, індол знешкоджується шляхом кон’югації з сульфатною або глюкуроновою кислотами.
Норма індикану в сироватці крові — 1,41—3,76 мкмоль/л; підвищення цього показника в крові спостерігають при ретенційній азотемії (ниркова недостатність, гломерулонефрит);порушенні функцій травного тракту та посиленому гнитті білків у кишках (знижена кислотність шлункового соку, закрепи, заворот кишок, защемлення кили, кишкова непрохідність); посиленому розщепленні білків в організмі (пухлини, емпієми, бронхоектази, абсцеси).
Підвищення вмісту індикану до 4,7 мкмоль/л оцінюють як наслідок захворювань кишок, а більш високі показники пов’язують із патологією нирок.
12.6.1.1. Азотемія. При деяких патологічних станах рівень небілкового азоту в крові підвищується. Такий стан має назву азотемії, яка може бути двох видів: абсолютною (нагромадження в крові компонентів залишкового азоту) і відносною (наприклад, при блювоті, проносі). У залежності від причин, які викликають захворювання, абсолютну азотемію поділяють на ретенційну і продукційну.
Ретенційна азотемія виникає в результаті недостатнього виділення з сечею азотовмісних продуктів у разі нормального надходження їх у кров'яне русло. Вона може бути нирковою і позанирковою. Ниркова ретенційна азотемія є наслідком порушення екскреторної (видільної) функції нирок, а позаниркова ретенційна азотемія виникає в результаті тяжкої недостатності кровообігу, зниження артеріального тиску, зменшенні ниркового кровоплину при серцево-судинній декомпенсації. Підвищення залишкового азоту відбувається за рахунок сечовини.
Продукційна азотемія виникає при збільшеному поступленні азотовмісних продуктів у кров, як наслідок посиленого розпаду тканинних білків, зменшеного вживання води. Функція нирок при цьому не порушена. Це спостерігають при голодуванні, кахексії, пораненнях, інфекціях (лептоспіроз, дифтерія, скарлатина), кишковій непрохідності, тиреотоксикозі, лейкозах, мієломній та променевій хворобах, отруєнні хлороформом, тетрахлорметаном), під час лікування глюкокортикоїдами. Цей вид азотемії має характерний склад фракції залишкового азоту – підвищення вмісту амінокислот, поліпептидів, сечової кислоти, креатину та креатиніну в разі незначної зміни рівня сечовини. Часто спостерігають азотемії змішаного типу. У цих випадках важко відрізнити ретенційну азотемію від продукційної.
12.6.2. Безазотисті сполуки.До безазотистих хімічних компонентів плазми крові належать вуглеводи, ліпіди, органічні кислоти, які є метаболітами обміну речовин (молочна, піровиноградна, ацетооцтова кислоти, метаболіти циклу трикарбонових кислот). Всі ці сполуки є або продуктами проміжного обміну вуглеводів і ліпідів, або відіграють роль поживних речовин.
У плазмі крові містяться переважно моносахариди, основним чином глюкоза та фруктоза, галактоза і деякі пентози (рибоза, дезоксирибоза). Основні продукти гліколізу - молочна та піровиноградна кислоти знаходяться в плазмі крові в концентрації 0,55 – 2,22 ммоль/л і 34,06 – 102,2 мкмоль/л відповідно.
Загальний вміст ліпідів у плазмі крові людини коливається залежно від режиму і харчування та конституційних особливостей організму (віку, статі) і становить в середньому 5 – 7 г/л. За фізіологічних умов загальна кількість ліпідів крові може збільшуватися до 10 – 15 г/л після вживання їжі, збагаченої жирами (аліментарна гіперліпемія).
Найбільшу кількість серед ліпідів плазми крові становлять триацилгліцероли (0,5 – 1,9 г/л), фосфоліпіди (1,1 – 2,75 г/л), холестерин загальний (1,5 – 2,6 г/л), холестерин естерифікований (1,0 – 2,1 г/л) та неестерифіковані жирні кислоти (0,08 – 0,2 г/л).
Ліпіди, як гідрофобні сполуки, не здатні знаходитися у вільному (розчинному) стані в плазмі крові, яка з фізико-хімічної точки зору є водно-сольовим розчином. Стабілізаторами ліпідів плазми є спеціальні білки - апопротеїни,які сприяють утворенню ліпопротеїнових міцел, у складі яких різні класи ліпідів можуть транспортуватися кров'ю.
Підвищення концентрації в плазмі крові різних класів ліпопротеїнів (гіперліпопротеїнемії) свідчить про серйозні зміни ліпідного обміну, найчастіше пов'язані з певними генетичними порушеннями, про що сказано в розділі 5.
12.6.3. неорганічні компоненти.Серед катіонів плазми крові важлива роль належить катіонам натрію, які становлять 93 % від всієї їх кількості, а серед аніонів слід виділити хлор і бікарбонат. Сума катіонів і аніонів практично однакова, тобто вся система є електронейтральною.
Більшість мікроелементів в крові зв'язані з білками. Так, мідь плазми крові входить до складу церулоплазміну, цинк еритроцитів міститься в карбоангідразі, 65 – 70 % йоду крові знаходиться в органічно зв'язаній формі у – складі тироксину. Кобальт міститься в складі вітаміну В12, і, так само як і селен, зв'язаний з білками плазми крові.
Дата добавления: 2018-05-12; просмотров: 3141; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
