Вивчення регуляції ферментативних процесів та аналіз механізмів виникнення ензимопатій. Медична ензимологія.
Активатори– являються факторами, що підвищують швидкість ферментативної реакції. Прикладами можуть бути іони хлору, що є активаторами амілази слини Н+, які підвищують активність пепсину, жовчні кислоти, що підвищують активність ліпази підшлункової залози. Існує і процес самоактивації. Багато ферментів виробляється в неактивній формі в клітинах в виді проферментів або зимогенів, у яких активний центр заблокований ділянкою пептидного ланцюга.
Коферментитеж є факторами, що впливають на швидкість реакції, при цьому відмічається пряма залежність між концентрацією коферменту і швидкістю реакції.
Кофакторами, що здатні активувати ферменти, можуть бути як іони металу, так і невеличкі органічні молекули, наприклад, похідні водорозчинних вітамінів (НАД, ФАД, ТГФК тощо). Усе це стосується лише ферментів, робота яких потребує наявності кофактора.
Інгібіторизнижують швидкість ферментативної реакції шляхом пригнічення дії ферменту. Даний процес носить назву інгібірування.
Інгібірування буває зворотне і незворотне.
При незворотному інгібіруванні повністю втрачається активність ферментів, що зв'язано з руйнуванням їх структури. До таких інгібіторів відносяться різні денатуруючі агенти (сильні кислоти, луги, спирти), отрути, фосфорорганічні сполуки.
Зворотне інгібірування проходить тільки в період взаємодії ферменту з інгібітором, видалення якого знову повертає активність ферменту. Воно буває конкурентним і неконкурентним.
|
|
|
Конкурентнемає в своїй основі конкуренцію між субстратом і інгібітором за взаємодію з активним центром ферменту. Це можливо тільки тоді, коли структура інгібітора подібна структурі субстрату, інгібітор є структурним аналогом субстрату. Тільки при цій умові інгібітор може взаємодіяти з активним центром ферменту.
Друга особливість конкурентного інгібірування - це строге кількісне співвідношення між субстратом і інгібітором.
Інгібірування може пройти тільки тоді, коли інгібітору буде більше, ніж ферменту.
Неконкурентне- інгібітор не є структурним аналогом субстрату і з'єднується з не активним центром, а з другим центром молекулами, що носить назву алостеричного центру. В результаті цього змінюється структура всього ферменту, в тому числі і активного центру, який уже не може приєднувати субстрат. Е + S + I ↔ ESI
Існують два принципових шляхи регуляції швидкості біохімічних ферментативних реакцій:
А – через зміну каталітичної активності ферменту.
Б – через зміну кількості ферменту (або ферментів), що визначають перебіг ферментативного процесу.
У разі реалізації першого шляху кількість ферменту залишається без змін, відбувається активація або інгібування ензиму. Це найбільш поширений шлях регуляції
|
|
|
Зміна кількості ферменту може відбуватися як результат коливання концентрації субстрату або дії гормональних чинників.
Кожен із цих шляхів має відповідні механізми регуляції, які дозволяють максимально можливо збалансувати метаболічні перетворення.
Зміна каталітичної активності ферментів можлива завдяки існуванню таких механізмів:
1) алостерична регуляція;
2) зворотна ковалентна модифікація (фосфорилювання / дефосфорилювання);
3) частковий протеоліз;
4) білок-білкові взаємодії.
Розглянемо кожен із названих механізмів.
Алостерична регуляція характерна для особливих регуля-торних (алостеричних) ферментів, які, крім активного, мають алостеричний ценр, що відповідає за зв’язування з модифікаторами (інгібіторами або активаторами).
До основних властивостей та характеристик алостеричних ферментів слід віднести таке:
1) усі алостеричні ферменти – це олігомерні білки, тобто складаються з декількох субодиниць;
2) активний та алостеричний центри знаходяться на різних субодиницях. Субодиниця, яка містить активний центр, має назву каталітична і позначається «С», та яка містить алостеричний – регуляторна і відповідно має позначку «R»;
|
|
|
3) кінетика алостеричних ферментів відрізняється від звичайних нерегуляторних ензимів, тому що вони мають олігомерну будову. Саме тому для алостеричних ферментів властивий кооперативний ефект зв’язування, який і змінює кінетичні характеристики хімічної реакції.
При зв’язуванні активатора з алостеричним центром через конформаційні зміни субодиниць реалізується його позитивна дія, яка супроводжується зростанням каталітичної активності активного центру ферменту. В разі приєднання інгібітора конформаційні зміни регуляторної субодиниці призводять до зниження роботи активного центру і, таким чином, до пригнічення активності ферменту взагалі.
Кінетична крива для алостеричних ферментів суттєво відрізняється від кривої для простих ферментів – вона має S-подібну форму, яка пояснюється саме існуванням кооператив-ного ефекту (рис. 17).
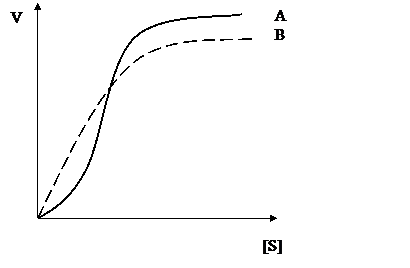

Кінетичні криві для: А – алостеричного ферменту;
В – нерегуляторного ферменту.
Зворотна ковалентна модифікація ферментів, яка призводить до зміни їх активності, найчастіше відбувається шляхом фосфорилювання або дефосфорилювання. Крім того, іноді відбуваються інші модифікації, такі, наприклад, як метилування, АДФ-рибозилювання, аденілування.
|
|
|
Фосфорилювання каталізують ферменти протеїнкінази за участі АТФ, дефосфорилювання – фосфопротеїнфосфатази.
Зворотна ковалентна модифікація (фосфо-рилювання / дефосфорилювання).
Ферменти: 1 – кіназа; 2 – фосфатаза
Частковий протеоліз як механізм зміни каталітичної активності ферментів є незворотним процесом, тому що відбувається відщеплення фрагменту білкової молекули. Цей механізм реалізується в разі, коли фермент синтезується у вигляді неактивного попередника – проферменту (або зимогену).
Пепсин, трипсин, хімотрипсин – протеолітичні ферменти шлунково-кишкового тракту, які спочатку синтезуються у вигляді неактивних зимогенів: пепсиногену, трипсиногену, хімотрипсиногену. Їх активація відбувається саме завдяки частковому протеолізу.
Аналогічний механізм активації властивий ферментам згортальної та фібринолітичної систем крові, системи комплементу, пептидним та білковим гормонам.
Наступний механізм зміни каталітичної активності ферментів базується на білок-білкових взаємодіях. Існують два основних види такої регуляції:
1) приєднання спеціальних регуляторних білків до молекули ферменту;
2) асоціація або дисоціація протомерів (субодиниць) молекули ферменту.
Спеціальні регуляторні білки також можуть суттєво змінювати активність ферментів. Найбільш поширеними регуляторними білками є кальмодулін, протеїназні інгібітори (α1-антитрипсин, α2- макроглобулін), антигемофільний глобулін А, убіквітин та інші.
Асоціація та дисоціація субодиницьмолекули ферменту, що призводить до зміни активності, також зустрічається дуже часто. Так, наприклад, при реалізації дії адреналіну в клітині активується фермент протеїнкіназа А (ПК А), що необхідна для фосфорилювання ферментів, які відповідають за відповідь клітини на дію гормону.
Ізоферменти (ізозоми) – це множинні генетично детерміновані форми одного ферменту, які каталізують одну й ту саму хімічну реакцію, але відрізняються за будовою, фізико-хімічними, імунологічними та каталітичними властивостями.
Лише ферменти з четвертинною структурою можуть мати ізоферментні форми, які формуються в результаті комбінацій різних субодиниць. Класичним прикладом ізоферментів є ізоферменти лактатдегідрогенази (ЛДГ або LDH).
Сукупність ферментів, які каталізують перетворення субстрату в продукт через ланцюг послідовних реакцій, має назву мультиферментний комплекс.
Можливість використання ферментів з діагностичною метою основана на тому, що кожний орган має характерний набір ферментів і поява їх у крові дозволяє локалізувати патологію. Так, для серцевого м'яза серед великої групи ферментів найбільш специфічними являються КК (креатинкіназа), АСТ (аспартатамінотрансфераза), ЛДГ (лактатдегідрагеназа). В печінці локалізується АЛТ (аланінамінотрансфераза), ЛДГ, ЩФ (лужна фосфатаза), АСТ. В скелетних м’язах ЛДГ, КК і в меншій мірі АСТ, в нирках, ЛДГ, ЩФ і в значно менше АСТ. В підшлунковій залозі висока активність α-амілази.
Крім того різна локалізація ізоферментів в органах і тканинах. Наприклад, ЛДГ-1 переважно локалізується в серці, а ЛДГ-4,5 в печінці.
Вихід ферментів в кров відбувається не тільки при руйнуванні клітин, а й при підвищені проникливості клітинних мембран. Останнє, як правило, відмічається на самому початку розвитку патологічного процесу, часто до розвитку клінічної картини захворювання.
Дата добавления: 2018-05-12; просмотров: 2895; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
