Задача. Вычисление массы продукта реакции, если известно количество вещества одного из исходных веществ.
Вычислите массу железа, образующуюся при восстановлении углём 0,2 моль оксида железа (III).
Запишем уравнение реакции:
Fe2O3 + 3C = 2Fe + 3CO
Для получения двух моль железа требуется один моль оксида, то есть в два раза меньшее количество. Следовательно, при восстановлении углем 0, 2 моль оксида железа получим 0, 4 моль железа.
Найдём массу этого количества железа:
M = √ (Fe) ∙ M (Fe) = 0, 4 ∙ 56 = 22, 4г
Ответ: 22, 4г железа
Билет №18
Опыт. Распознавание раствора соли хлороводородной кислоты среди трех предложенных растворов.
Соли соляной кислоты называются хлоридами. Качественной реакцией на хлорид – ион служит выпадение белого творожистого осадка хлорида серебра при добавлении к испытуемому раствору нескольких капель раствора нитрата серебра.
Ag NO3 + Na CI = Ag CI ↓ + Na NO3
Бромид – ионы дают бледно – желтый творожистый осадок, а иодид – ионы – осадок иодида серебра желтого цвета.
Билет №19
Задача. Вычисление количества вещества продукта реакции, если известна масса одного из исходных веществ.
Найдите количество вещества оксида алюминия, которое образуется при сжигании на воздухе алюминиевой пудры 5,4г.
Запишем уравнение химической реакции:
4 AI + 3O2 = 2AI2O3
Найдём количество вещества алюминия, поделив его массу на молярную массу алюминия.
√ =  =
= 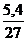 = 0, 2 моль
= 0, 2 моль
По уравнению реакции из 4 моль алюминия образуется 2 моль оксида, то есть оксида образуется по моль в два раза меньше. Следовательно, из 0, 2 моль алюминия получим 0, 1 моль оксида.
|
|
|
Ответ: 0, 1 моль.
Билет №20
Опыт. Распознавание среди трех предложенных веществ кислоты и щелочи.
Для распознавания кислот и щелочей удобно использовать кислотно-основные индикаторы.
Для проведения определения необходимо капнуть в каждый раствор несколько капель индикатора и сравнить наблюдаемую окраску с таблицей.
Окраска индикаторов в различный средах.
| Индикатор | Реакция среды | ||
| кислая | нейтральная | щелочная | |
| Лакмус | красный | фиолетовый | синий |
| Метилоранж | красный | Оранжевый | жёлтый |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
Билет №21
Опыт. Получение и собирание углекислого газа. Доказательство наличия этого газа в сосуде.
Углекислый газ – оксид углерода(IV) – бесцветный газ, тяжелее воздуха, растворяется в воде. Образуется при брожении, дыхании, сжигании органических веществ. В лаборатории получают при действии соляной кислоты на мрамор, основной частью которой является карбонат кальция.
Для получения углекислого газа используют универсальный прибор для получения газов. Кусочки мрамора помещают в пробирку и наливают соляную кислоту. Происходит реакция:
|
|
|
Ca CO3 + 2HCI = Ca CI2 + CO2↑ + H2O
Выделяющийся газ собирают методом вытеснения воздуха в сосуд, расположенный дном вниз.
Для доказательства наличия углекислого газа в сосуд опускают горящую лучинку. Она тухнет.
Можно определить также пропуская углекислый газ через прозрачный раствор известковой воды, образуется белый осадок - карбонат кальция.
Ca (OH)2 + CO2 = CaCO3 ↓ + H2O
Билет №22
Опыт. Осуществление превращения: соль – нерастворимое основание – оксид металла.
Cu SO4 → Cu (OH)2 → Cu O
Сульфат меди (II)- соль растворимая в воде, раствор её окрашен в голубой цвет. Cu (OH)2 – гидроксид меди (II), основание нерастворимое в воде, для его получения к соли добавляют щелочь – гидроксид натрия, выпадает осадок синего цвета – гидроксид меди(II). Уравнение имеет вид:
Cu S O4 + 2 Na OH = Cu (OH)2 ↓+ Na2S O4
Полученный синий раствор нагревают, при этом он быстро чернеет, разлагаясь до оксида меди (II). При этом протекает реакция:
Cu (OH)2 = Cu O + H2O
Билет №23
Дата добавления: 2018-05-02; просмотров: 1887; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
