Химическое действие электрического тока
Прохождение тока через электролит (растворы солей, кислот и щелочей) сопровождается химическим процессом, называемым электролизом. Если погрузить в электрлит электроды, находящиеся под напряжением, то ионы с положительным зарядом, т. е. с недостатком электронов, начнут двигаться к катоду, где пополнят свои недостающие электроны, а ионы с отрицательным зарядом будут двигаться к аноду и там отдадут свои лишние заряды. Число положительных и отрицательных ионов в жидкости всегда одинаково. Поэтому жидкость электрически нейтральна.
При электролизе на электродах выделяется определенное количество веществ, содержащихся в виде химического соединения в электролите. Зависимость массы выделенного вещества от силы тока устанавливается двумя законами Фарадея.
Первый закон Фарадея. Количество выделенного при электролизе вещества m пропорционально заряду (количеству электричества) q, перенесенному ионами:

где α - коэффициент пропорциональности, называемый электрохимическим эквивалентом.
Таблица 2.6 - Значения электрохимических эквивалентов некоторых веществ
| Вещество | Α, г/А∙ч |
| 1 | 2 |
| Водород | 0,0374 |
| Кислород | 0,2984 |
| Хром | 0,323 |
| Никель | 1,096 |
| Медь | 1,186 |
| Цинк | 1,219 |
| Хлор | 1,3212 |
| Свинец | 3,859 |
| Серебро | 4,025 |
| Золото | 7,355 |
В практических расчетах для определения количества электричества удобнее пользоваться не кулонами, а ампер-часами (А ч). Так как 1 Кл = 1 А ∙ с, то между ампер-часом и кулоном имеет место следующая зависимость: 1 А ∙ ч = 3600 А ∙ с = 3600 Кл.
|
|
|
Электрохимический эквивалент выражается в граммах, отнесенных к одному ампер-часу количества электричества (г/А ∙ ч), т. е. это количество массы вещества, выделившегося из электролита при прохождении через него одного ампер-часа количества электричества (таблица 2.6).
Если выразить электрохимический эквивалент для серебра в миллиграммах на ампер-секунду, то получим 1,118 мг/А∙с. Это значение длительное время служило эталоном единицы силы тока.
Из таблицы 2.6 видно, что для выделения определенного количества вещества необходимо значительное количество электричества. Поэтому электрохимические предприятия считаются самыми крупными потребителями электроэнергии.
Второй закон Фарадея. При одном и том же количестве электричества, протекающего через различные электролиты, количество массы веществ, выделившихся на электродах, пропорционально их химическим эквивалентам.
Из законов Фарадея вытекает, что электрохимические эквиваленты α пропорциональны их химическим эквивалентам α:

Следовательно, отношение электрохимических эквивалентов к химическим является величиной постоянной:
|
|
|

Второй закон Фарадея может быть выражен следующей формулой:

Оба закона можно выразить математически одной формулой:

Электролиз получил широкое применение в различных отраслях промышленности: в гальванопластике, гальваностегии, для очистки поверхности металлов.
Пример.Определить количество электричества и расход электроэнергии, необходимые на выделение 1 кг хлора, если напряжение химического источника тока составляет 4 В.
Решение.Количество электричества:

Расход электроэнергии:

Пример.Определить количество меди, выделившейся из раствора медного купороса (C11SO4) в течение 24 ч при токе 12 А.
Решение.Количество меди

Химические источники тока
Эти источники постоянного тока предназначены для преобразования химической энергии в электрическую. К ним относятся гальванические элементы и аккумуляторы.

Рисунок 2.8 - Гальванические элементы и аккумуляторы
Простейшим гальваническим элементом является медно-цинковый. В этом случае в стеклянный сосуд, наполненный водным раствором серной кислоты H2SO4, погружены медная и цинковая пластины. Медная пластина является положительным, а цинковая - отрицательным полюсом элемента.
|
|
|
При замыкании цепи элемента проводником внутри этого элемента будет проходить ток от цинковой отрицательнойпластины к медной положительной, а во внешней цепи - от медной к цинковой.
ЭДСмедно-цинкового элемента равна 1,1 В, внутреннее сопротивление в зависимости от времени работы - 5 - 10 Ом.
Наибольшее распространение получили угольно-цинковые элементы. У них положительным полюсом является угольный стержень, отрицательным - цинковый цилиндр. Электролитом служит водный раствор хлористого аммония (нашатыря) - NH4CI. Начальное напряжение такого элемента составляет примерно 1,5 В. Однако оно быстро падает из-за поляризации, т. е. скопления на положительном электроде водорода, который создает в совокупности с металлом электрода противоэлектродвижущую силу элемента. Кроме того, из-за покрытия угольного стержня слоем пузырьков водорода возрастает внутреннее сопротивление элемента. В качестве деполяризатора в угольно-цинковом элементе применяют агломерат - спрессованную смесь перекиси марганца и графита.
ЭДС угольно-цинкового элемента 1,4 - 1,5 В в начале разряда при среднем значении 0,9 - 1,1 В, а внутреннее сопротивление в зависимости от конструкции элемента - 0,25 - 0,7 Ом в начале разряда и 1,4 - 5 Ом в конце.
|
|
|
Угольно-цинковые элементы выпускаются в виде так называемых сухих элементов, которые широко применяются в электрических, электронных и радиотехнических устройствах. В настоящее время созданы миниатюрные и притом работоспособные элементы, которые могут год и более питать током электронные наручные часы. Для таких элементов применяются специальные электродные материалы и электролиты (окись ртути, амальгама цинка, раствор едкого кали).
Приборы, обладающие способностью накапливать электрическую энергию в результате химических процессов (заряжаться), сохранять ее в течение некоторого времени, а затем отдавать (разряжаться), называются аккумуляторами. При заряде аккумулятора получаемая им электрическая энергия преобразуется в химическую, а при разряде, наоборот, химическая энергия превращается в электрическую. Основными характеристиками аккумулятора являются емкость и коэффициент полезного действия. Емкость - это количество электричества, которое аккумулятор может отдать при разряде номинальным током до наинизшего допустимого напряжения. Под номинальной емкостью понимают количество электричества, которое отдает полностью заряженный аккумулятор при 10 - часовом режиме разряда и температуре 25 °С. Емкость измеряется в ампер-часах (А ∙ ч).
КПД аккумулятора - это отношение полученной при разряде аккумулятора энергии к затраченной при его заряде:

В среднем η = 0,75 - 0,8.
В зависимости от состава электролита аккумуляторы могут быть кислотными и щелочными.

Рисунок 2.9 - Кислотный аккумулятор
Кислотный аккумулятор состоит из групп положительных (РbО2) и отрицательных (Рb) пластин, размещенных в сосуде. Электролитом служит водный раствор серной кислоты (H2SO4). Пластины каждой группы соединяют друг с другом. При этом их располагают так, чтобы они входили друг в друга наподобие гребенок. Чтобы действующая поверхность была наибольшей, пластины делают ребристыми или придают им форму решетки.
Если отрицательные пластины соединить с минусом, а положительные - с плюсом источника тока, то начнется химическая реакция. В результате электролиза окисляется свинец на положительном электроде и образуется губчатый свинец на отрицательном.
Если отключить аккумулятор от источника тока и замкнуть его на приемник энергии, то он сам станет источником тока, электродами которого служат пластины, отличающиеся друг от друга по химическому составу.
Кислотные аккумуляторы применяются на электротехнических установках стационарного типа и на автотранспорте.

Рисунок 2.10 - Щелочной аккумулятор: 1 - активная масса; 2 - стальные перфорированные ленты; 3 - эбонитовые палочки; 4 - блок положительных пластин; 5 - полюсные выводы; 6 - пробка с отверстием для заливки электролита; 7 - крышка; 8 - блок отрицательных пластин; 9 - активная масса положительных пластин; 10 - активная масса отрицательных пластин; 11 - изоляция (винипласт, эбонит); 12 - пробка
Щелочные аккумуляторы в зависимости от материала электродов бывают кадмиево-никелевые, железоникелевые, серебряно-цинковые, золото-цинковые и газовые.
Широкое распространение получили кадмиево-никелевые и железоникелевые аккумуляторы. Они состоят из железных никелированных электродов, имеющих форму решетки, которая заполняется активной массой. Активная масса анода состоит из гидрата окиси никеля Ni(ОН)3, активная масса катода - из кадмия Cd или губчатого железа Fe. Электролитом служит раствор едкого кали (КОН). Электроды и электролит помещены в сосуд из никелированной тонкой листовой стали.
Серебряно-цинковый аккумулятор представляет собой пластмассовый сосуд, в котором помещены положительные и отрицательные электроды, составленные из отдельных пластин. Отрицательные электроды изготовляют из окиси цинка, положительные - из серебра.
Золото-цинковые аккумуляторы применяются редко из-за высокой стоимости.
Газовые аккумуляторы отличаются легкостью и дешевизной, но технология их производства еще недостаточно разработана.
Щелочные аккумуляторы не выделяют вредных испарений, не требуют тщательного ухода, не боятся сотрясений, менее чувствительны к коротким замыканиям, которые для кислотных аккумуляторов представляют большую опасность. Саморазряд у них меньше, чем у кислотных аккумуляторов.
Соединение источников ЭДС
Для составления аккумуляторной батареи или батареи гальванических элементов несколько элементов соединяют последовательно или параллельно. Встречается также групповое соединение, которое представляет собой комбинацию последовательного и параллельного соединения элементов.
Последовательное соединение (рисунок 2.11, а) применяют тогда, когда ток приемника не превышает номинального разрядного тока элемента, а напряжение приемника больше ЭДС отдельного элемента. Емкость батареи в этом случае равна емкости одного элемента, ЭДС батареи:

Внутреннее сопротивление:

где n - число последовательно включенных элементов в батарее;
Ео - ЭДС одного элемента;
rо - внутреннее сопротивление элемента.
Параллельное соединение (рисунок 2.11, б) применяют в том случае, когда напряжение приемника примерно равно ЭДС отдельного элемента, а ток потребителя больше разрядного тока элемента. Параллельное соединение допускается только при одинаковых ЭДС и внутренних сопротивлениях элементов. ЭДС батареи в этом случае равна
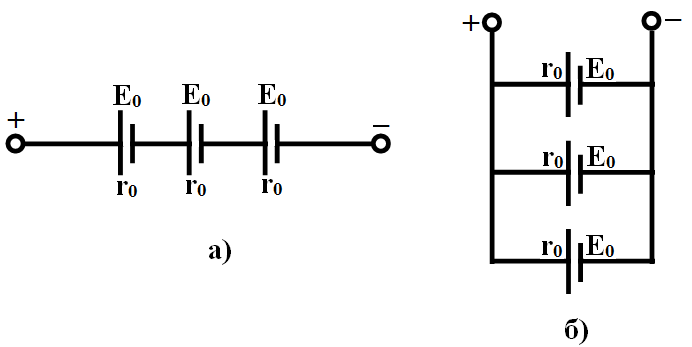
Рисунок 2.11 - Соединение источников ЭДС: а - последовательное; б - параллельное

Рисунок 2.12 -Электрическая цепь с двумя источниками ЭДС
ЭДС элемента Е = Ео, емкость батареи - сумме емкостей элементов, а внутреннее сопротивление:

При параллельном соединении батарея может дать приемнику ток

где m - число параллельно соединенных элементов в батарее;
Iраз - разрядный ток одного элемента.
Пример.Определить число и выбрать способ соединения аккумуляторов для питания электроэнергией аварийного освещения цеха. ЭДС аккумулятора Еo = 2 В, его разрядный ток Iраз = 8 А, мощность всех ламп Р = 2,2 кВт, напряжение U = 110В.
Решение.Ток потребителя:

Так как напряжение и ток потребителя больше, чем у одного элемента, то следует применить групповое соединение. Число параллельных групп:

Выбираем число групп m = 3.
В каждой группе нужно соединить последовательно n элементов

Общее число аккумуляторов

Пример.В цепи (рисунок 2.12) ЭДС первого источника E1 = 60 В, второго источника Е2 = 40 В. Внутренние сопротивления источников r01 = r02 = 0,5 Ом. Сопротивление электроприемника r = 4 Ом. Определить ток в цепи и напряжение на выводах источников и электроприемника. Источники ЭДС соединены последовательно согласно.
Решение.Ток в цепи:

Напряжение на выводах первого источника:

Напряжение на выводах второго источника:

Напряжение па выводах электроприемника:

Проверка:

КОНТРОЛЬНАЯ РАБОТА №2
«Электрические цепи постоянного тока»
Задание 1
Указать единицы измерения:
| 1. Плотность тока | |
| 2. Сила тока | |
| 3. Электрическая проводимость | |
| 4. Электрическое сопротивление | |
| 5. Удельное электрическое сопротивление | |
| 6. Электрическая мощность (активная) | |
| 7. ЭДС | |
| 8. Работа | |
| 9. Электрическая энергия | |
| 10. Диэлектрическая проницаемость |
Задание 2
Написать формулу:
| 1. Закон Ома для участка цепи | |
| 2. Закон Ома для полной цепи | |
| 3. Эквивалентное сопротивление при последовательном соединении | |
| 4. Эквивалентное сопротивление при параллельном соединении | |
| 5. Зависимость между сопротивлением при температуре 20 °С и сопротивлением при других температурах | |
| 6. Удельное сопротивление | |
| 7. Энергия источника | |
| 8. Мощность |
Задание 3
Решить задачу:
К групповому распределительному щитку присоединены три параллельные группы электроприемников, имеющие сопротивления r1 = 22 Ом; r2=10 Ом; r3=100 Ом. Ток в первой группе I1 = 10 А. Определить ток в магистральном проводе, а также напряжение на главном распределительном щите, расположенном от группового щитка на расстоянии 100 м, если магистраль выполнена двумя медными проводами сечением 10 мм2.

Задание 4
Решить задачу:
В учреждении установлено 40 ламп накаливания мощностью по 100 Вт каждая. Определить стоимость израсходованной электроэнергии за месяц (25 дней), если все лампы включаются ежедневно на 7 часов. Стоимость 1кВт ∙ ч - 4 руб.
Задание 5
Решить задачу:
Определить, до какой температуры нагрелась обмотка электродвигателя, выполненная из медного провода, если ее сопротивление до начала работы было 0,1 Ом (при температуре окружающей среды 20°С), а после окончания работы - 0,2 Ом; α = 0,004 °С-1. То же, если сопротивление после окончания работы 0,12 Ом.
Задание 6
Подчеркнуть материал с более высокой электрической проводимостью:
1. золото и медь;
2. константан и вольфрам;
3. нихром и фехраль;
4. латунь и сталь.
Задание 7
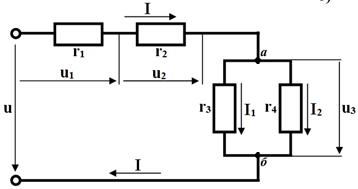
Найти эквивалентное сопротивление цепи, показанной на рисунке, если все сопротивления равны 1 Ом и найти ток I, если подведенное к цепи напряжение U= 2,5 В.
КОНТРОЛЬНАЯ РАБОТА №3
«Тепловое и химическое действие тока»
Задание 1
Указать единицы измерения:
| 1. Плотность тока | |
| 2. Количество электричества | |
| 3. электрохимический эквивалент α | |
| 4. Электрическое сопротивление | |
| 5. Удельное электрическое сопротивление | |
| 6. КПД | |
| 7. ЭДС | |
| 8. Работа | |
| 9. Электрическая энергия | |
| 10. Диэлектрическая проницаемость |
Задание 2
Написать формулу:
| 1. Первый закон Кирхгоффа | |
| 2. Второй закон Кирхгоффа | |
| 3. Закон Джоуля - Ленца | |
| 4. Соотношения между ккал и Дж | |
| 5. Соотношение между кВт∙ч и ккал и кДж | |
| 6. Потери напряжения | |
| 7. Сечение проводов (мм2) двухпроводной линии, при котором обеспечивается нормальное рабочее напряжение на зажимах потребителей электрической энергии | |
| 8. Первый закон Фарадея | |
| 9. Второй закон Фарадея | |
| 10. ЭДС батареи аккумуляторов |
Задание 3
Решить задачу:
В цепи ЭДС первого источника E1 = 60 В, второго источника Е2 = 40 В. Внутренние сопротивления источников r01 = r02 = 0,5 Ом. Сопротивление электроприемника r = 4 Ом. Определить ток в цепи и напряжение на выводах источников и электроприемника. Источники ЭДС соединены последовательно согласно.

Задание 4
Решить задачу:
Определить минимальное сечение алюминиевых изолированных проводов, необходимых для сооружения двухпроводной линии длиной 0,025 км (ввод в здание), по которой передается мощность 15 кВт при напряжении 220 В. Допускаемая нормами потеря напряжения не должна превышать 5%, минимально разрешенное по механической прочности сечение 16 мм2. Удельная проводимость материала провода 35 м/Ом∙мм2. Проверить полученное сечение на нагрев.
Задание 5
Решить задачу:
Определить количество электричества и расход электроэнергии, необходимые на выделение 1 кг хлора, если напряжение химического источника тока составляет 4 В. Электрохимический эквивалент а = 1,3212 г/А∙ч.
Задание 6
Решить задачу:
В резисторе r = 10 Ом при прохождении тока в течение t = 1ч выделяется 900 кДж теплоты. Определить ток, протекающий по резистору, и напряжение на его выводах.
Дата добавления: 2018-04-15; просмотров: 3503; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
