Подготовьте доклад, реферат или презентацию.
Лекция №Амины. Строение и свойства аминов предельного ряда. Анилин как представитель ароматических аминов.
План
1. Определение и классификация аминов
2.Нахождение аминов в природе
3.Номенклатура аминов
4.Изомерия аминов
5. Получение аминов
6.Физические свойства аминов
7. Химические свойства аминов
8. Применение
1.Амины– азотсодержащие органические вещества, производные аммиака (NH3), в молекулах которых один или несколько атомов водорода замещены на углеводородный радикал (- R или – CnH2n+1)
Функциональная группа: - NH2 аминогруппа
Классификация аминов:
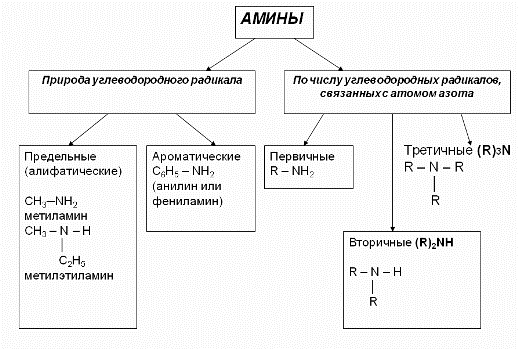 2. Нахождение аминов в природе
Соединения аминов широко распространены как в растительном, так и в животном мире, а также являются такими биологически активными веществами, как витамины, гормоны, промежуточные продукты обмена веществ. Также амины встречаются в природе в роли продуктов разложения, так как они образуются при гниении живых организмов. Продукты разложения белков дают запах селедочного рассола. Этот запах сигнализирует о присутствии аминов. В художественной литературе вы могли неоднократно сталкиваться с таким словосочетанием, как «трупный яд» - это также связано с присутствием аминов.
Из-за этого неприятного запаха низшие амины часто путали с аммиаком. Но французский химик Шарль Вюрц в 1849 году обратил внимание на различие между аминами и аммиаком. Оказывается, вся разница в том, что амины обладают способностью к горению на воздухе и при этом образуют углекислый газ.
3. Номенклатура аминов
1). В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин.
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в алфавитном порядке.
CH3-CH2-NH-CH3 Метилэтиламин
При наличии одинаковых радикалов используют приставки ди и три.
(CH3)2NH Диметиламин
2. Нахождение аминов в природе
Соединения аминов широко распространены как в растительном, так и в животном мире, а также являются такими биологически активными веществами, как витамины, гормоны, промежуточные продукты обмена веществ. Также амины встречаются в природе в роли продуктов разложения, так как они образуются при гниении живых организмов. Продукты разложения белков дают запах селедочного рассола. Этот запах сигнализирует о присутствии аминов. В художественной литературе вы могли неоднократно сталкиваться с таким словосочетанием, как «трупный яд» - это также связано с присутствием аминов.
Из-за этого неприятного запаха низшие амины часто путали с аммиаком. Но французский химик Шарль Вюрц в 1849 году обратил внимание на различие между аминами и аммиаком. Оказывается, вся разница в том, что амины обладают способностью к горению на воздухе и при этом образуют углекислый газ.
3. Номенклатура аминов
1). В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин.
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в алфавитном порядке.
CH3-CH2-NH-CH3 Метилэтиламин
При наличии одинаковых радикалов используют приставки ди и три.
(CH3)2NH Диметиламин
   2). Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2. В этом случае аминогруппа указывается в названии суффиксами амин (одна группа -NH2), диамин (две группы -NH2) и т.д. с добавлением цифр, отражающих положение этих групп в главной углеродной цепи.
Например:
CH3-CH2-CH2-NH2 пропанамин-1
H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3
4. Изомерия аминов
Структурная изомерия
- углеродного скелета, начиная с С4H9NH2:
2). Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2. В этом случае аминогруппа указывается в названии суффиксами амин (одна группа -NH2), диамин (две группы -NH2) и т.д. с добавлением цифр, отражающих положение этих групп в главной углеродной цепи.
Например:
CH3-CH2-CH2-NH2 пропанамин-1
H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3
4. Изомерия аминов
Структурная изомерия
- углеродного скелета, начиная с С4H9NH2:
 
  - положения аминогруппы, начиная с С3H7NH2:
- положения аминогруппы, начиная с С3H7NH2:
 - изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте, т.е. между типами аминов:
- изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте, т.е. между типами аминов:
 Пространственная изомерия
Возможна оптическая изомерия, начиная с С4H9NH2:
Пространственная изомерия
Возможна оптическая изомерия, начиная с С4H9NH2:
 5. Получение аминов
Из-за запаха низшие амины долгое время принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на воздухе с образованием углекислого газа. Он же синтезировал метиламин и этиламин.
1842 г Н. Н. Зинин получил анилин восстановлением нитробензола - в промышленности
Восстановление нитросоединений:
R-NO2 + 6[H] t,kat-Ni → R-NH2 + 2H2O
или
R-NO2+3(NH4)2S t, Fe в кислой среде →R-NH2 +3S↓ +6NH3↑ + 2H2O (р. Зинина)
Другие способы:
1). Промышленный
CH3Br + 2NH3 t, ↑p → CH3-NH2 + NH4Br
2). Лабораторный - Действие щелочей на соли алкиламмония
(получение первичных, вторичных, третичных аминов):
[R-NH3]Г + NaOH t → R-NH2 + NaГ + H2O
3). Действием галогеналканов на первичные алифатические и ароматические амины получают вторичные и третичные амины, в том числе, смешанные.
5. Получение аминов
Из-за запаха низшие амины долгое время принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на воздухе с образованием углекислого газа. Он же синтезировал метиламин и этиламин.
1842 г Н. Н. Зинин получил анилин восстановлением нитробензола - в промышленности
Восстановление нитросоединений:
R-NO2 + 6[H] t,kat-Ni → R-NH2 + 2H2O
или
R-NO2+3(NH4)2S t, Fe в кислой среде →R-NH2 +3S↓ +6NH3↑ + 2H2O (р. Зинина)
Другие способы:
1). Промышленный
CH3Br + 2NH3 t, ↑p → CH3-NH2 + NH4Br
2). Лабораторный - Действие щелочей на соли алкиламмония
(получение первичных, вторичных, третичных аминов):
[R-NH3]Г + NaOH t → R-NH2 + NaГ + H2O
3). Действием галогеналканов на первичные алифатические и ароматические амины получают вторичные и третичные амины, в том числе, смешанные.
 6. Физические свойства аминов
Метиламин, диметиламин и триметиламин — газы, средние члены алифатического ряда - жидкости, высшие — твердые вещества. Низшие амины имеют характерный «рыбный» запах, высшие не имеют запаха.
Связь N–H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О–Н).
6. Физические свойства аминов
Метиламин, диметиламин и триметиламин — газы, средние члены алифатического ряда - жидкости, высшие — твердые вещества. Низшие амины имеют характерный «рыбный» запах, высшие не имеют запаха.
Связь N–H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О–Н).
 Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой. Например:
Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой. Например:
 Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов (триэтиламин кипит при 89 °С, ан-гексиламин – при 133 °С).
По сравнению со спиртами алифатические амины имеют более низкие температуры кипения (т. кип.метиламина -6 °С, т. кип. метанола +64,5 °С). Это свидетельствует о том, что амины ассоциированы в меньшей степени, чем спирты, поскольку прочность водородных связей с атомом азота меньше, чем с участием более электроотрицательного кислорода.
При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха. Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов (триэтиламин кипит при 89 °С, ан-гексиламин – при 133 °С).
По сравнению со спиртами алифатические амины имеют более низкие температуры кипения (т. кип.метиламина -6 °С, т. кип. метанола +64,5 °С). Это свидетельствует о том, что амины ассоциированы в меньшей степени, чем спирты, поскольку прочность водородных связей с атомом азота меньше, чем с участием более электроотрицательного кислорода.
При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха. Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
 Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины в воде практически не растворяются.
Анилин (фениламин) С6H5NH2 – важнейший из ароматических аминов:
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
7. Химические свойства аминов
I. Основные свойства
Для аминов характерны основные свойства, которые обусловлены наличием не поделённой электронной пары на атоме азота
Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины в воде практически не растворяются.
Анилин (фениламин) С6H5NH2 – важнейший из ароматических аминов:
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
7. Химические свойства аминов
I. Основные свойства
Для аминов характерны основные свойства, которые обусловлены наличием не поделённой электронной пары на атоме азота
  Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
 Ряд увеличения основных свойств аминов:
Ряд увеличения основных свойств аминов:
В растворах оснoвные свойства третичных аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три радикала создают пространственные препятствия для сольватации образующихся аммониевых ионов. По этой же причине основность первичных и вторичных аминов снижается с увеличением размеров и разветвленности радикалов.
Водные растворы аминов имеют щелочную реакцию (амины реагируют с водой по донорно-акцепторному механизму):
ион алкиламмония Анилин с водой не реагирует и не изменяет окраску индикатора!!! Взаимодействие с кислотами (донорно-акцепторный механизм): CH3-NH2 + H2SO4 → [CH3-NH3]HSO4 (соль - гидросульфат метиламмония) 2CH3-NH2 + H2SO4 → [CH3-NH3]2SO4 (соль - сульфат метиламмония) Соли неустойчивы, разлагаются щелочами: [CH3-NH3]2SO4 + 2NaOH → 2CH3-NH2 ↑ + Na2SO4 + H2O Способность к образованию растворимых солей с последующим их разложением под действием оснований часто используют для выделения и очистки аминов, не растворимых в воде. Например, анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном состоянии. II. Реакции окисления Реакция горения (полного окисления) аминов на примере метиламина: 4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2 Ароматические амины легко окисляются даже кислородом воздуха. Являясь в чистом виде бесцветными веществами, на воздухе они темнеют. Неполное окисление ароматических аминов используется в производстве красителей. Эти реакции обычно очень сложны. III. Особые свойства анилина Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимнымвлияниематомов.
1). Для анилина характерны свойства бензольного кольца – действие аминогруппы на бензольное кольцо приводит к увеличению подвижности водорода в кольце в орто- и пара- положениях: С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Эта реакция может использоваться для качественного и количественного определения анилина: 2). Свойства аминогруппы: С6Н5NН2 + HCl → [С6Н5NН3 ]+Сl- хлорид фениламмония Применение Амины используют при получении лекарственных веществ, красителей и исходных продуктов для органического синтеза. Гексаметилендиамин при поликонденсации с адипиновой кислотой дает полиамидные волокна. Анилин находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты). 9. Вредное воздействие на организм Следует знать, что амины – это вещества, которые довольно таки токсичны. Они представляют опасность при вдыхании их паров, а также при контакте с кожным покровом. А такие амины, как, например, анилин, обладает способностью проникновения через кожу в кровь и может нарушить функции гемоглобина, и тем самым привести к летальному исходу. При попадании аминов в кровь появляются такие симптомы, как одышка, посинение губ, носа и кончиков пальцев. Также при отравлении наблюдается учащенное дыхание и сердцебиение. А в некоторых случаях может дойти и до потери сознания. В случае отравления или попадания амина на незащищенные участки кожи, необходимо как можно быстрее, очистить пораженный участок кожного покрова с помощью спирта и ваты. Но это следует делать очень аккуратно, стараясь не увеличивать пораженные участки кожи. В случае отравления парами аминов, следует сразу же пострадавшему обеспечить доступ к свежему воздуху и вызвать врача. При отравлении алифатическими аминами может произойти нарушение функций печени, поражение нервной системы и проницаемости кровеносных сосудов. Вдыхание ароматических аминов может привести к угнетению центральной нервной системы, а также вызвать рак мочевого пузыря.
Практическое задание Давайте с вами проведем небольшой опыт. Для этого мы берем и наливаем в пробирку 0,5 мл анилина. Теперь возьмем и взболтаем содержимое. Вопрос: Какую реакцию вы наблюдаете? А сейчас давайте в эту же пробирку добавим соляную кислоту и понаблюдаем до полного растворения анилина в воде.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ: 1. Как вы думаете, почему происходит растворение анилина, после того, как мы добавили соляную кислоту? 2. Запишите эту реакцию в виде уравнения. 3. Попробуйте рассчитать массу вещества, которое образовалось. 4. Назовите известные вам классы органических веществ. 5. Какие азотосодержащие соединения вам известны? Назовите их и запишите их формулы. 6. Как использование аминов на предприятиях влияет на окружающую среду? 7. В чем различие между аммиаком и аминами? 8. Назовите сходные свойства аммиака и аминов.
Задания для самостоятельного выполнения: 1. Продолжите определение: Аминами называют органические производные аммиака, в которых…………. 2. Приведите примеры различных типов аминов и назовите их: а) первичный амин………………………………. ……………………… б) вторичный амин………………………………………………………. в) третичный амин……………………………………………………….. г) ароматические амины…………………………………………………
3. Какое из утверждений правильное? А) Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называют ароматическими. Б) Амины, содержащие в своем составе ароматическое кольцо, называют ароматическими. 4. Напишите структурные формулы аминов состава С4Н11N и назовите их. 5.При сгорании первичного амина массой 62 грамма образовалось 88 граммов СО2 и 90 граммов Н2О. Найдите формулу амина. 6. Напишите реакции получения анилина из метана (СН4 → С6Н5NН2). 7. Лекарственный препарат парацетомол можно получить по схеме:
8. Лекарственный препарат анестезин можно получить по схеме:
Расшифруйте эту схему и назовите органические вещества Х1 – Х3. Подсказка: название анестезина – этил-пара-аминобензоат.
Подготовьте доклад, реферат или презентацию. Перечень тем: 1. Метиламин: получение, применение. 2. Триметиламин: свойства, получение, применение. 3. Анилин: получение, свойства, применение.
1.Зурабян, С.Э.,Лузин,А.П. Органическая химия: учебник/Под редакцией Н.А. Тюкавкиной. - М.:ГЭОТАР – Медиа, 2011. (с.203-219, упр.№1-9 с. 218-219)
|
Дата добавления: 2018-04-15; просмотров: 397; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!





 Расшифруйте эту схему и назовите органические вещества Х1– Х4.
Расшифруйте эту схему и назовите органические вещества Х1– Х4.