Вторичный тетанус (опыт Маттеучи)
К. Маттеучи показал, что можно вызвать сокращение мышц нервно-мышечного препарата, прикладывая нерв к сокращающимся мышцам другого препарата. Этот опыт свидетельствует о том, что в сокращающейся мышце возникают токи, причем настолько значительные, что их можно использовать в качестве раздражителя для нерва другого препарата. Эти токи получили название токов действия.
Для работы необходимы: стимулятор, держатель, набор препаровальных инструментов, раствор Рингера.
Объект исследования – два нервно-мышечных препарата лягушки.
Проведение работы. Готовят два препарата задних лапок лягушки. Мышцы бедра удаляют, а обе лапки за бедренную кость укрепляют в держателях (рис. 85). Нерв одного препарата помещают на электроды, а нерв другого располагают вдоль икроножной мышцы первого. Ритмически раздражая нерв вызывают тетаническое сокращение мышц первого препарата, наблюдают за сокращениями мышц второго.
Результаты работы и их оформление. Зарисуйте схему проведения опыта. Объясните механизмы возникновения токов действия.
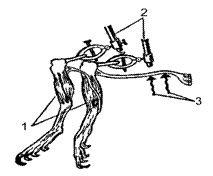
Рис. 85. Опыт Маттеучи:
1 – нервно-мышечные препараты лягушки; 2 – держатели; 3 – раздражающие электроды
Р а б о т а 8
ИЗМЕРЕНИЕ МЕМБРАННОГО ПОТЕНЦИАЛА
МЫШЦЫ ЛЯГУШКИ
Если внутрь нервной или мышечной клетки ввести один электрод, а второй поместить в окружающем клетку растворе или ткани, то между электродами обнаруживается разность электрических потенциалов – мембранный потенциал покоя. Внутренняя область клетки при этом всегда электроотрицательна относительно наружной среды. Потенциал покоя измеряют как разность между потенциалами цитоплазмы и наружной среды клетки, поэтому он всегда обозначается со знаком минус. О существовании разности потенциалов свидетельствует скачок потенциала, возникающий в момент прокола электродом мембраны клетки. Если электроды соединены с помощью усилителя постоянного тока с осциллографом, то этот скачок потенциала вызывает резкое смещение луча осциллографа с изоэлектрической линии вниз (рис. 86).
|
|
|
Для работы необходимы: лабораторный рН-метр (например, ЛПЧ-02), стеклянные микроэлектроды, заполненные ЗМ раствором КСl (диаметр кончика порядка 0,5–1 мкм), два серебряных электрода, микроманипулятор, камера из органического стекла для помещения и фик-
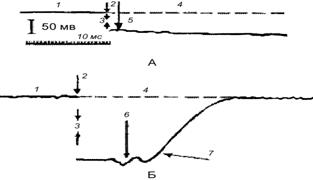
Рис. 86. Внутриклеточное отведение биопотенциалов от нервной
(пирамидная клетка коры мозга – А)и мышечной клеток
(поперечнополосатая мышца кошки – Б):
1 – внеклеточная запись; 2 – момент прокола мембраны и вхождения микроэлектрода в клетку; 3 – величина разности потенциалов между внутренней и наружной поверхностями мембраны (мембранный потенциал); 4 – линия; определяющая исходное (нулевое) значение потенциала; 5 – одиночный спонтанный разряд клетки; 6 – колебания, связанные с давлением микроэлектрода на внутреннюю поверхность мембраны мышечной клетки; 7 – момент прокола мембраны
|
|
|
и выхода микроэлектрода из мышечной клетки
сации препарата, набор препаровальных инструментов, раствор Рин-гера.
Объект исследования – лягушка.
Проведение работы. Измерение мембранного потенциала мышечных волокон производят стеклянными микроэлектродами с помощью рН-метра, используемого как высокоомный милливольтметр. Необходимо включать в сеть рН-метр не менее чем за 1 ч до начала измерений. В работе используют портняжную мышцу лягушки. Лягушку обездвиживают. На сухожилие у колена накладывают лигатуру, а у сращения бедренных костей лигатуру накладывают на конец мышцы. Отпрепарированную мышцу укрепляют в камере из органического стекла внутренней стороной вверх, слегка растянув ее. Камеру заполняют раствором Рингера. Вскрывают оболочку мышцы, чтобы при введении не обламывался кончик микроэлектрода.
Камеру укрепляют на стеклянном столике от настольной лупы под бинокуляром. Стеклянный микроэлектрод, предварительно заполненный ЗМ раствором КСl, фиксируют в препаратоводителе, который укреплен на универсальном штативе над камерой для препарата. Препаратоводитель используют в качестве микроманипулятора для введения микроэлектрода в клетку. К входному кабелю рН-метра припаяны два серебряных электрода, которые непосредственно перед опытом хлорируются.
|
|
|
Хлорирование проводят в 1%-ном растворе NaCl. Источником тока служит батарейка для карманного фонарика (4,5 В), анодом – оба серебряных электрода одновременно, катодом – графитовый стержень. Для регулирования силы пропускаемого тока в цепь включен реостат. Подбирают такую величину тока, чтобы за 2–3 с поверхность электрода покрылась ровным белым слоем AgCl. Затем один из серебряных электродов погружают в раствор КСl, который заполняет широкую часть микроэлектрода, а другой опускают в раствор Рингера, заполняющий камеру с мышцей.
Перед началом введения микроэлектрода в мышцу ручку «Виды работ» рН-метра устанавливают в положение «рН». Переключатель «Пределы измерений» устанавливают в положение «2–6 рН», тогда шкала соответствует напряжению от 0 до 400 мВ с ценой деления 5 мВ.
|
|
|
Опускают микроэлектрод в камеру с раствором Рингера и измеряют межэлектродный потенциал. После этого вводят микроэлектрод в мышечное волокно, медленно вращая микровинт препаратоводителя. О попадании электрода внутрь клетки судят по отклонению стрелки рН-метра. Измеряют мембранный потенциал у 10–15 мышечных волокон, причем перед каждым введением микроэлектрода сначала измеряют меж-электродный потенциал.
Мембранный потенциал определяют как разность между потенциалом, возникшим при введении микроэлектрода в мышечное волокно, и межэлектродным потенциалом. Например, если межэлектродный потенциал равен +15 мВ, а после введения микроэлектрода стрелка рН-метра отклонилась на 95 мВ, то мембранный потенциал данного волокна равен 80 мВ.
Результаты работы и их оформление. Вычислите среднее значение мембранного потенциала одиночного мышечного волокна скелетной мышцы лягушки. Обсудите природу мембранного потенциала.
Р а б о т а 9
Дата добавления: 2018-04-04; просмотров: 9242; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
