Образование и разрушение растворов высокомолекулярных веществ
Цель работы- изучить зависимость степени набухания ВМС от рН среды, познакомиться с явлением высаливания ВМС и исследовать защитное действие желатина при электролитной коагуляции лиофобных золей.
Теоретическая часть
К высокомолекулярным соединениям (ВМС) относятся вещества, имеющие молекулярную массу десятки и сотни тысяч углеродных единиц. Растворы ВМС в родственных растворителях представляют собой гомогенные системы, неограниченно устойчивые и термодинамически равновесные. Например, растворы белков, полисахаридов и т. д. Однако процесс растворения ВМС обладает рядом особенностей, отличающих его от растворения низкомолекулярных веществ.
Растворение ВМС происходит в течение длительного времени и начинается оно с набухания. Различают четыре стадии растворения ВМС.
1) Контакт растворителя и ВМС - происходит энергетическое взаимодействие между растворителем и ВМС. На этой стадии система двухфазна.
2) Диффузия молекул растворителя в ВМС – набухание. Стадия продолжительна. Система двухфазна: первая фаза – набухший полимер, вторая фаза - избыток растворителя. Необходимо отметить, что набухший полимер можно считать однофазной системой – раствор растворителя в ВМС. Эту систему называют студень.
3) Диффузия макромолекул ВМС в растворитель. Система двухфазна: первая фаза – набухший ВМС (студень), вторая фаза – раствор ВМС в растворителе.
|
|
|
4) Выравнивание концентраций этих двух растворов (ВМС в растворителе и растворитель в ВМС). Полная двусторонняя диффузия может привести в итоге к однофазной системе – раствору ВМС в растворителе.
Процесс растворения ВМС может заканчиваться на второй или третьей стадии. Следовательно, существуют:
1) ограниченное набухание, которое заканчивается образованием студня. Процесс растворения заканчивается на второй или третьей стадии;
2) неограниченное набухание, которое заканчивается образованием однофазной системы. В этом случае идёт и четвёртая стадия процесса.
Для количественной характеристики процесса набухания вводится понятие степени набухания – 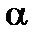 .
.
 (1)
(1)
или  (2)
(2)
где m - вес набухшего ВМС,  - вес сухого ВМС, h - высота столба набухшего ВМС,
- вес сухого ВМС, h - высота столба набухшего ВМС,  - высота столба сухого ВМС.
- высота столба сухого ВМС.
Кинетика процесса набухания выражается тремя видами кривых (рисунок 12.1) Степень набухания зависит от температуры, давления природы ВМС и растворителя. На степень набухания ВМС – амфолитов сильное влияние оказывает характер среды (pH) (рисунок 12.2)
Дело в том, что ВМС – амфолиты, например белки, способны диссоциировать и по кислотному и по основному механизму. Покажем это на примере аминокислот, из которых и состоят белки:
|
|
|
1) рН < i NH2-R-COOH+H2O ⇆ [NH3-R-COOH]++OH-
2) pH > i NH2-R-COOH ⇆ NH2-R-COO-+H+
В изоэлектрической точке (i) макромолекула электронейтральна и сворачивается в плотную глобулу.


| Рисунок 12.1 - Кинетика различных вариантов процесса набухания: 1 - ограниченное набухание; 2 - неограниченное набухание; 3 - ограниченное набухание с частичным растворением ВМС |
| Рисунок 12.2 - Зависимость степени набухания ВМС – амфолитов от рН среды |
Вещество, состоящее из молекул, свёрнутых в плотную упаковку, естественно, набухает медленно. При рН<i и pH>i отдельные звенья макромолекул приобретают одноимённые заряды, отталкивание которых приводит к раскручиванию плотных упаковок - упрощается диффузия растворителя в ВМС.
Если к водному раствору ВМС добавлять неорганическую соль (электролит), то при определённой концентрации соли начинается выделение ВМС в осадок – этот процесс называется высаливанием. Высаливание связано с тем, что добавленный электролит связывает воду, как бы увеличивая концентрацию ВМС. Высаливание – процесс обратимый: если после высаливания добавить растворитель, то вновь произойдёт растворение ВМС.
|
|
|
Практическая часть
1. Изучение зависимости степени набухания желатина от рН раствора
В шесть сухих пробирок насыпьте по 1 см3 сухого порошка желатина (желатин – смесь белковых веществ животного происхождения), пронумеруйте их и в каждую налейте одинаковый объём буферного раствора с определённым значением рН согласно таблице 12.1.
рН каждого раствора вычислите по формуле (3):
 ;
;  (3)
(3)
Таблица 12.1 - Приготовление буферных растворов для изучения зависимости степени набухания желатина от рН раствора и результаты измерений
| № пробирки | 1 | 2 | 3 | 4 | 5 | 6 |
 (мл) (мл)
| 10 | |||||
 (мл) (мл)
| 9 | 7 | 5 | 3 | 1 | |
 (мл) (мл)
| 1 | 3 | 5 | 7 | 9 | |
| Кислотность, рH | ||||||
| Высота столба набухшего полимера, h | ||||||
| Степень набухания, α |
Оставьте желатин набухать в течение 30 минут. Через 30 минут измерьте высоту столбика набухшего желатина (h), рассчитайте степень набухания (по формуле 2), постройте график зависимости степени набухания желатина от рН - среды (рисунок 12.2) и найдите изоэлектрическую точку i.
|
|
|
2. Высаливание желатина из раствора
В две колбы налейте одинаковый объём (5 … 10 мл) 1 %-го раствора желатина и по каплям добавьте из мерного цилиндра в одну из колб насыщенный раствор (NH4)2SO4 до появления хлопьев. Во вторую колбу по каплям добавляйте такое же количество разбавленного раствора (NH4)2SO4.
Проверьте обратимость процесса высаливания при разбавлении водой.
3. Защитное действие желатина при электролитной коагуляции лиофобных золей
Приготовьте отрицательно заряженный золь AgI (10 мл 0,1н. KI и 2 мл 0,1н. AgNO3). Разделите его пополам в две колбочки. В одну колбочку добавьте 0,5 … 1 мл 1 %-го раствора желатина. Незащищённый золь коагулируют по каплям раствором Al(NO3)3 из бюретки. Такое же количество электролита добавьте к защищённому золю. Наблюдения зафиксируйте в рабочем журнале (тетради).
Вопросы для самоконтроля
1. Как происходит растворение ВМС?
2. Что называют застудневанием и набуханием?
3. Что такое степень набухания ВМС?
4. Пояснить механизм высаливания ВМС.
5. Что такое изоэлектрическая точка?
6. Как влияют характер растворителя, температура, рН раствора и другие факторы на степень набухания ВМС?
7. Приведите примеры ограниченного и неограниченного набухания ВМС.
8. В чем сходство и отличие студней от золей и гелей?
Лабораторная работа № 13
Дата добавления: 2018-04-05; просмотров: 501; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
