III. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность. 5 страница

Рисунок 2.10. Зависимость первой энергии ионизации (эВ) от порядкового номера атома (Z).
Из этой диаграммы видно, что энергия ионизации увеличивается по мере движения по периоду, достигает максимума у благородного газа (He, Ne, Ar, Kr, Xe), а при переходе к щелочному металлу скачкообразно уменьшается.
Энергетический эффект присоединения электрона к нейтральному атому называется «сродством к электрону». Сродство к электрону характеризует окислительные или неметаллические свойства атома элемента. Принимая электроны, атом превращается в отрицательно заряженный ион. Эта величина так – же выражается в кДж/моль, либо в эВ/атом. В периодах слева направо сродство к электрону и окислительные свойства элементов возрастают. В группах сверху вниз сродство к электрону, как правило, уменьшается.
Электроотрицательность - способность атома химического элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения. Эта способность зависит от энергии ионизации атома и его сродства к электрону. Существует множество способов оценки электроотрицательности, но относительное положение элементов в этих шкалах не меняется. В периодах наблюдается общая тенденция роста величины электроотрицательности, а в подгруппах - ее падения.
Сопоставляя эти свойства несложно догадаться, что элементы, которые в химических реакциях активно присоединяют к себе электроны (маленький атомный радиус, высокие энергия ионизации и сродство к электрону, большая электроотрицательность), находятся в верхних периодах в правой части таблицы (кислород, азот, фтор). Эти элементы типичные неметаллы. Элементы, которые предпочитают электроны отдавать (большой атомный радиус, маленькие энергия ионизации, сродство к электрону и электроотрицательность) находятся в нижних периодах в левой части таблицы (натрий, калий, цезий, франций). Это металлы. Сильные металлы и неметаллы обладают очень высокой химической активностью. Так вода в атмосфере фтора горит, а реакция воды с калием может протекать со взрывом.
|
|
|
Пример решения задачи на тему «Строение атома»
Задание: описать электронную конфигурацию атома скандия.
Решение: Скандий (Sc) – 21й элемент периодической таблицы, следовательно, в его конфигурации должен быть 21 электрон.
Начинаем с первого уровня. Главное квантовое число равно 1. Орбитальное квантовое число на первом уровне может быть равным только 0 (l=n-1=1-1=0). Магнитное квантовое число может быть равно только 0. Значит, на первом уровне имеется только одно s-облако, на котором по правилу Хунда находятся два электрона. Конфигурация первого уровня скандия 1s2  . Осталось 19 электронов.
. Осталось 19 электронов.
|
|
|
На втором уровне главное квантовое число равно 2. Орбитальное может быть равным 0 и 1 (l=0…n-1). На s подуровне существует только одно s-облако (магнитное число = 0), а на p подуровне три облака (ml=-l…+l=-1,0,+1). Электронов в атоме достаточно для полного заселения этих орбиталей. Конфигурация второго уровня скандия 2s2  2p6
2p6 

 . Осталось 11 электронов.
. Осталось 11 электронов.
На третьем уровне главное число равно 3. Орбитальное число может быть равно 0, 1 и 2. Для s и p подуровней ситуация аналогична. 3s2  3p6
3p6 

 . Для их заполнения нужны 8 электронов, осталось 3. 3d подуровень по правилу Клечковского начнет заполняться после подуровня 4s.
. Для их заполнения нужны 8 электронов, осталось 3. 3d подуровень по правилу Клечковского начнет заполняться после подуровня 4s.
На четвертом подуровне электронов хватит только для заполнения орбитали 4s. Оставшийся электрон будет размещен на 3d подуровне. Конфигурация валентных подуровней скандия 4s2  3d1
3d1 



 .
.
Ответ: 21Sc 1s2  2s2
2s2  2p6
2p6 

 3s2
3s2  3p6
3p6 

 4s2
4s2  3d1
3d1 




Вопросы для самоконтроля.
1. Что такое протоны, нейтроны и электроны? Как они распределены в атоме?
2. Какие возможны комбинации строения атомных ядер? Как различить их друг от друга?
3. Какие особенности приходится учитывать при описании движения электрона?
4. Что такое электронное облако?
5. Как охарактеризовать электрон и электронное облако в атоме?
|
|
|
6. В чем заключается принципиальное различие между исходной и современной формулировками периодического закона?
7. Какую информацию можно получить из периодической таблицы?
8. Как меняются свойства атомов по мере роста заряда их ядер?
Задания для самоконтроля.
1. Описать электронную конфигурацию атома Ca и определить его принадлежность к электронному семейству.
2. Описать электронную конфигурацию атома Cl и определить его принадлежность к электронному семейству.
3. Описать электронную конфигурацию атома Mn и определить его принадлежность к электронному семейству.
Глава 3. Химическая связь.
3.1. Образование и свойства ковалентной связи
Теперь, когда нам известно как именно распределяются электроны в электронной оболочке атома – когда мы можем использовать понятие электронная конфигурация и описывать её – пришло время познакомиться с тем, как атомы образуют друг с другом химические связи. Химическая связь обычно определяется как результат сложного взаимодействия между электронами взаимодействующих атомов по квантово-механическим законам, а так – же протонами в их ядрах. Количественно химическую связь можно описать с помощью следующих величин:
|
|
|
1) Длина связи (l),
2) Энергия связи (Eсв),
3) Валентный угол (θ).
Кроме того, в зависимости от того, как распределяются, электроны между атомами выделяют три типа химических связей:
1) Ковалентную,
2) Ионную,
3) Полярную.
Однако, прежде опишем возникновение химической связи в рамках современных методов, и по мере повествования будем работать с этими понятиями. Образование химической связи описывается двумя методами:
· Методом Валентных Связей (МВС);
· Методом Молекулярных Орбиталей (ММО).
Теоретические предсказания этих методов в своём высшем развитии близки, не смотря на то, что в их основе лежит разные представление о химической связи[27]. С точки зрения МВС химическая связь является «собственностью» только той пары атомов, между которыми она возникла. А с точки зрения ММО химическая связь является «собственностью» всей молекулы. Использование метода ММО удобно, если речь идет о больших электронных облаках, которые формируются при участии более чем двух атомов. Например, в молекуле бензола существует единое π-электронное облако, охватывающее целых 6 атомов углерода (рисунок 3.1):

Рисунок 3.1. Слияние 6 электронных облаков в молекуле бензола в единую систему.
В рамках курса общей химии рассматривается образование химической связи с позиций МВС, ММО – же проходится в курсе физической химии несколько позже.
Основные положения метода валентных связей:
I. Химическая связь образуется двумя валентными электронами различных атомов с антипараллельными спинами. При этом происходит перекрывание электронных облаков и между атомами возникает зона с повышенной электронной плотностью. Это приводит к уменьшению потенциальной энергии системы.
Обычно эти процессы иллюстрируются на примере молекулы водорода, которая состоит из двух атомов (рисунок 3.2):
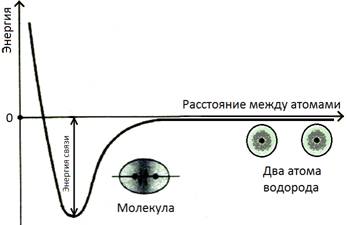
Рисунок 3.2. Образование химической связи между атомами водорода.
У двух атомов водорода имеется некий запас энергии, который на этой диаграмме условно обозначен нулевым (0). Пока атомы находятся далеко друг от друга, и их электронные облака не взаимодействуют, этот уровень энергии не меняется (правая часть диаграммы). По мере сближения атомов их электронные облака начинают взаимодействовать, при этом меняется движение электронов, расположенных на этих облаках. В итоге это сближение приводит к слиянию (т.н. «перекрыванию») двух электронных облаков и образования нового, общего на два атома. Для этого общего, молекулярного облака действуют те – же правила, что и для обычной атомной орбитали (принцип наименьшей энергии, запрет Паули). При формировании этого облака меняется и значение волновой функции электронов: если ранее электроны на одинаковом расстоянии от ядра можно было найти с одинаковой вероятностью, то теперь большую часть времени они проводят между двумя ядрами, формируя общую электронную пару (рисунок 3.3) [28]:

Рисунок 3.3. Перекрывание электронных облаков.
На этом рисунке общая электронная пара находится в области перекрывания (заштрихованная область).
При образовании общей электронной пары падает уровень энергии, поэтому, согласно принципу минимума энергии, такой процесс является выгодным. Однако, сближение атомов не происходит бесконечно. На некотором расстоянии силы отталкивания ядер атомов (ядра заряжены положительно, а одноименные заряды отталкиваются) уравновесят процесс дальнейшего слияния электронных облаков (на рисунке 3.2 это состояние соответствует минимуму энергии, т.н. «потенциальной яме»). При попытке дальнейшего сближения, из-за действия сил отталкивания будет резко возрастать уровень энергии (левая часть рисунка 3.2). Это равновесное расстояние между двумя центрами ядер называется длиной связи (l). Длина связи обычно измеряется в нанометрах (нм, 10-9м) или ангстремах (Å, 10-10м).
Та энергия, которая выделяется атомами при формировании химической связи, называется энергией связи (Есв). Энергия связи измеряется в Дж/моль, либо Эв/моль. Эта величина характеризует прочность химической связи. Если мы хотим разделить атомы, разрушить химическую связь, то это количество энергии мы должны сообщить молекуле. Поэтому энергию связи можно определять двояко: это и то количество энергии, которое выделяется при формировании химической связи, и то количество энергии, которое нужно затратить на разрушение этой связи. Ниже приведены длины связей и их энергии для некоторых простых веществ (таблица 3.1):
Таблица 3.1. Энергия и длины связей некоторых веществ
| Связь | Есв, кДж/моль | l, Å |
| H – H Cl – Cl Br – Br I – I H – Cl H – Br H - I | 435,1 238,9 190,3 152,7 431,0 366,0 299,5 | 0,74 1,99 2,28 2,67 1,28 1,41 1,60 |
Как уже было сказано выше, молекулярное облако подчиняется запрету Паули. Следовательно, на этом облаке не могут находиться два электрона с одинаковым спином. При сближении атомов, электроны которых имеют одинаковый спин, не произойдет перекрывания электронных облаков, а энергия такой структуры будет расти. Это проиллюстрировано ниже (рисунок 3.4):

Рисунок 3.4. Перекрывание электронных облаков.
Случай 1 – перекрывание электронных облаков, электроны которых имеют разный (антипараллельный) спин. Случай 2 – отталкивание электронных облаков, электроны которых имеют одинаковый (параллельный) спин. Как видно из этой диаграммы, в первом случае процесс энергетически выгоден, и химическая связь образуется, во втором процесс сближения энергетически невыгоден, и химическая связь не формируется.
Кроме того, из первого положения видно, что химическая связь является результатом взаимодействия и электронов, которые формируют новое электронное облако, и протонов, вокруг электрического поля которых, происходит формирование этого облака.
В приведенном выше примере не имеет значения, в каком направлении производить перекрывание, у двух s-облаков, имеющих форму шара, все направления перекрывания будут равноценны. Однако, если у атома имеются облака другой формы, то направление их перекрывания начинает играть важную роль, что отражается вторым положением МВС.
II. В пространстве связь располагается по направлению, в котором возможность перекрывания электронных облаков наибольшая.
Из второго положения следует, что существуют определенные способы перекрывания электронных облаков, отличающиеся направлением. А, значит, у химической связи есть такая характеристика, как валентный угол. Валентный угол (θ) – это угол между прямыми, соединяющими центры ядер атомов в молекуле. Величина валентного угла зависит от электронной конфигурации атомов, входящих в состав молекулы. У молекул, которые состоят из 2 атомов валентный угол, очевидно, равен 1800, а такая молекула имеет форму линии (обладает линейной конфигурацией). Но если молекула состоит уже из трёх атомов, то появляется два варианта её пространственной конфигурации: линейная и угловая (рисунок 3.5):

Рисунок 3.5. Линейная и угловая конфигурация трёхатомной молекулы.
У линейной молекулы валентный угол равен 1800, а у угловой зависит от природы атомов A и B.
III. Количество электронов, отдаваемых атомом на образование связи, определяет его валентность.
Третье положение вводит определение термину валентность. Здесь нужно обратить внимание на очередное отличие от школьного определения валентности. Согласно школьным учебникам валентность – это способность атома химического элемента присоединять или замещать определенное количество атомов другого элемента [1-6]. Пользуясь только этим определением, остается только заучивать валентности всех используемых элементов, а ведь многие из них еще и переменную валентность имеют. А пользуясь третьим положением МВС достаточно лишь знать количество протонов в ядре атома. Знаем количество протонов – можем описать электронную конфигурацию – видим, сколько электронов атом готов отдать на образование химической связи.
Итак, химическая связь образуется при взаимодействии двух электронных облаков, с образованием общей электронной пары. Но между атомами может сформироваться не одна общая электронная пара, а несколько. В таком случае и химические свойства у такой связи будут другими. Химические связи, образованные несколькими электронными парами называются кратными (двойными и тройными, по количеству общих пар). Для обозначения химической связи используются два способа: либо отмечается сама химическая связь валентным штрихом «-», либо пара электронов, которая эту связь сформировала «:». Двойная связь обозначается двумя валентными штрихами «=», либо двумя парами электронов «::». Тройная – тройным валентным штрихом «≡», либо тремя парами «:::». При изображении химической связи валентным штрихом отличия в изображении валентных штрихов (разные длина, ширина, угол) не имеют значения. В таблице 3.2 приведены примеры обозначения химических связей.
Таблица 3.2. Обозначение химических связей
| Молекула | HI | C2H4 | N2 |
| Связь | H-I | 
| N≡N |
| Формула Льюиса | H:I | 
| :N:::N: |
| Название связи | Простая ковалентная | Двойная ковалентная | Тройная ковалентная |
Если принято решение использовать точки для обозначения электронов, то, как правило, указываются не только участвующие в формировании химической связи электроны, но и электроны атомов, находящиеся на валентном уровне. Такая запись называется формулой Льюиса. По фамилии ученого, который впервые высказал идею о формировании химической связи парой электронов.
Пример образования химической связи, который подробно рассмотрен выше описывает процесс образования ковалентной связи по обменному механизму. Химическая связь между атомами, осуществляемая обобществленными электронами, называется ковалентной. Ковалентная связь (означает – «совместно действующая») возникает за счет образования общих электронных пар между атомами в молекуле. Ковалентная связь может быть образована по двум механизмам:
1) обменный;
2) донорно-акцепторный.
Обменный механизм заключается в том, что каждый из участвующих атомов для образования общей электронной пары отдает по одному электрону. При этом происходит перекрывание электронных облаков, уменьшается энергия системы на величину энергии связи. С использованием формул Льюиса можно описать обменный механизм образования ковалентной связи для общего случая следующим уравнением:
Дата добавления: 2018-04-05; просмотров: 603; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
