Важнейшие классы органических соединений
ВведениеДля приготовления пищи, одежды, красителей, лекарств и т. д. человек издавна научился применять различные вещества. Со временем накапливалось все больше и больше сведений о свойствах тех или иных веществ, совершенствовались способы их получения, переработки и т. д. Причем оказалось, что многие из необходимых человеку веществ могут быть получены им непосредственно. Это вещества минерального происхождения, или неорганические вещества. Однако некоторые используемые человеком вещества не могли быть им синтезированы. Их выделяли из организмов животных и из растений. Эти вещества назвали органическими. Попытки синтезировать органические вещества в лабораторных условиях оканчивались безуспешно. Вследствие этого вначале XIX в. развилось учение “о жизненной силе”, или витализм (vita – жизнь), согласно которому органические вещества возникают только по воле мифической “жизненной силы”, а человек вне живого организма создавать их не может. Это было реакционное учение, которое и тормозило исследование органических веществ и препятствовало развитию науки. Но наука накапливала все новые и новые факты, в том числе и сведения об органических веществах, которые подрывали устои теории виталистов. Наконец, открытия 30–50-х гг. XIX в. полностью опровергли доводы виталистов и способствовали утверждению материалистических принципов в науке. В 1824 г. немецкий ученый и врач Фридрих Вѐлер (1800–1882 гг.) впервые в истории из неорганических веществ (дициана и воды) синтезировал органическое вещество – щавелевую кислоту: В 1828 г. нагреванием циановокислого натрия с сернокислым аммонием Вѐлер синтезировал мочевину – продукт жизнедеятельности животных организмов. По этому поводу Вѐлер писал одному из выдающихся ученых того времени шведскому химику Берцелиусу (создателю виталистической теории): “Должен сказать Вам, что я могу приготовить мочевину, не нуждаясь для этого ни в почке, ни в живом организме вообще”. Опыты Вѐлера положили начало органическому синтезу. В 1842 г. русский химик Н. Н. Зинин восстановлением нитробензола получил анилин: Француз Бертло в 1854 г. из глицерина и жирных кислот получил жиры, а в 1863 г. – ацетилен из водорода и углерода. Эти открытия сыграли огромную роль в развитии науки вообще, а химии в особенности. Ученые-химики постепенно стали отходить от виталистических позиций и склоняться к тому, что и органические вещества человек может получить из химических элементов. Принцип противопоставления веществ органических и неорганических обнаружил свою несостоятельность. В настоящее время все вещества по-прежнему делят на органические и неорганические, однако смысл в этом заложен иной. Органическими называют вещества, содержащие в своем составе углерод, их ещѐ называют соединениями углерода. Таких соединений около 3-х млн., в то время как все остальные элементы образуют около 300.000 соединений. Вещества же, в состав которых углерод не входит, называют неорганическими. Правда, есть ряд соединений, имеющих в своем составе углерод и относящихся все равно к неорганическим веществам: CO и CO2, CS2, H2CO3 и её соли. Все они по составу и свойствам сходны с неорганическими соединениями. РАЗДЕЛ I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ ГЛАВА 1. ОБЩИЕ ПОЛОЖЕНИЯ ОРГАНИЧЕСКОЙ ХИМИИ §1. Основное сырье и источники получения органических соединений Главным сырьем для получения органических соединений являются природные газы, нефть, каменный и бурые угли, сланцы, торф и продукты сельского и лесного хозяйства. Природные газы Природные газы обычно сопутствуют нефти и имеют различный состав. Как правило это метан, этан, пропан, бутан и другие углеводороды, сероводород, азот, углекислый газ, а также инертные газы – гелий и аргон. Помимо использования в качестве топлива природный газ может использоваться как сырьѐ для органического синтеза. Основными направлениями переработки природных газов являются пиролиз (на ацетилен, водород и газовую сажу), неполное окисление (до окиси углерода), хлорирование (с целью получения хлорсодержащих продуктов). Нефть Нефть (греч. – nafta) – жидкое горючее ископаемое; сложная смесь углеводородов с небольшим количеством органических (кислородных, сернистых и азотистых) соединений. Нефть – маслянистая жидкость с характерным запахом, преимущественно черного цвета (бывает черной, иногда почти прозрачной), легче воды, в воде нерастворима. Существуют несколько теорий происхождения нефти, из которых ни одна ещѐ не приобрела общего признания. Органическая теория – нефть – геохимические измененные остатки некогда населявших земной шар растений и животных. Неорганическая теория – образование нефти происходит в результате действия воды в толщах земного шара на раскаленные карбиды металлов (соединения металлов с углеродом) с последующим изменением получающихся углеводородов под влиянием высокой температуры, высокого давления, воздействия металлов, воздуха, водорода и т. д. Нефть известна человеку с древних времен. Это важнейший источник топлива, масел, сырья для химической промышленности, различных нефтепродуктов. Основным (первичным) процессом переработки нефти является еѐ перегонка, в результате которой образуются следующие нефтепродукты: бензин, лигроин, керосин, соляровое масло, мазут, вазелин, парафин, гудрон. Вторичные процессы переработки нефти (крекинг, пиролиз) дают возможность производить больше и высшего качества бензин, различные углеводороды, главным образом ароматические (бензол, толуол). Большое значение имеют, как топливо и как сырье для химической промышленности, попутные нефтяные газы и газы крекинга нефти. Нефтяные газы Это смесь различных газообразных углеводородов, растворенных в нефти, выделяющихся в процессе еѐ добычи и перегонки. Газы крекинга нефти, состоящие из предельных и непредельных углеводородов (этилен, ацетилен), также относят к нефтяным газам. Нефтяные газы применяются как топливо и как сырье для химической промышленности. Путем химической переработки из нефтяных газов получают пропилен, бутилены, бутадиен и др., которые используются в производстве пластмасс, каучуков и других продуктов органического синтеза. Каменный уголь и другие виды ископаемых углей Запасы каменного угля в природе значительно превышают запасы нефти. Многие страны вообще не имеют нефти, но имеют каменный уголь. Поэтому каменный уголь – важнейший вид сырья для химической промышленности. Ископаемый уголь представляет собой остатки растительного мира, существовавшего на нашей планете в давно минувшие периоды еѐ жизни. Чем старше уголь, тем богаче он углеродом. Различают три главных вида ископаемых углей: 1. Антрацит – самый древний из ископаемых углей. Отличается большой плотностью и блеском. Содержит в среднем 95 % углерода. 2. Каменный уголь – плотное черное вещество. Содержащий 75–90 % углерода. Из всех ископаемых углей находит самое широкое применение. 3. Бурый уголь содержит 65–70 % углерода. Имеет бурый цвет. Как самый молодой из ископаемых углей часто сохраняет следы структуры дерева из которого он образовался. Бурый уголь отличается большой гигроскопичностью и высокой зольностью 7 (7÷38%), поэтому используется только как местное топливо и как сырье для химической переработки. В настоящее время в промышленности используются несколько путей переработки каменного угля: сухая перегонка (коксование), гидрирование, неполное сгорание, получение карбида кальция. Сухая перегонка угля используется для получения кокса в металлургии или бытового газа. При коксовании угля получаются кокс, каменноугольная смола, надсмольная вода и газы коксования. Каменноугольная смола содержит самые разнообразные ароматические и гетероциклические органические соединения. Разгонкой при обычном давлении она разделяется на несколько фракций. Каждая фракция подвергается дальнейшей обработке и новой перегонке. Из каменноугольной смолы получают ароматические углеводороды, фенолы, гетероциклические соединения – пиридин, хинолин и их гомологи. Газы коксования содержат метан, этилен, водород, окись углерода. Частично они сжигаются, частично перерабатываются. Гидрирование угля осуществляется при 400–600 ºC под давлением водорода до 250 атм в присутствии катализатора – оксидов железа, при этом получается жидкая смесь углеводородов, подвергающаяся обычно деструктивному гидрированию на никеле или других катализаторах. Неполное сгорание угля дает окись углерода, которая потом используется для получения углеводородов и спиртов. Карбид кальция получается из угля (кокса, антрацита) и извести. В дальнейшем он превращается в ацетилен, который используется в химической промышленности. Сланцы. Различные виды природных сланцев перерабатываются путем пиролиза в смолу, которая является источником фенолов. Органическая составляющая сланцев – кероген – может быть переработана в двухосновные кислоты (окисление) и другие ценные продукты. Торф. Окислением торфяной массы получают щавелевую кислоту. Продукты сельского и лесного хозяйства Некоторые химические производства используют в качестве сырья продукты сельского и лесного хозяйства. Этиловый спирт производят сбраживанием глюкозы, образующейся при гидролитическом расщеплении клетчатки (из древесины) или крахмала (из хлебных злаков и картофеля). Из того же сырья получают витамин C и лимонную кислоту. Скипидар и канифоль производят из живицы или древесины хвойных пород, витамин А и другие душистые вещества – из эфирных масел. В настоящее время имеется тенденция резко уменьшить использование пищевого сырья в химической промышленности на основе применения новых синтетических методов органической химии. §2. Теория химического строения органических соединений А. М. Бутлерова Крупнейшим событием в развитии органической химии было создание в 60-х гг. XIX в. великим русским ученым. А. М. Бутлеровым теории химического строения органических соединений. Эта теория заложила научные основы органической химии и объяснила еѐ важнейшие закономерности. Основные принципы своей теории А. М. Бутлеров изложил в докладе “О теории химического строения” на Международном съезде естествоиспытателей и врачей в Шпейере 19 сентября 1861 г. В дальнейшем она успешно развивалась как самим ученым, так и его учениками. Основные положения теории строения сводятся к следующему: 1. Атомы в органической молекуле соединяются между собой в определенном порядке в соответствии с их валентностью, что и обуславливает химическое строение молекул. 2. Молекулы с одинаковым составом могут иметь разное химическое строение и соответственно обладать различными свойствами. Такие молекулы называют изомерами. Для данной эмпирической формулы можно вывести определенное число теоретически возможных изомеров. 3. Атомы в молекуле оказывают взаимное влияние друг на друга, т. е. свойства атома могут изменяться в зависимости от природы других атомов соединения. Взаимное влияние испытывают не только связанные атомы, но и непосредственно несвязанные друг с другом. 4. Каждое органическое соединение имеет лишь одну химическую формулу. Рассмотрим эти положения на примерах. Химическая формула этана – С2Н6. Обозначим валентность элементов черточками, изобразим молекулу этана в порядке соединения атомов, т. е. напишем её структурную формулу. Согласно теории А. М. Бутлерова, она будет иметь следующий вид: Атомы водорода и углерода связаны в одну частицу, валентность водорода равна единице, а углерода – четырѐм. Два (три) атома углерода соединены между собой связью углерод – углерод (С – С). Способность углерода образовывать С – С связь объясняется исходя из того, что на внешнем электронном слое у атома углерода четыре электрона, способность отдавать эти электроны такая же, как и присоединять недостающие. Поэтому углерод чаще всего образует соединения с ковалентной связью, т. е. за счет образования электронных пар с другими атомами, в том числе и атомов углерода друг с другом. Второе положение теории Бутлерова объясняет существование изомеров. Различают структурную и пространственную изомерию. Структурная изомерия обусловлена различным порядком связей углеродных атомов (изомерии скелета) или различным расположением функциональных групп или кратных связей (изомерия положения). Изомерию скелета проиллюстрируем изомерами бутана и пентана. Формуле бутана C4H10 отвечают два вещества, структуры которых можно представить: Формуле пентана C5H12 отвечают три вещества, структурные формулы которых можно представить: Изомерию положения можно показать на примере пропилового спирта: Пространственная изомерия обусловлена различным расположением химических связей атомов углерода в пространстве и включает геометрическую, оптическую и другие виды изомерии. Пространственные изомеры называют стереоизомерами. К числу геометрических изомеров относятся цис- и транс-изомеры, например изомеры 1,2- дибромэтена: Оптические изомеры имеют в своем составе один или несколько атомов углерода, связанных с четырьмя различными атомами или группами атомов. Такие изомеры отличаются друг от друга, как предмет от своего зеркального изображения. Они обладают способностью вращать плоскость поляризованного луча света вправо или влево (L-D-изомерия). Третье положение теории Бутлерова (о взаимном влиянии атомов в молекуле) утверждает, что реакционная способность атомов (или атомных групп), входящих в состав молекулы, меняется в зависимости от того, с какими атомами они связаны в данной молекуле. Это изменение обусловлено, прежде всего, взаимным влиянием связанных непосредственно друг с другом атомов. Сравнивая между собой, например, хлоруксусные кислоты, можно заметить, что константа диссоциации возрастает при переходе от уксусной кислоты к хлоруксусной, причем кислотные свойства последней сопоставимы с таковыми сильных минеральных кислот: Увеличение константы диссоциации при введении галогена в радикал кислоты объясняется тем, что хлор, как более электроотрицательный элемент, оттягивает к себе электроны от соседнего углеродного атома, вследствие чего последний приобретает некоторый положительный заряд. В свою очередь этот атом углерода притягивает электроны от соседнего атома углерода. Таким образом, сдвиг электронов в сторону хлора происходит по всей цепи атомов, и в конечном итоге атом водорода в карбоксильной группе легче отцепляется в виде иона, чем водород в карбоксильной группе уксусной кислоты. Этот сдвиг электронов усиливается по мере увеличения числа атомов галогена и поэтому трихлоруксусная кислота в данном ряду является самой сильной кислотой. Четвертое положение теории Бутлерова утверждает: “Каждое органическое соединение имеет лишь одну химическую формулу”. При изложении последующих разделов органической химии данное положение теории будет проиллюстрировано на конкретных примерах. Теория химического строения А. М. Бутлерова является важнейшей частью теоретического фундамента органической химии. По значимости её можно сопоставить с периодической системой Д. И. Менделеева. Подобно последней, она дала возможность систематизировать огромный практический материал, заранее предсказать существование новых веществ, а также указать пути их получения. А это обеспечило невиданные успехи органического синтеза. И в настоящее время теория химического строения служит руководящей основой во всех исследованиях по органической химии. § 3. Классификация органических соединений В зависимости от строения углеродной цепи органические соединения разделяют на соединения с открытой цепью (алифатический или жирный ряд) и циклические. Последние делятся на две группы: карбоциклические соединения (циклы состоят только из атомов углерода) и гетероциклические (в циклы входят и другие атомы, кроме атомов углерода). Карбоциклические соединения, в свою очередь, включают два ряда: алициклический и ароматический. Ароматический ряд объединяет ароматические углеводороды – бензол, нафталин и т. д. и их производные. В каждом ряду органические соединения делятся на классы в зависимости от состава и строения (табл. 1). Наиболее простыми представителями соединений жирного алициклического и ароматического рядов являются углеводороды. Заменяя атомы водорода в углеводородах на другие атомы или группы атомов (функциональные группы), переходят от углеводородов к другим классам органических соединений данного ряда. Атомы – заместители и функциональные группы определяют главнейшие направления химических превращений данного класса органических соединений. Углеводороды и их производные с одним и тем же атомом – заменителем или с одной и той же функциональной группой образуют гомологические ряды. Гомологическим рядом называют бесконечный ряд веществ, отличающихся друг от друга на любое число групп СН2 (гомологическая разность), имеющих сходное строение и, следовательно, сходные химические свойства. Существование гомологических рядов связано со способностью углеродных атомов соединяться между собой в длинные цепи. Поскольку гомологи имеют сходные химические свойства, значительно упрощается изучение органических соединений.
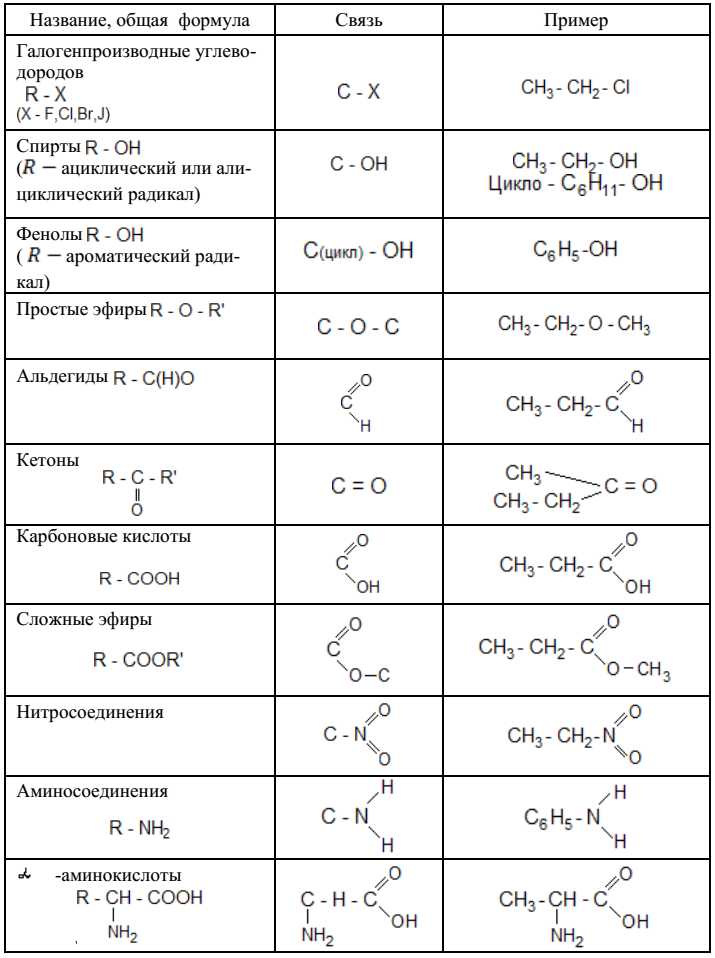
Важнейшие классы органических соединений
Дата добавления: 2018-04-05; просмотров: 922; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
