Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Максимальная степень окисления атома элемента равна номеру группы в периодической таблице, к которой относится данный элемент. Соединения, содержащие атомы элементов с минимальной степенью окисления могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому, что внешний энергетический уровень у таких атомов завершен восемью электронами. Минимальная степень окисления у атомов металлов равна 0, для неметаллов - (n–8) (где n- номер группы в периодической системе). Соединения, содержащие атомы элементов с промежуточной степенью окисления, могут быть и окислителями и восстановителями, в зависимости от партнера, с которым взаимодействуют и от условий реакции.
Классификация окислительно-восстановительных реакций
Межмолекулярные окислительно-восстановительные реакции
Окислитель и восстановитель находятся в разных веществах; обмен электронами в этих реакциях происходит между различными атомами или молекулами:
S0 + O20 S+4O2-2
S - восстановитель; O2 - окислитель
Cu+2O + C+2O Cu0 + C+4O2
CO - восстановитель; CuO - окислитель
Zn0 + 2HCl Zn+2Cl2 + H20
Zn - восстановитель; HСl - окислитель
|
|
|
Mn+4O2 + 2KI-1 + 2H2SO4 I20 + K2SO4 + Mn+2SO4 + 2H2O
KI - восстановитель; MnO2 - окислитель.
Сюда же относятся реакции между веществами, в которых атомы одного и того же элемента имеют разные степени окисления
2H2S-2 + H2S+4O3 ® 3S0 + 3H2O
Внутримолекулярные окислительно- восстановительные реакции
Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Внутримолекулярные реакции протекают, как правило, притермическом разложении веществ, содержащих окислитель и восстановитель.
2KCl+5O3-2 2KCl-1 + 3O20
Cl+5 - окислитель; О-2 - восстановитель
Опыт. Разложение дихромата аммония
(N-3H4)2Cr2+6O7 –t° Cr2+3O3 + N20 + 4H2O
Cr+6 - окислитель; N-3 - восстановитель.
Диспропорционирование - окислительно-восстановительная реакция, в которой один элемент одновременно повышает и понижает степень окисления.
Cl20 + 2KOH KCl+1O + KCl-1 + H2O
3K2Mn+6O4 + 2H2O 2KMn+7O4 + Mn+4O2 + 4KOH
3HN+3O2 HN+5O3 + 2N+2O + H2O
2N+4O2 + 2KOH KN+5O3 + KN+3O2 + H2O
Составление уравнений окислительно-восстановительных реакций.
Взаимодействие между иодоводородом и концентрированной серной кислотой. Эта реакция протекает согласно схеме:

Если мы подсчитаем степень окисленности каждого элемента в исходных веществах и в продуктах реакции, то увидим, что она изменяется у иода и у серы. У иода в HI она равна —1, а в свободном иоде 0. Степень же окисленности серы изменяется от  до —2 (в
до —2 (в  ). Таким образом, степень окисленности иода повышается, а серы — понижается. Следовательно, иод окисляется, а сера восстанавливается.
). Таким образом, степень окисленности иода повышается, а серы — понижается. Следовательно, иод окисляется, а сера восстанавливается.
|
|
|
Уравнение процесса окисления иода имеет простой вид:

Уравнение восстановления серы более сложно, так как и исходное вещество 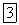 или
или  , и продукт реакции
, и продукт реакции 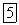 кроме серы содержат другие элементы. При составлении этого уравнения будем исходить из того, что реакция протекает в кислой водной среде, а ион
кроме серы содержат другие элементы. При составлении этого уравнения будем исходить из того, что реакция протекает в кислой водной среде, а ион  превращается в молекулу
превращается в молекулу  :
:

Четыре атома кислорода, высвобождающиеся при этом процессе, должны связаться в четыре молекулы воды. Для этого понадобятся восемь ионов водорода. Кроме того, два иона водорода необходимы для образования молекулы  . Следовательно, с ионом
. Следовательно, с ионом  должны взаимодействовать десять ионов водорода:
должны взаимодействовать десять ионов водорода:

Суммарный заряд ионов, находящихся в левой части этой схемы, равен восьми элементарнымположительным зарядам, а в правой ее части имеются лишь незаряженные частицы. Поскольку суммарный заряд в ходе процесса не изменяется, то, следовательно, в процессе восстановления принимают участие также восемь электронов:
|
|
|

В рассматриваемом примере отношение числа электронов, принимаемых в процессе восстановления, к числу электронов, высвобождающихся при окислении, равно  . Для получения суммарного уравнения реакции надо, складывая уравнения процессов восстановления и окисления, учесть это соотношение — умножить уравнение восстановления на 4. При этом в записи обычно справа от вертикальной черты проставляются необходимые множители:
. Для получения суммарного уравнения реакции надо, складывая уравнения процессов восстановления и окисления, учесть это соотношение — умножить уравнение восстановления на 4. При этом в записи обычно справа от вертикальной черты проставляются необходимые множители:

Полученное уравнение реакции может быть представлено и в молекулярной форме:

Пример 2. Взаимодействие алюминия с нитратом калия в щелочной среде. Схема реакции:

Здесь степень окисленности изменяется у азота и алюминия. Металлический алюминий (степень окисленности равна 0) превращается в ион  , в котором степень окисленности алюминия равна
, в котором степень окисленности алюминия равна  . Для составления уравнения окисления будем исходить из схемы:
. Для составления уравнения окисления будем исходить из схемы:

В щелочной среде источником кислорода, необходимого для протекания этого процесса, служат ионы  . Для связывания одного атома алюминия в
. Для связывания одного атома алюминия в  необходимо четыре гидроксид-иона:
необходимо четыре гидроксид-иона:

В левой части схемы имеются четыре отрицательных заряда, а в правой — один. Следовательно, в ходе процесса отдаются три электрона:
|
|
|

Для получения уравнения восстановления будем исходить из схемы:

Здесь в ходе процесса атомы азота лишаются атомов кислорода и связываются с атомами водорода. В щелочной среде это возможно при участии молекул воды. Три молекулы воды понадобятся для связывания трех атомов кислорода и еще три молекулы, воды — для образования молекулы  :
:

Суммарный заряд правой части схемы равен девяти отрицательным зарядам, а левой — одному. Следовательно, в процессе принимают участие восемь электронов:

Отношение числа электронов, высвобождающихся в процессе окислеиая, к числу электронов, принимаемых при восстановлении, в данном примере равно  . Следовательно, для получения суммарного уравнения реакции необходимо сложить уравнения процессов окисления и восстановления, умножив первое из них на 8, а второе на 3.
. Следовательно, для получения суммарного уравнения реакции необходимо сложить уравнения процессов окисления и восстановления, умножив первое из них на 8, а второе на 3.

или в молекулярной форме:

Дата добавления: 2018-04-04; просмотров: 658; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
