Три разновидности структурных формул
Билет №4
Щелочные металлы: нахождение в периодической системе химических элементов Д.И. Менделеева, строение атомов, нахождение металлов в природе, физические и химические свойства, общие способы их получения.
Щелочными металлами называются химические элементы металлы I A группы периодической системы Д.И. Менделеева: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Электронное строение атомов.
На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы I A характерна степень окисления +1.
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:
· увеличение радиуса атомов;
· уменьшение электроотрицательности;
· усиление восстановительных, металлических свойств.
Строение атомов щелочных металлов на примере литий Li, натрий Na, калий K:
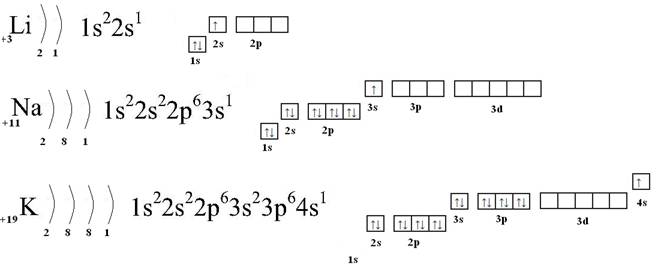
Нахождение в природе
Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
· каменная соль (хлорид натрия NaCl),
· глауберова соль или мирабилит, — декагидрат сульфата натрия Na2SO4 · 10H2O,
· сильвин — хлорид калия KCl,
· сильвинит — двойной хлорид калия-натрия KCL · NaCl и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
|
|
|
Физические свойства
В твердом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами IA группы — это легкоплавкие металлы, серебристо-белого (литий, натрий, калий, рубидий) или золотисто-желтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.
Наиболее твердым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
Химические свойства
- Взаимодействие с неметаллами
Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
· Щелочные металлы легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
|
|
|
оксид образует только литий:
4Li + O2 = 2Li2O,
натрий образует пероксид:
2Na + O2 = Na2O2,
калий, рубидий и цезий – надпероксид:
K + O2 = KO2.
· С галогенами все щелочные металлы образуют галогениды:
2Na + Cl2 = 2NaCl.
· Взаимодействие с водородом, серой, фосфором, углеродом, кремнием протекает при нагревании:
с водородом образуются гидриды:
2Na + H2 = 2NaH,
с серой – сульфиды:
2K + S = K2S,
с фосфором – фосфиды:
3K + P = K3P,
с кремнием – силициды:
4Cs + Si = Cs4Si,
с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2,
калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом.
· С азотом легко реагирует только литий, реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N.
- Взаимодействие с водой

Все щелочные металлы реагируют с водой, литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Mе + 2H2O = 2MеOH + H2.
- Взаимодействие с кислотами
Щелочные металлы способны реагировать с разбавленными кислотами с выделением водорода, однако реакция будет протекать неоднозначно, поскольку металл будет реагировать и с водой, а затем образующаяся щелочь будет нейтрализоваться кислотой.
|
|
|
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Взаимодействие щелочных металлов с кислотами практически всегда сопровождается взрывом, и такие реакции на практике не проводятся.
- Восстановление металлов из оксидов и солей
Менее активные металлы могут быть получены восстановлением щелочными металлами:
3Na + AlCl3 = Al + 3NaCl.
Общие способы получения
Основной способ получения щелочных металлов – это восстановение металлов электрическим током (электролиз) из расплавов гидроксидов:
4NaOH –расплав, электр. ток.→ 4Na + O2↑ + 2H2O
Понятие об органических веществах. Общие и отличительные признаки органических и неорганических соединений. Причины многообразия органических соединений. Молекулярные и структурные формулы органических веществ.
Органические и неорганические вещества состоят из одних и тех же химических элементов и могут быть превращены друг в друга.
Примеры органических веществ и их молекулярные формулы: уксусная кислота CH3-COOH, этиловый спирт CH3CH2OH, сахароза C12H22O11, глюкоза C6H12O6, ацетилен HC=CH.
|
|
|
Во все органические соединения входят углерод и водород.
Признаки органических веществ:
1. Содержат углерод.
2. Горят и (или) разлагаются с образованием углеродсодержащих продуктов.
3. Связи в молекулах органических веществ ковалентные.
Общие и отличительные признаки органических и неорганических соединений.
| Характеристика | Неорганические вещества | Органические вещества |
| Качественный состав | Любые элементы периодической системы | Все соединения содержат Карбон и Гидроген, во многих содержатся Оксиген, Сульфур, Азот, Фосфор и др. |
| Валентность элементов | Разная, может быть переменной | Постоянная: С — IV, H — И O — II, Hal — И |
| Виды связей | Все типы связи: ковалентная полярная и неполярная, ионный, металлический | Преимущественно ковалентная полярная и неполярная типы связи |
| Строение вещества | Атомная, молекулярная, ионная | Преимущественно молекулярная |
| Количество соединений | Сотни тысяч | Около 20 миллионов и постоянно увеличивается |
| Термостойкость | Разная | Преимущественно низкая, за 300400 °С — разлагаются |
Органические соединения отличаются от неорганических рядом характерных особенностей:
• почти все органические вещества горят или легко разрушаются вследствие нагревании с окислителями, выделяя CO2 (по этому признаку можно установить принадлежность исследуемого вещества к органическим соединениям);
• в молекулах органических соединений Карбон может быть соединен почти с любым элементом Периодической системы;
• органические молекулы могут содержать последовательность атомов Углерода, соединенных в цепи (открытые или замкнутые);
• молекулы большинства органических соединений не диссоциируют на достаточно устойчивые ионы;
• реакции органических соединений протекают значительно медленнее и в большинстве случаев не завершаются окончательно;
• среди органических соединений широко распространено явление изомерии;
• органические вещества имеют более низкие температуры фазовых переходов (tкип, tпл).
Молекулярные и структурные формулы органических веществ.
Молекулярная формула вещества указывает количество атомов в молекуле:
Например: C2H6, C3H6, C3H4, С2Н5ОН.
Структурная показывает связи между молекулами/
Три разновидности структурных формул
1.Самая полная форма записи формулы углеводорода – это когда каждый атом молекулы показан отдельно:

Такая запись громоздкая, занимает много места и используется редко.
2.Форма записи, в которой указывают общее число атомов водорода при каждом атоме С, а между соседними углеродами ставят черточки,
СН3–СН2–СН3, Сl–СН2–СН2–Br.
3.Структурная формула, в которой черточки между атомами, расположенными в записи на одной строке, не указывают, тогда как атомы, выходящие на другие строки, соединяют черточками с прямой цепью:

Иногда углеродные цепи изображают ломаными линиями, геометрическими фигурами (треугольник, квадрат, куб). При этом в каждом изломе цепи, а также в начале и в конце цепи подразумевают атом С. Например, изображениям

соответствуют структурные формулы

Дата добавления: 2018-02-28; просмотров: 1787; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
