Классификация поверхностных явлений
Поскольку ДС обладают значительной удельной поверхностью, а, следовательно, большим запасом свободной энергии, то большинство ДС (за исключением лиофильных) термодинамически неустойчивы. Поэтому, в таких системах самопроизвольно протекают ПЯ, приводящие к снижению свободной поверхностной энергии  (
( ). Чем больше
). Чем больше  , тем больше интенсивность ПЯ.
, тем больше интенсивность ПЯ.
ПЯ удобно классифицировать в соответствии с объединенным уравнением I и II начал термодинамики, запишем его еще раз:
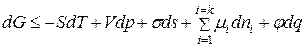 , (3)
, (3)
Уравнение (3) выражает приращение энергии Гиббса системы через алгебраическую сумму приращений других видов энергии. Превращение свободной поверхностной энергии  в один из представленных видов энергии отвечает определенным ПЯ. Слагаемое
в один из представленных видов энергии отвечает определенным ПЯ. Слагаемое  определяет влияние на энергию Гиббса изменения поверхности раздела фаз в ДС (для гомогенной системы
определяет влияние на энергию Гиббса изменения поверхности раздела фаз в ДС (для гомогенной системы  ). Стрелки указывают на пять возможных превращений свободной поверхностной энергии:
). Стрелки указывают на пять возможных превращений свободной поверхностной энергии:
1) в энергию Гиббса –  ;
;
2) в теплоту (тепловую энергию) – (–  );
);
3) в механическую работу – 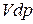 ;
;
4) в химическую энергию (энергию химических взаимодействий) –  , для индивидуальных веществ слагаемое равно нулю;
, для индивидуальных веществ слагаемое равно нулю;
5) в электрическую энергию (энергию взаимодействия заряженных частиц) –  .
.
Для изобарно-изотермических процессов справедливо уравнение (8)
 . (8)
. (8)
Дифференцируя (8), получим
 , (10)
, (10)
или  .
.
Т.е. снижение  может быть достигнуто либо за счет уменьшения поверхности раздела фаз
может быть достигнуто либо за счет уменьшения поверхности раздела фаз  , либо поверхностного натяжения
, либо поверхностного натяжения  . Следовательно, все ПЯ в ДС можно разделить на две группы (табл. 3):
. Следовательно, все ПЯ в ДС можно разделить на две группы (табл. 3):
1) обусловленные снижением  ;
;
2) связанные с уменьшением поверхности раздела фаз.












Лекция 3
1) В первом случае снижение  может быть вызвано протеканием: физико-химических (адсорбция, адгезия), электрических (образование ДЭС), механических (изменение размера частиц ДФ, относительное перемещение фаз), тепловых процессов (образование новой поверхности, а также сопутствующих ПЯвлениям). Физико-химические процессы сопровождают тепловые эффекты, связанные с выделением или поглощением теплоты.
может быть вызвано протеканием: физико-химических (адсорбция, адгезия), электрических (образование ДЭС), механических (изменение размера частиц ДФ, относительное перемещение фаз), тепловых процессов (образование новой поверхности, а также сопутствующих ПЯвлениям). Физико-химические процессы сопровождают тепловые эффекты, связанные с выделением или поглощением теплоты.
Определим влияние температуры на  . Из совместного решения уравнений (3) и (10) в отсутствии изменения других параметров (
. Из совместного решения уравнений (3) и (10) в отсутствии изменения других параметров ( ,
,  и
и  ), получим:
), получим:
 ,
,
или 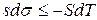 .
.
При равновесии  . (11)
. (11)
где 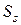 – удельная энтропия, т.е. энтропия поверхностного слоя в расчете на единицу поверхности раздела фаз.
– удельная энтропия, т.е. энтропия поверхностного слоя в расчете на единицу поверхности раздела фаз.
Величина  показывает изменение
показывает изменение  в зависимости от температуры и является температурным коэффициентом поверхностного натяжения.
в зависимости от температуры и является температурным коэффициентом поверхностного натяжения.
На основании II начала термодинамики для обратимых процессов энтропию можно связать с теплотой образования единицы площади поверхности  , т.е.
, т.е.
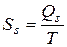 . (12)
. (12)
Из уравнений (11) и (12) получим:
 . (13)
. (13)
Поскольку для индивидуальных веществ теплота образования поверхности  всегда положительна, из условия (13) следует, что
всегда положительна, из условия (13) следует, что  , т.е.
, т.е.  индивидуальных веществ на границе с газом снижается самопроизвольно с повышением температуры.
индивидуальных веществ на границе с газом снижается самопроизвольно с повышением температуры.
Для воды 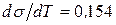
 . Это означает, что при повышении температуры на 1 градус
. Это означает, что при повышении температуры на 1 градус  снижается на указанную величину.
снижается на указанную величину.
2) Снижение  может быть реализовано за счет образования сферической и идеально гладкой поверхности, укрупнения частиц и механических процессов.
может быть реализовано за счет образования сферической и идеально гладкой поверхности, укрупнения частиц и механических процессов.
Сферические частицы по сравнению с частицами другой формы обладают минимальной поверхностью. Например, капли любой жидкости в отсутствие гравитации (в кабине космического корабля), капельки ртути, обладающей значительным поверхностным натяжением, всегда образуют сферу. Идеально гладкая поверхность образуется на границе раздела с газовой фазой. Поверхность воды в стакане всегда идеально гладкая.
При укрупнении частиц дисперсной фазы всегда уменьшается удельная поверхность. Например, если частицы цемента диаметром 
 укрупнятся и образуют агрегаты диаметром
укрупнятся и образуют агрегаты диаметром 
 , то удельная поверхность таких частиц уменьшится от 500 до 5
, то удельная поверхность таких частиц уменьшится от 500 до 5  .
.
Укрупнение частиц твердой ДФ происходит за счет слипания и образования более крупных агрегатов. Этот процесс называется коагуляцией.
Слияние капель (или пузырьков) внутри подвижной ДСр (жидкости или газа) и образование частиц большего размера – коалесценция.
Рост крупных капель за счет исчезновения более мелких происходит в результате изотермической перегонки.
Адсорбция
Основные понятия и определения
Адсорбция – самопроизвольное концентрирование (сгущение) веществ на поверхности раздела фаз.
С термодинамической точки зрения адсорбция является самопроизвольным процессом выравнивания химических потенциалов веществ в объеме системы и межфазном (поверхностном) слое, вследствие стремления к минимуму поверхностной энергии или энергии Гиббса всей системы.
Фазу, на поверхности которой происходит адсорбция, называют адсорбентом.
Адсорбируемое вещество в зависимости от его положения относительно адсорбента имеет два названия: если оно находится в объеме раствора – это адсорбтив, на поверхности адсорбента (в адсорбированном состоянии) – адсорбат.
В зависимости от агрегатного состояния смежных фаз (адсорбента и адсорбтива) различают адсорбцию на границе жидкость–газ (Ж–Г), твердое тело–жидкость (Т–Ж), твердое тело–газ (Т–Г).
Величину адсорбции обычно выражают двумя способами.
а) Абсолютная адсорбция  – количество
– количество  го компонента (адсорбата) в поверхностном слое
го компонента (адсорбата) в поверхностном слое  ,
,  , приходящееся на единицу площади поверхности
, приходящееся на единицу площади поверхности 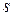 ,
,  или единицу массы адсорбента
или единицу массы адсорбента 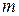 ,
, 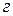
 , (14)
, (14)
б) Избыточная, или гиббсовская, адсорбция  – избыток
– избыток  го компонента в поверхностном слое по сравнению с его содержанием в объеме фазы, приходящийся на единицу площади поверхности
го компонента в поверхностном слое по сравнению с его содержанием в объеме фазы, приходящийся на единицу площади поверхности 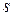 ,
,  или единицу массы адсорбента
или единицу массы адсорбента 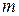 ,
, 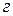
 , (15)
, (15)
где  ,
,  – молярная концентрация
– молярная концентрация  го компонента в поверхностном слое и объеме фазы соответственно,
го компонента в поверхностном слое и объеме фазы соответственно,  ;
;  – объем поверхностного слоя,
– объем поверхностного слоя,  ;
;
 – количество
– количество  го компонента в объеме фазы,
го компонента в объеме фазы,  .
.
Относительно площади величины  и
и  определяют при адсорбции на поверхности раздела жидкость – газ или твердых гладких поверхностях и измеряют в
определяют при адсорбции на поверхности раздела жидкость – газ или твердых гладких поверхностях и измеряют в  , а при адсорбции на твердых порошкообразных и особенно пористых сорбентах, площадь поверхности которых трудно измерить,
, а при адсорбции на твердых порошкообразных и особенно пористых сорбентах, площадь поверхности которых трудно измерить,  и
и  определяют относительно массы адсорбента и измеряют в
определяют относительно массы адсорбента и измеряют в 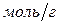 .
.
Если концентрация адсорбируемого вещества на поверхности значительно превышает его концентрацию в объеме  , можно принять, что
, можно принять, что  .
.
По количеству слоев адсорбата, образующихся на поверхности адсорбента, различают мономолекулярную (один слой) и полимолекулярную (более одного слоя) адсорбцию.
Дата добавления: 2015-12-18; просмотров: 81; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
