Стандартный водородный электрод
И электродные потенциалы
Абсолютное значение электродного потенциала металлического электрода ЕZn2+/Zn (скачок потенциала) определить невозможно. В связи с этим на практике выбирают так называемый электрод сравнения, потенциал которого принимают равным нулю при любой температуре и относительно него измеряют потенциалы всех других электродов. В электрохимии в качестве электрода сравнения выбран стандартный водородный электрод (СВЭ).
Потенциал стандартного водородного электрода принимается равным нулю при любой температуре. Е02Н+/Н2=0
В стандартном водородном электроде (СВЭ) пластина из платины, покрытая высокодисперсной платиной, погружается в раствор серной кислоты, в котором активность (концентрация) ионов водорода H + = 1 моль/л. Электрод омывается током газообразного водорода, давление которого над раствором равно 105 Па (1 бар).
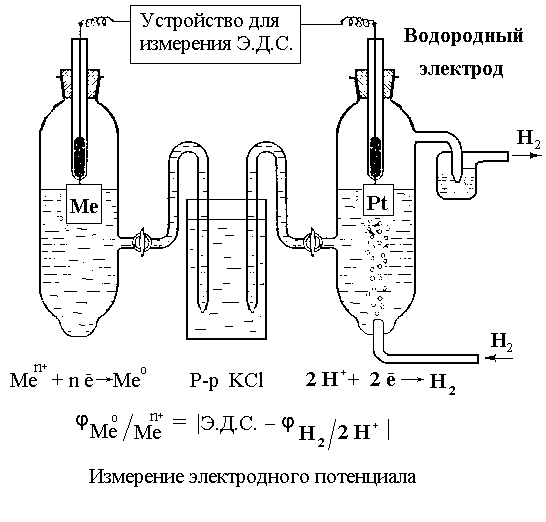
Если создавать гальваническую пару между металлическим электродом и водородным электродом, то можно измерить потенциалы всех металлов, так
как ЭДС гальванического элемента Pt, H 2 | 2H + || M z+ | M при p = 10 5 Па (1 бар), H+ = 1 моль/л соответствует потенциалу системы MZ + | M .
Если расположить потенциалы металлов в порядке возрастания, то получится ряд напряжения металлов (ряд Бекетова).

Факторы, влияющие на величину электродного потенциала:
· Природа металла: чем большей химической активностью обладает металл, тем легче он растворяется, тем отрицательнее потенциал.
|
|
|
· Концентрация ионов металла в растворе: чем больше концентрация катионов в растворе, тем положительнее потенциал.
· Температура: с повышением температуры потенциал становится более положительным.
Относительное расположение металлов в ряду стандартных электродных потенциалов характеризует их относительную активность в процессах окисления и восстановления.
1. Чем меньше значение стандартного электродного потенциала, тем сильнее выражена способность металла отдавать электроны. С увеличением Е 0 система менее активно отдает электроны.
2. Металл, не разлагающий воду, вытесняет (восстанавливает) все следующие за ним в ряду металлы из водных растворов их солей.
3. Все металлы, стоящие в ряду стандартных электродных потенциалов левее водорода, вытесняют (восстанавливают) его из разбавленных кислот (типа разбавленных серной или соляной), а металлы, стоящие правее, не вытесняют водород.
4. Чем больше разница значений стандартных электродных потенциалов двух металлов, тем большую ЭДС будет иметь построенный из них гальванический элемент.
Зависимость электродного потенциала от температуры и концентрации была изучена Нернстом. Им было получено следующее уравнение:
|
|
|
Е=Е0 +  ln a ок /авос ИЛИ:
ln a ок /авос ИЛИ:

R – газовая постоянная, 8,31 Дж/моль∙К;
F – число Фарадея, 96500 Кл/моль;
а – активность электролита;
Т – абсолютная температура, К;
E0 – стандартный электродный потенциал.
Это уравнение написано для процесса восстановления; при температуре 25С R =8,31, F =96500 K ln =2,3 lg уравнение преобразуется:
Е=Е0 +  lga ок /авос
lga ок /авос
Для металлической пластинка, опущенная в раствор уравнение принимает вид:
Е=Е0+  lg а Ме n +
lg а Ме n +
В разбавленных растворах электролитов активности можно заменить на концентрации частиц (a = C). Предполагается fa =1, то an + Me =С Me n +
Е=Е0 +  lg C Ме n +
lg C Ме n +
Дата добавления: 2022-12-03; просмотров: 29; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
