Особенности состава соединительной ткани. Роль протеогликанов и гликозамингликанов в обмене воды и катионов. Возрастные изменения соединительной ткани
Особенности химического строения соединительной ткани Соединительная ткань составляет до 50% массы человеческого организма. Это связующее звено между всеми тканями организма. Различают 3 вида соединительной ткани: - собственно соединительная ткань; - хрящевая соединительная ткань; - костная соединительная ткань Соединительная ткань может выполнять как самостоятельные функции, так и входить в качестве прослоек в другие ткани. ФУНКЦИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ 1. Структурная 2. Обеспечение постоянства тканевой проницаемости 3. Обеспечение водно-солевого равновесия 4. Участие в иммунной защите организма СОСТАВ И СТРОЕНИЕ СОЕДИНИТЕЛЬНОЙ ТКАНИ В соединительной ткани различают: МЕЖКЛЕТОЧНОЕ (ОСНОВНОЕ) ВЕЩЕСТВО, КЛЕТОЧНЫЕ ЭЛЕМЕНТЫ, ВОЛОКНИСТЫЕ СТРУКТУРЫ (коллагеновые волокна). Особенность: межклеточного вещества гораздо больше, чем клеточных элементов. МЕЖКЛЕТОЧНОЕ (ОСНОВНОЕ) ВЕЩЕСТВО Желеобразная консистенция основного вещества объясняется его составом. Основное вещество - это сильно гидратированный гель, который образован высокомолекулярными соединениями, составляющими до 30% массы межклеточного вещества. Оставшиеся 70% - это вода. Высокомолекулярные компоненты представлены белками и углеводами. Углеводы по своему строению являются гетерополисахаридами - ГЛЮКОЗОАМИНОГЛИКАНЫ (ГАГ). Эти гетерополисахариды построены из дисахаридных единиц, которые и являются их мономерами. По строению мономеров различают 7 типов ГАГ: 1. Гиалуроновая кислота 2. Хондроитин-4-сульфат 3. Хондроитин-6-сульфат 4. Дерматансульфат 5. Кератансульфат 6. Гепарансульфат 7. Гепарин Мономеры различных ГАГ построены по одному принципу. Во первых, в их состав входят гексуроновые кислоты: бета-D-глюкуроновая кислота, бета-L-идуроновая кислота. В некоторых ГАГ вместо бета-D-глюкуроновой кислоты встречается бета-D-галактоза: Вторым компонентом мономера ГАГ является амин. Гексозамины представлены глюкозамином и галактозамином, а чаще их ацетильными производными: бета-D-N-ацетилглюкозамином, бета-D-N-ацетилгалактозамином: В составе мономера гексуроновая кислота и гексозамин соединяются 1,3-бета-гликозидной связью. Исключение - гепарин (у него 1,3-альфа-гликозидная связь). Между мономерами 1,4-бета-гликозидная связь (гепарин - 1,4-альфа-гликозидная связь) (смотрите рисунок). Различаются ГАГ строением мономеров, их количеством, связями между ними. ГИАЛУРОНОВАЯ КИСЛОТА Молекулярная масса этого полимера - до 1.000.000 Da. Мономер построен из глюкуроновой кислоты и N-ацетилглюкозамина. Внутри мономера - 1,3-бета-гликозидная связь, между мономерами - 1,4-бета-гликозидная связь. Гиалуроновая кислота может находиться и в свободном виде, и в составе сложных агрегатов. Это единственный представитель ГАГ, который не сульфатирован. ХОНДРОИТИН-СУЛЬФАТЫ 2 вида: хондроитин-4-сульфат и хондроитин-6-сульфат. Отличаются друг от друга местом расположения остатка серной кислоты. Все они содержат остаток серной кислоты. Мономер хондроитин-сульфата построен из глюкуроновой кислоты и N-ацетилгалактозаминсульфата. Встречаются в связках суставов и в ткани зуба. ДЕРМАТАН-СУЛЬФАТ Его мономер построен из идуроновой кислоты и галактозамин-4-сульфата. Он является одним из структурных компонентов хрящевой ткани. КЕРАТАН-СУЛЬФАТ Мономер кератан-сульфата состоит из галактозы и N-ацетилглюкозамин-6-сульфата. ГЕПАРАН-СУЛЬФАТ и ГЕПАРИН Они сильно сульфатированы (в мономере 2-3 остатка серной кислоты). В состав их входят глюкуронат-2-сульфат и N-ацетилглюкозамин-6-сульфат. Длинные полисахаридные цепи складываются в глобулы. Однако эти глобулы рыхлые (не имеют компактной укладки) и занимают сравнительно большой объем. ГАГ являются гидрофильными соединениями, содержат много гидроксильных групп, имеют значительный отрицательный заряд (много карбоксильных и сульфогрупп). Значительный отрицательный заряд способствует присоединению к ним положительно заряженных катионов калия, натрия, кальция, магния. Это еще более увеличивает способность удерживать воду, а также способствует диссоциации молекул этих веществ в соединительной ткани. ГАГ входят в состав сложных белков, которые называются ПРОТЕОГЛИКАНАМИ. ГАГ составляют в протеогликанах 95% их веса. Остальные 5% веса - это белок. Белковый и небелковый компоненты в протеогликанах связаны прочными, ковалентными связями. Как построена молекула протеогликанов? Белковый компонент - это особый COR-белок. К нему при помощи трисахаридов присоединяются ГАГ. 1 молекула COR-белка может присоединить до 100 ГАГ. В клетке протеогликаны связаны с гиалуроновой кислотой. Образуется сложный надмолекулярный комплекс. В его составе: гиалуроновая кислота, особые связующие белки, а также протеогликаны. Упругие цепи ГАГ в составе протеогликанов образуют образуют макромолекулярные сетчатые структуры. Такое химическое строение обеспечивает выполнение функции молекулярного сита с определенными размерами пор при транспорте различных веществ и метаболитов. Размер пор определяется типом ГАГ, преобладающим в данной конкретной ткани. Например, соединительнотканая капсула почечного клубочка обеспечивает селективный транспорт веществ в процессе ультрафильтрации. За счет множества сульфо- и карбоксильных групп сетчатые структуры являются полианионами, способными депонировать воду, некоторые катионы (К+, Na+, Ca+2, Mg+2). Кроме протеогликанов, основное вещество содержит гликопротеины. ГЛИКОПРОТЕИНЫ Их углеводный компонент - это олигосахарид, состоящий 10 - 15 мономерных единиц. Этими мономерными единицами могут быть в основном минорные моносахариды: манноза, метилпентозы рамноза и фукоза, арабиноза, ксилоза. На конце этого олигосахарида имеется еще одно производное моносахаридов: сиаловые кислоты (ацильные производные нейраминовой кислоты). Если в крови увеличивается концентрация сиаловых кислот - значит, идет распад межклеточного матрикса. Это бывает при воспалении. ГЛИКОПРОТЕИНЫ делят на 2 группы: 1. Растворимые 2. Нерастворимые. Углеводная часть гликопротеинов очень вариабельна. Важное значение имеет последовательность моносахаридов, как и последовательность аминокислот в белковой части. Из гликопротеинов наиболее изучены растворимый фибронектин и нерастворимый ламинин. РАСТВОРИМЫЕ гликопротеины представлены особым белком - ФИБРОНЕКТИНом. Молекулярная масса фибронектина - 440 kDa. Он состоит из двух полипептидных цепей, соединенных дисульфидным мостиком. Имеет центры связывания с протеогликанами, с волокнистыми структурами, гликолипидами клеточных мембран. Поэтому фибронектин называют "молекулярным клеем". Он обычно располагается на поверхности фибробластов и участвует в адгезии всех перечисленных клеточных структур, а, значит, и клеток. Известно, что при опухолевых заболеваниях количество фибронектина снижается, что способствует метастазированию опухоли. К растворимым гликопротеинам также относятся COR-белок - компонент протеогликанов, связующие белки, а также целый ряд белков плазмы крови. НЕРАСТВОРИМЫЕ гликопротеины образуют "каркас", "строму" межклеточного матрикса. К нерастворимым гликопротеинам относится ЛАМИНИН. Молекулярная масса этого белка - 10000 kDa. Содержит такие же углеводные компоненты, как и ганглиозиды клеточных мембран. Углеводные компоненты гликопротеинов также, как и углеводные компоненты гликопротеинов обладают свойствами тканевых антигенов. КАТАБОЛИЗМ КОМПОНЕНТОВ ОСНОВНОГО ВЕЩЕСТВА Идет под действием некоторых гидролаз. Например, НЕЙРАМИНИДАЗА отщепляет от гликопротеинов N-ацетилнейраминовую (сиаловую) кислоту, и уже дестабилизированный гликопротеин поглощается макрофагами. Поэтому концентрация сиаловых кислот в крови - характеристика состояния соединительной ткани. При воспалительных процессах эта концентрация намного возрастает. При недостаточности ферментов катаболизма основного вещества развиваются заболевания - мукополисахаридозы, при которых в тканях происходит накопление тех или иных ГАГ. ВОЛОКНА СОЕДИНИТЕЛЬНОЙ ТКАНИ В межклеточном матриксе находятся 2 типа волокнистых структур: КОЛЛАГЕНОВЫЕ и ЭЛАСТИНОВЫЕ ВОЛОКНА. Основным их компонентом является нерастворимый белок КОЛЛАГЕН. КОЛЛАГЕН - сложный белок, относится к группе гликопротеинов, имеет четвертичную структуру, его молекулярная масса составляет 300 kDa. Составляет 30% от общего количества белка в организме человека. Его фибриллярная структура - это суперспираль, состоящая из 3-х альфа-цепей. Нерастворим в воде, солевых растворах, в слабых растворах кислот и щелочей. Это связано с особенностями первичной структуры коллагена. В коллагене 70% аминокислот являются гидрофобными. Аминокислоты по длине полипептидной цепи расположены группами (триадами), сходными друг с другом по строению, состоящими из трех аминокислот. Каждая третья аминокислота в первичной структуре коллагена - это глицин (триада (или группа): (гли-X-Y)n, где X - любая аминокислота или оксипролин, Y - любая аминокислота или оксипролин или оксилизин). Эти аминокислотные группы в полипептидной цепи многократно повторяются. Необычна и вторичная структура коллагена: шаг одного витка спирали составляют только 3 аминокислоты (даже немного меньше, чем 3), а не 3.6 аминокислоты на 1 виток, как это наблюдается у других белков. Такая плотная упаковка спирали объясняется присутствием глицина. Эта особенность определяет высшие структуры коллагена. Молекула коллагена построена из 3-х цепей и представляет собой тройную спираль. Эта тройная спираль состоит из 2-х альфа-1-цепей и одной альфа-2-цепи. В каждой цепи 1.000 аминокислотных остатков. Цепи параллельны и имеют необычную укладку в пространстве: снаружи расположены все радикалы гидрофобных аминокислот. Известно несколько типов коллагена, различающихся генетически. СИНТЕЗ КОЛЛАГЕНА Существуют 8 этапов биосинтеза коллагена: 5 внутриклеточных и 3 внеклеточных. 1-Й ЭТАП Протекает на рибосомах, синтезируется молекула-предшественник: препроколлаген. 2-Й ЭТАП С помощью сигнального пептида “пре” транспорт молекулы в канальцы эндоплазматической сети. Здесь отщепляется “пре” - образуется “проколлаген”. 3- Й ЭТАП Аминокислотные остатки лизина и пролина в составе молекулы коллагена подвергаются окислению под действием ферментов пролилгидроксилазы и лизилгидроксилазы (эти окислительные ферменты относятся к подподклассу монооксигеназ) (смотрите рисунок). При недостатке витамина “С” - аскорбиновой кислоты наблюдается цинга, - заболевание, вызванное синтезом дефектного коллагена с пониженной механической прочностью, что вызывает, в частности, разрыхление сосудистой стенки и другие неблагоприятные явления. 4-Й ЭТАП Посттрасляционная модификация - гликозилирование проколлагена под действием фермента гликозил трансферазы. Этот фермент переносит глюкозу или галактозу на гидроксильные группы оксилизина. 5-Й ЭТАП Заключительный внутриклеточный этап - идет формирование тройной спирали - тропоколлагена (растворимый коллаген). В составе про-последовательности - аминокислота цистеин, который образует дисульфидные связи между цепями. Идет процесс спирализации. 6-Й ЭТАП Секретируется тропоколлаген во внеклеточную среду, где амино- и карбоксипротеиназы отщепляют (про-)-последовательность. 7-Й ЭТАП Ковалентное “сшивание” молекулы тропоколлагена по принципу “конец-в-конец” с образованием нерастворимого коллагена. В этом процессе принимает участие фермент лизилоксидаза (флавометаллопротеин, содержит ФАД и Cu). Происходит окисление и дезаминирование радикала лизина с образованием альдегидной группы. Затем между двумя радикалами лизина возникает альдегидная связь. Только после многократного сшивания фибрилл коллаген приобретает свою уникальную прочность, становится нерастяжимым волокном. Лизилоксидаза является Cu-зависимым ферментом, поэтому при недостатке меди в организме происходит уменьшение прочности соединительной ткани из-за значительного повышения количества растворимого коллагена (тропоколлагена). 8-Й ЭТАП Ассоциация молекул нерастворимого коллагена по принципу “бок-в-бок”. Ассоциация фибрилл происходит таким образом, что каждая последующая цепочка сдвинута на 1/4 своей длины относительно предыдущей цепи. ЭЛАСТИЧЕСКИЕ ВОЛОКНА 2-й вид волокон - эластические. В основе строения - белок ЭЛАСТИН. Эластин еще более гидрофобен, чем коллаген. В нем до 90% гидрофобных аминокислот. Много лизина, есть участки со строго определенной последовательностью расположения аминокислот. Цепи укладываются в пространстве в виде глобул. Глобула из одной полипептидной цепи называется альфа-эластин. За счет остатков лизина происходит взаимодействие между молекулами альфа-эластина. В образовании этой структуры принимают участие радикалы аминокислоты лизина. Это структура ДЕСМОЗИНА. ДЕСМОЗИН - это структура пиридина, которая образуется при взаимодействии лизина 4-х молекул альфа-эластина. КЛЕТОЧНЫЕ ЭЛЕМЕНТЫ СОЕДИНИТЕЛЬНОЙ ТКАНИ. Это ФИБРОБЛАСТЫ, ТУЧНЫЕ КЛЕТКИ и МАКРОФАГИ. В них происходят процессы синтеза структурных компонентов, а также процесс распада соединительной ткани. Коллаген обновляется на 50% за 10 лет. В фибробластах идут синтетические процессы: синтез коллагена, эластина.
|
|
|
|
|
|
|
|
|
|
|
|
ІІ- этап
61. Альбумины, глобулины, свойства. Сходство и отличие их друг от друга. Значение для животного организма, распространение в природе.
Альбумин и Глобулин белки, которые есть во всех тканях. Сыворотка крови наиболее богата этими белками. Содержание альбуминов в ней составляет 40-45 г/л, глобулинов 20-30 г/л, т.е на долю альбуминов приходится более половины белков плазмы крови.
Альбумин – это белок плазмы крови. Белок синтезируется почти исключительно в печени. Хотя по классификации его относят к простым белкам , отмечается широкая микрогетерогенность молекул альбумина, что связано с количеством и качеством агрегированных с альбумином молекул.
Глобулины — семейство глобулярных белков крови, имеющих более высокую молекулярную массу и меньшую растворимость в воде, чем альбумины. Глобулины вырабатываются печенью и иммунной системой. Глобулины, альбумины и фибриноген называют основными белками плазмы крови. Нормальная концентрация глобулинов в крови 2.6-4.6 г/децилитр. Глобулины составляют почти половину белков крови; определяют иммунные свойства организма; определяют свертываемость крови; участвуют в переносе железа и в других процессах.
62.Протамины, гистоны, свойства. Сходство и отличие их друг от друга. Значение для животного организма, распространение в природе.
Гистоны - тканевые белки многоклеточных организмов, связанных с ДНК хроматина. Это белки небольшой молекулярной массы (11000-24000); по электрохимическим свойствам относятся к белкам с резко выраженными основными признаками (изоэлектрическая точка у разных гистонов колеблется в пределах 9,5-12,0). Гистоны имеют только третичную структуру. Выделяют 5 главных типов или фракций гистонов. Основные функции гистонов - структурная и регуляторная. Структурная функция состоит в том, что гистоны участвуют в стабилизации пространственной структуры ДНК, а следовательно, хроматина и хромосом. Четыре фракции гистонов, за исключением Н1, составляют основу нуклеосом, являющихся структурными единицами хроматина; фракция Н1 заполняет фрагменты ДНК между нуклеосомами. Регуляторная функция заключается в способности блокировать передачу генетической информации от ДНК к РНК.
Протамины - своеобразные биологические заменители гистонов, но качественно отличающиеся от них аминокислотным составом и структурой. Это самые низкомолекулярные белки (М 4000-12000), они обладают резко выраженными основными свойствами из-за большого содержания аргинина (до 80%). Как и гистоны, протамины - поликатионные белки; они связываются с ДНК в хроматине спермиев. Замена гистонов на протамины в хроматине спермиев наблюдается не у всех животных. Наиболее типично присутствие протаминов в составе нуклеопротамина в сперматозоидах рыб (в молоках). Отдельные протамины получили свое название по источнику получения: cальмин - протамин из молоки лосося; клупеин - из икры сельди; труттин - из молоки форели; скумбрин - из молоки скумбрии.
Протамины делают компактной ДНК сперматозоидов, т. е. выполняют, как и гистоны, структурную функцию. Однако они, по-видимому, не выполняют регуляторных функций, поэтому и присутствуют в клетках, не способных к делению. Возможно, этим и объясняется биологическая замена в некоторых клетках гистонов на протамины. Свойства:
1.Хорошо растворяются в воде, кислой и нейтральной среде.
2.Осаждаются щелочами.
3.Отсутствует денатурации при нагревании.
4.Образуют соли с кислотами и комплексы с кислыми белками
63.Коллагены, эластины, кератины. Особенности аминокислотного состава, свойства, распространение в природе. Значение для животного организма.
Коллаген (рождающий клей) – широко распространённый в организме белок, составляет около трети всех белков организма. Входит в состав костей, хрящей, зубов, сухожилий и других видов соединительной ткани.
К особенностям аминокислотного состава коллагена относится, прежде всего, высокое содержание глицина (1/3 всех аминокислот), пролина (1/4 всех аминокислот), лейцина. В составе коллагена присутствуют редкие аминокислоты гидроксипролин и гидроксилизин, но отсутствуют циклические аминокислоты. Полипептидные цепи коллагена содержит около 1000 аминокислот. Различают несколько видов коллагена в зависимости от сочетания в нём различных видов полипептидных цепей
Кератины - белки волос, ногтей. Они не растворимы в растворах солей, кислот, щелочей. В составе кератинов имеется фракция, которая содержит большое количество серосодеоржащих аминокислот (до 7 – 12%), образующих дисульфидные мостики, придающие высокую прочность этим белкам. Молекулярная масса кератинов очень высока, достигает 2 000 000 д. Кератины могут иметь α– структуру и β- структуру. В α - кератинах три α - спирали объединяются в суперспираль, формирующую протофибриллы. Протофибриллы объединяются в профибриллы, затем в макрофибриллы. Примером β - кератинов является фиброин шёлка.
Эластин – белок эластических волокон, связок, сухожилий. Эластин не растворим в воде, не способен к набуханию. В эластине высока доля глицина, валина, лейцина (до 25 – 30%). Эластин способен растягиваться под действием нагрузки и восстанавливать свои размеры после снятия нагрузки. Эластичность связана с присутствием в эластине большого количества межцепочечных сшивок при участии аминокислоты лизина. Две цепи образуют связь лизил – норлейцин, четыре цепи образуют связь – десмозин.
64. Сложные белки: фосфопротеиды, металлопротеиды. Понятие о строении, основные представители, свойства, значение для животного организма.
Фосфопротеиды — сложные белки, содержащие фосфорную кислоту.Обычно фосфорильная группа (=PO32-) присоединена к молекулам Ф. через остатки аминокислот серина илитреонина; в митохондриях животных тканей обнаружены Ф., в которых фосфорильная группа присоединена к белку через имидазольное кольцогистидина. Перенос фосфорильного остатка на белок катализируется ферментом протеинкиназой из группы фосфотрансфераз, донором фосфата при этом служит молекула аденозинтрифосфорной кислоты (АТФ). Под действием щёлочи происходит неферментативное отщепление фосфорильной группы; к влиянию кислот Ф. сравнительно устойчивы. К Ф. относятся: казеин = один из основных белков молока, овальбумин и вителлин = белки куриного яйца, фосфорилированные модификации гистонов, ферменты РНК-полимеразы, некоторые фосфотрансферазы, фосфатазы и др. Ф. широко распространены в живых организмах, участвуя в обмене веществ, регуляции ядерной активности клетки, транспорте ионов и окислительных процессах в митохондриях.
Металлопротеиды – группа сложных белков, молекулы которых содержат ионы металлов (Fe, Zn, Mg, Mn, Co, Mo, Ca и др.). В молекулах металлопротеидов металлы связаны непосредственно с белковой частью.
В зависимости от типа связи между металлом и белковой частью различают транспортные, запасающие и истинные маталлопротеиды – металлоферменты. Самыми важными металлоферментами являются: тирозиназа (содержит медь), карбоангидраза и карбоксипептидаза (содержат цинк), ксантиноксидаза (содержит молибден). Металлопротеидами также являются железо- и молибденосодержащие белки азотфиксирующей нитрогеназной системы бактерий (железосодержащий фередоксин и т.д.).
65.Сложные белки: хромопротеиды, строение, своиства, значение для организма.
Хромопротеиды содержат в качестве простетической группы окрашенные небелковые соединения. В группе хромопротеидов выделяют гемопротеиды и флавопротеды. В гемопоротеидах простетической группой является гем – органическое, железосодержащее вещество, придающее белку красный цвет. Гем соединяется с белком глобином за счёт координационных и гидрофобных связей. Примерами гемопротеидов являются белок эритроцитов гемоглобин, белок мышц миоглобин, тканевые белки цитохромы, ферменты каталаза, пероксидаза. Гемопротеиды участвуют в переносе кислорода и в окислительных процессах в тканях.
В флавопротеидах содержится простетическая группа жёлтого цвета. В качестве простетической группы могут быть представлены нуклеотиды ФАД, ФМН. К флавопротеидам относится фермент сукцинатдегидрогеназа. Некоторые флавопротеиды содержат в своём составе металлы – металлофлавопротеиды. Флавопротеиды участвуют в окислительных процессах в организме.
66. Гемоглобин, миоглобин, строение, значение для организма, свойства, химическая природа простетической группы.
Гемоглобин представляет собой белок четвертичной структуры, состоящий из двух пар субъединиц альфа- (141 АКО) и бетта- (147 АКО- аминокислотных остатков). Субъединицы миоглобина и гемоглобина очень сходны между собой, как весьма сходна и третичная структура обоих белков.
Миоглобин- сложный белок третьего уровня структурной организации. Состоит из одной полипептидной цепи (153 остатка). Третичная структура белка образована, главным образом, альфа-спиралями вторичной структуры, на которые приходится около 70 процентов АКО, остальные- на повороты и начальный и конечный участки. Белок содержит в себе так называемый ГЕМ- комплекс порфирина и иона железа в степени окисления +2. Миоглобин сосредоточен, главным образом, в мышцах и его главной функцией является хранение кислорода. Скорость насыщения миоглобина кислородом намного превышает таковую для гемоглобина. Миоглобин мало приспособлен для транспортировки кислорода из легких в ткани, поскольку скорость отдачи кислорода в тканях невелика (при давлении 1 мм рт. ст. примерно половина миоглобина все еще не отдает кислород). Главное отличие гемоглобина от миоглобина заключается в проявлении особого рода эффектов- кооперативных, влияющих на скорости присоединения- отсоединения молекул кислорода. Каждая молекула гемоглобина способна присоединять и переносить четыре молекулы кислорода, при этом кооперативность проявляется в том, что как присоединение, так и отсоединение каждой последующей молекулы кислорода облегчается в результате структурных изменений в конформации молекулы, которых у гемоглобина имеется две основных- оксигенированная и дезоксигенированная.
67. Сложные белки: гликопротеиды, строение, основные представители.Свойства, распространение в природе, истинные гликопротеиды и протеогликаны, отличие и сходства в строении и роли.
Гликопротеид - это сложные белки, содержащие в качестве простетической группы УГВ и их производные (D-галактозу, D-маннозу, D-глюкозу, L-фукозу, N-ацетилглюкозамин, N-ацетилгалактозу, сиаловую кислоту, арабинозу, нейраминовую кислоту, ксилозу) (гликановая фракция). Гликановая фракция ковалентно связана с неуглеводной частью (агликановой фракцией), которая может быть представлена белком, пептидом, аминокислотой, липидом. Углеводы прикреплены к неуглеводной части через О-гликозидную связь к гидроксигруппам сер, тре. Свойства ГП: высокая молекулярная масса, высокая вязкость, кислый характер, осаждение в кислой среде, термостабильность, устойчивы к действию ферментов за счет УГВ части. Свойства определяют биологическую роль. В природе ГП встречаются часто: в плазме крови, слюне, различных секретах, в межклеточном веществе, соединительной ткани, в мембранах. истинные ГП. 80-90% белка и 10-20% простетическая группа. Своеобразие белковой части заключается в том, что 2/3 всех аминокислот составляют 4 аминокислоты: тре, про, сер, ала. Простетическая группа – нерегулярные УГВ: преобладают олигосахаридные участки, состоящие из ацетилгексозаминов, фукозы, арабинозы, ксилозы, галактозы и маннозы. В меньшей степени имеются нейтральные мукополисахариды, содержащие нейраминовую и сиаловую кислоты. Представители: иммуноглобулины, муцины, сиалопротеиды, некоторые гормоны (ФСГ, ТТГ), рецепторы к гормонам, некоторые ферменты (холинэстераза), белки, обуславливающие групповую принадлежность крови, протромбин, транспортные белки (транскортин, гаптоглобин, церулоплазмин) и др. Муцины (мукопротеины) – это белки слизи, слюны, секретов всех желез ЖКТ, дыхательных путей, МВС. Роль – защитная. В слизи рыб и земноводных они предохраняют от воздействия вредных внешних факторов. Белки, определяющие групповую принадлежность крови содержат 80-85% УГВ (манноза, фукоза, глюкоза, сиаловые кислоты). Важное значение в определении группы крови имеет строение конечных УГВ в молекулах этих белков. антигенная активность этих белков определяется следующей последовательностью углеводов на концах углеводной цепи: Д-галактоза-N-ацетилглюкозамин и Д-галактоза-N-ацетилгалактозамин. Группа крови зависит от тог, какой углевод присоединен к этому фрагменту. Установлено, что детерминантными сахарами являются L-фукоза для первой группы крови, альфа-N-ацетилгалактозамин для второй группы крови, альфа-D-галактоза для третьей группы крови.
68. Гликозамингликаны представители, химическая природа, значение для организма.
Гликозаминогликаны (мукополисахариды, от лат. mucus — «слизь») — углеводная часть протеогликанов, полисахариды, в состав которых входят аминосахара-гексозамины. В организме гликозаминогликаны ковалентно связаны с белковой частью протеогликанов и в свободном виде не встречаются. Гликозаминогликаны подразделяются на семь основных типов. Шесть из них структурно сходны — в их полисахаридных цепях чередуются дисахаридные звенья, состоящие из остатков сульфатированных аминосахаров (N-ацетилглюкозамина и N-ацетилгалактозамина) и гексуроновых кислот (D-глюкуроновой или L-идуроновой). Это:
гиалуроновые кислоты
хондроитин-4-сульфат
хондороитин-6-сульфат
дерматансульфат
гепарин
гепарансульфат
В гликозаминогликанах седьмого типа — кератансульфате, или кератосульфате, в дисахаридных звеньях — вместо уроновых кислот находится D-галактоза. Гликозаминогликаны в составе протеогликанов входят в состав межклеточного вещества соединительной ткани, содержатся в костях, синовиальной жидкости, стекловидном теле и роговице глаза. Вместе с волокнами коллагена и эластина, протеогликаны образуют соединительнотканный матрикс (основное вещество). Один из представителей гликозаминогликанов — гепарин, обладающий противосвёртывающей активностью, находится в межклеточном веществе ткани печени, лёгких, сердца, стенках артерий.
69.Гидролазы: эстеразы и гликозидазы. Представители, каталитическое действие, место нахождение.
Эстеразы - ферменты, катализирующие в клетках гидролитическое расщепление сложных эфиров (англ. esters) на спирты и кислоты при участии молекул воды (гидролиз).Эстеразы принадлежат к классу гидролаз. Они участвуют в реакциях расщепления сложноэфирной связи в органических соединениях. Гликозидазы - группа ферментов класса гидролаз, катализирующих гидролитическое расщепление эфирных связей в гликозидах; участвуют в процессах превращения углеводов.
70.Гидролазы: пептидгидролазы. Основные подклассы, представители, каталитическое действие, место нахождение. Проферменты, механизм активизации проферментов в ферменты.
Подкласс пептидгидролазы действует на белки и способствует расщеплению пептидных связей. Он делится на 2 подподкласса:
1.Эндопептидазы - гидролизуют пептидные связи внутри молекулы белков, расщепляя их до полипептидов;
2.Экзопептидазы – гидролизуют пептидные связи на концах полипептидов, расщепляя их до отдельных аминокислот.
Проферменты, или проэнзимы, зимогены, энзимогены — функционально неактивные предшественники ферментов, подвергающиеся тем или иным преобразованиям (обычно расщеплению специфическими эндо- или экзопептидазами или гидролизу), в результате чего образуется каталитически активный продукт — фермент.
71. Цикл трикарбоновых кислот, сущность, последовательность реакции, роль ЦТК.
Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г. Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов. В дальнейшем было показано, что цикл трикарбо-новых кислот является тем центром, в котором сходятся практически все метаболические пути. Таким образом, цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизмабольшая часть органических молекул, играющих роль «клеточного топлива»: углеводов, жирных кислот иаминокислот. Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает вцикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций . Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота путем ряда дегидрирований и двух декарбоксилирований теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат, т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула окса-лоацетата регенерируется.
72. Тиамин, строение, участие в образовании коферментов, биологическое значение, суточная потребность, распространение в природе, авитаминоз.
Витамин B1 (тиамин). Структура витамина включает пиримидиновое и тиазоловое кольца, соединённые метановым мостиком. Витамин В1 - первый витамин, выделенный в ристаллическом виде К. Функом в 1912 г. Суточная потребность взрослого человека в среднем составляет 2-3 мг витамина В1.Широко распространён в продуктах растительного происхождения (оболочка семян хлебных злаков и риса, горох, фасоль, соя и др.). В организмах животных витамин В1, содержится в виде (ТДФ); он образуется в печени, почках, мозге, сердечной мышце путём фосфорилирования тиамина при участии тиаминкиназы иАТФ.Биологическая роль витамина В, определяется тем, что в виде ТДФ он входит в состав как минимум трёх ферментов и ферментных комплексов: в составе пируват- и ос-кетоглутаратдегидрогеназных комплексов он участвует в окислительном декарбоксилировании пирувата и ос-кетоглутарата; в составе транскетолазы ТДФ участвует в пентозофосфатном пути превращения углеводов. Основной, наиболее характерный и специфический признак недостаточности витамина В1- полиневрит, в основе которого лежат дегенеративные изменения нервов. Вначале развивается болезненность вдоль нервных стволов, затем - потеря кожной чувствительности и наступает паралич (бери-бери). К характерным признакам заболевания, связанного с недостаточностью витамина В1относят также нарушения секреторной и моторной функций ЖКТ.
73. Рибофлавин, строение, участие в образовании коферментов, биологическое значение, суточная потребность, распространение в природе.
Витамин В2 (рибофлавин). В основе структуры витамина В2 лежит структура изоаллоксазина, соединённого со спиртом рибитолом. Суточная потребность в витамине В2 взрослого человека составляет 1,8-2,6 мг.
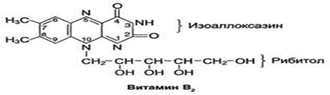
Главные источники витамина В2 - печень, почки, яйца, молоко, дрожжи. Витамин содержится также в шпинате, пшенице, ржи. Частично человек получает витамин В2 как продукт жизнедеятельности кишечной микрофлоры.Биологические функции. В слизистой оболочке кишечника после всасывания витамина происходит образование коферментов FMN и FAD. Коферменты FAD и FMN входят в состав флавиновых ферментов, принимающих участие в окислительно-восстановительных реакциях.
74. Никотинамид, строение, участие в образовании коферментов, биологическое действие, суточная потребность, распространение в природе, авитаминоз.
Витамин РР (никотиновая кислота, никотинамид, витамин B3) Источники. Витамин РР широко распространён в растительных продуктах, высоко его содержание в рисовых и пшеничных отрубях, дрожжах, много витамина в печени и почках крупного рогатого скота и свиней. Суточная потребность в этом витамине доставляет для взрослых 15-25 мг, для детей - 15 мг.Недостаточность витамина РР приводит к заболеванию "пеллагра".

Биологические функции. Никотиновая кислота в организме входит в состав NAD и NADP, выполняющих функции коферментов различных дегидрогеназ. Синтез NAD в организме протекает в 2 этапа: NADP образуется из NAD путём фосфорилирования под действием цитоплазматической NAD-киназы. NAD+ + АТФ → NADP+ + АДФ
75. Пиридоксин, строение, участие в образовании коферментов, биологическое значение, суточная потребность, распространение в природе.
Витамин В6(пиридоксин, пиридоксаль,пиридоксамин) C8H11NO3.В основе структуры витамина В6 лежит пиридиновое кольцо. Известны 3 формы витамина В6, отличающиеся строением замещающей группы у атома углерода в п-положении к атому азота. Все они характеризуются одинаковой биологической активностью.Источники витамина В6 для человека - такие продукты питания, как яйца, печень, молоко, зеленый перец, морковь, пшеница, дрожжи. Суточная потребность составляет 2-3 мг.Биологические функции. Все формы витамина В6 используются в организме для синтеза кофер-ментов: пиридоксальфосфата и пиридоксаминфосфата. Коферменты образуются путём фос-форилирования по гидроксиметильной группе в пятом положении пиримидинового кольца при участии фермента пиридоксалькиназы и АТФ как источника фосфата.Клинические проявления недостаточности витамина. Авитаминоз В6 у детей проявляется повышенной возбудимостью ЦНС, периодическими судорогами. У взрослых признаки гиповитаминоза В6 наблюдают при длительном лечении туберкулёза изониазидом . При этом возникают поражения нервной системы (полиневриты), дерматиты.
76. Витамин Вс и В12, понятие о строении, участие в образовании коферментов. Биологическое значение, суточная потребность, распространение в природе, авитаминоз.
Витамин В12 (кобаламин) Витамин В12 был выделен из печени в кристаллическом виде в 1948 г. В 1955 г. Дороти Ходжкен с помощью рештено-структурного анализа расшифровала структуру этого витамина. За эту работу в 1964 г. ей была присуждена Нобелевская премия. Витамин В12 - единственный витамин, содержащий в своём составе металл кобальт. Ни животные, ни растения не способны синтезировать витамин В12. Это единственный витамин, синтезируемый почти исключительно микроорганизмами: бактериями, актиномицетами и сине-зелёными водорослями. Из животных тканей наиболее богаты витамином В12 печень и почки. Суточная потребность в витамине В12 крайне мала и составляет всего 1-2 мкг.Основной признак авитаминоза В12 - макроцитарная (мегалобластная) анемия. Для этого заболевания характерны увеличение размеров эритроцитов, снижение количества эритроцитов в кровотоке, снижение концентрации гемоглобина в крови. Нарушение кроветворения связано в первую очередь с нарушением обмена нуклеиновых кислот, в частности синтеза ДНК в быстроделящихся клетках кроветворной системы.
77. Витамины С и Р, строение, физиологическое природе, авитаминоз.Ретинол, понятие о строении, физиологическое (действие) значение, авитаминоз, суточная потребность, распространение в природе.
Витамин С Аскорбиновая кислота - лактон кислоты, близкой по структуре к глюкозе. Существует в двух формах: восстановленной (АК) и окисленной (дегидроаскорбиновой кислотой, ДАК). Источники витамина С - свежие фрукты, овощи, зелень.Суточная потребность человека в витамине С составляет 50-75 мг.Биологические функции. Главное свойство аскорбиновой кислоты - способность легко окисляться и восстанавливаться. Вместе с ДАК она образует в клетках окислительно-восстановительную пару с редокс-потенциалом +0,139 .Клинические проявления недостаточности витамина С. Недостаточность аскорбиновой кислоты приводит к заболеванию, называемому цингой (скорбут). Цинга.Это заболевание связано с недостатком в пище витамина С. Болеют цингой только человек, приматы и морские свинки. Наблюдают разрыхление дёсен, расшатывание зубов, нарушение целостности капилляров. Возникают отёки, боль в суставах, анемия. Анемия при цинге может быть связана с нарушением способности использовать запасы железа, а также с нарушениями метаболизма фолиевой кислоты.
Витамин Р (биофлавоноиды)В настоящее время известно, что понятие "витамин Р" объединяет семейство биофлавоноидов. Это очень разнообразная группа растительных полифенольных соединений, влияющих на проницаемость сосудов сходным образом с витамином С.Биологическая роль флавоноидов заключается в стабилизации межклеточного матрикса соединительной ткани и уменьшении проницаемости капилляров. Многие представители группы витамина Р обладают гипотензивным действием.Клиническое проявление гипоавитаминоза витамина Р характеризуется повышенной кровоточивостью дёсен и точечными подкожными кровоизлияниями, общей слабостью, быстрой утомляемостью и болями в конечностях.Продукты богатые витамином Р-Лимон, грейпфрут,абрикос,гречка,черешня,смородина.
78. Кальциферолы, строение, особенно-активные формы витаминов биологическое значение, суточная потребность, распространение в природе, авитаминоз.
Витамин D (кальциферол) представляет собой одновременно и гормон и жирорастворимый витамин, «витамин солнца». В 1936 году он был выделен из рыбьего жира.Кальциферолы - группа химически родственных соединений, относящихся к производным стеринов. Наиболее биологически активные витамины - D2 и D3. Витамин D2 (эргокалыщферол), производное эргостерина - растительного стероида, встречающегося в некоторых грибах, дрожжах и растительных маслах. При облучении пищевых продуктов УФО из эргостерина получается витамин D2, используемый в лечебных целях. Витамин D3, имеющийся у человека и животных, - холекальциферол, образующийся в коже человека из 7-дегидрохолестерина под действием УФ-лучей.Витамины D2 и D3 - белые кристаллы, жирные на ощупь, нерастворимые в воде, но хорошо растворимые в жирах и органических растворителях.Источники. Наибольшее количество витамина D3 содержится в продуктах животного происхождения: сливочном масле, желтке яиц, рыбьем жире.Суточная потребность для детей 12-25 мкг (500-1000 ME), для взрослого человека потребность значительно меньше.Биологическая роль. Кальциферол выполняет гормональную функцию, участвуя в регуляции обмена Са2+ и фосфатов, стимулируя всасывание Са2+ в кишечнике и кальцификацию костной ткани, реабсорбцию Са2+и фосфатов в почках. При низкой концентрации Са2+ или высокой концентрации D3 он стимулирует мобилизацию Са2+ из костей Недостаточность. При недостатке витамина D у детей развивается заболевание "рахит", характеризуемое нарушением кальцификации растущих костей. Избыток.Поступление в организм избыточного количества витамина D3 может вызвать гипервитаминоз D. Это состояние характеризуется избыточным отложением солей кальция в тканях лёгких, почек, сердца, стенках сосудов, а также остеопорозом с частыми переломами костей.
79. Витамин К и Е, понятие о строении, биологическое значение, распространение в природе, суточная потребность.
Витамин К — общее название группы веществ, включающей филлохинон и родственные соединения с модифицированной боковой цепью. Недостаток витамина К наблюдается довольно редко, так как эти вещества вырабатываются микрофлорой кишечника. Витамин К принимает участие в карбоксилировании остатков глутаминовой кислоты белков плазмы крови, что важно для нормализации или ускорения процесса свертывания крови . Процесс ингибируется антагонистами витамина К (например, производными кумарина), что находит применение как один из методов лечения тромбозов.Суточная потребность в витамине взрослого составляет 1-2 мгБиологическая функция витамина К . Он участвует в активации факторов свёртывания крови: протромбина (фактор II), проконвертина (фактор VII), фактора Кристмаса (фактор IX) и фактора Стюарта (фактор X). Эти белковые факторы синтезируются как неактивные предшественники. Для лечения и предупреждения гиповитаминоза К используют синтетические производные нафтохинона: менадион, викасол, синкавит.
Витамин Е был выделен из масла зародышей пшеничных зёрен в 1936 г. и получил название токоферол.Они - метальные производные исходного соединения токола, по строению очень близки и обозначаются буквами греческого алфавита. Наибольшую биологическую активность проявляет α-токоферол.Токоферолы представляют собой маслянистую жидкость, хорошо растворимую в органических растворителях.Источники витамина Е для человека - растительные масла, салат, капуста, семена злаков, сливочное масло, яичный желток.Суточная потребность взрослого человека в витамине примерно 5 мг.Биологическая роль. По механизму действия токоферол является биологическим антиоксидантом.Токоферол повышает биологическую активность витамина А, защищая от окисления ненасыщенную боковую цепь.Клинические проявления недостаточности витамина Е у человека до конца не изучены. Известно положительное влияние витамина Е при лечении нарушения процесса оплодотворения, при повторяющихся непроизвольных абортах, некоторых форм мышечной слабости и дистрофии.
80.Аэробный распад глюкозы, последовательность реакции, физиологическое значение, энергетическая ценность.
Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки. В аэробном гликолизе можно выделить 2 этапа.
1. Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ.
2. Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.
82.Анаэробный гликолиз, последовательность реакции, физиологическое значение, энергетическая ценность. Каких патологических процессах происходит.
В определённых ситуациях обеспечение кислородом тканей может не соответствовать их потребностям. Например, на начальных стадиях интенсивной мышечной работы при стрессе сердечные сокращения могут не достигать нужной частоты, а потребности мышц в кислороде для аэробного распада глюкозы велики. В подобных случаях включается процесс, который протекает без кислорода и заканчивается образованием лактата из пировиноградной кислоты. Этот процесс называют анаэробным распадом, или анаэробным гликолизом. Анаэробный распад глюкозы энергетически малоэффективен, но именно этот процесс может стать единственным источником энергии для мышечной клетки в описанной ситуации. В даньнейшем, когда снабжение мышц кислородом будет достаточным в результате перехода сердца на ускоренный ритм, анаэробный распад переключается на аэробный.
83.Биосинтез холестерина, последовательность реакций до образования мевалоновой кислоты, представление о дальнейших этапах. Роль липопротеидов в обмене холестерина.
Холестерин — важная составная часть клеточных мембран животных клеток. Суточная потребность в холестерине (1 г) может в принципе покрываться за счет биосинтеза. При смешанной диете примерно половина суточной нормы холестерина синтезируется в кишечнике, коже и главным образом в печени , а остальной холестерин поступает с пищей. Значительная часть холестерина включена в липидный слой плазматических мембран. Большое количество холестерина расходуется в биосинтезе желчных кислот, часть выделяется с желчью.Биосинтез холестерина, как и всех изопреноидов, начинается с ацетил-КоА . Биосинтез холестерина можно разделить на четыре этапа. На первом этапе (1) из трех молекул ацетил-КоА образуется мевалонат (С6). На втором этапе (2) мевалонат превращается в «активный изопрен», изопентенилдифосфат. На третьем этапе (3) шесть молекул изопрена полимеризуются с образованием сквалена (С30). Наконец, сквален циклизуется с отщеплением трех атомов углерода и превращается в холестерин.

84.Транспортные формы липидов, особенности состава, судьба.
62Липопротеи́ны (липопротеиды) — класс сложных белков, простетическая группа которых представлена каким-либо липидом. Так, в составе липопротеинов могут быть свободные жирные кислоты, нейтральные жиры, фосфолипиды, холестериды.
Липопротеины представляют собой комплексы, состоящие из белков (аполипопротеинов; сокращенно — апо-ЛП) и липидов, связь между которыми осуществляется посредством гидрофобных и электростатических взаимодействий.
Виды липопротеидов (ЛП):
ЛПОНП (преβ-ЛП) – ЛП очень низкой плотности
ЛПНП (β-ЛП) – ЛП низкой плотности
ЛПВП (α-ЛП) – ЛП высокой плотности.
Липопротеиды, как и хиломикроны, состоят из гидрофобного ядра и гидрофильной оболочки.
В составе ЛПОНП до 55% ТАГ, в ЛПНП- 50% ХС, в ЛПВП- 50% белков.
Основное место образования липопротеидов – печень, где синтезируются апопротеины.
Различные ЛП отличаются друг от друга:
а) процентным соотношением составных частей;
б) плотностью — плотность их находится в прямой зависимости от содержания белков и в обратной — от концентрации липидов;
в) электрофоретической подвижностью, пре-β-ЛП при электрофорезе предшествуют β-глобулинам, β-ЛП находятся в зоне β-глобулинов, а α-ЛП –в зоне α-глобулинов;
г) размерами — самыми крупными из ЛП являются ЛПОНП (40—50 нм), β-ЛП 20—26 нм, α-ЛП 10—15 нм;
д) функцией.
85.86. Судьба свободных жирных кислот. β-окисление, энергетическая ценность. Судьба глицерина в тканях.
Жирные кислоты входят в состав большей части липидов. Поэтому вопросы обмена липидов – это, как правило, вопросы обмена жирных кислот: их источники и пути дальнейших превращений. Судьба жирной кислоты зависит от ее строения (насыщенная ЖК или полиненасыщенная ЖК) и от внутриклеточных условий (наличие или отсутствие энергии).Состояние покоя и отдыха в абсорбтивный период.В течение нескольких часов после приема пищи (абсорбтивный период) экзогенныенасыщенные и мононенасыщенные жирные кислоты поступают с помощью хиломикронов из кишечника в ткани, которые имеют липопротеинлипазу на эндотелии капилляров.Параллельно в этот период времени в печени жирные кислоты способны синтезироваться из избытка экзогенной глюкозы и полученные эндогенные жирные кислоты этерифицируются с глицеролом в реакциях липогенеза с образованием ТАГ. Далее они транспортируются из печени в ткани, имеющие липопротеинлипазу, в составе ЛПОНП. В клетках жировой ткани после приема пищи насыщенная жирная кислота либо синтезируется из глюкозы, либо поступает из хиломикронов и ЛПОНП. Далее она направляется в липогенез и запасается в составе ТАГ.Если липопротеинлипазы нет в ткани, то жирная кислота доставляется сюда в комплексе с альбумином (как в случае со скелетной мышцей). Этот комплекс образуется после работы липопротеинлипазы в других тканях.Полиненасыщенные жирные кислоты (ПНЖК) обычно поступают в клетки в виде эфиров холестерола и фосфолипидов в составе ЛПВП и ЛПНП. Эти жирные кислоты необходимы для синтеза эйкозаноидов в некоторых видах клеток либо они участвуют в синтезе фосфолипидов для мембран клетки.
87. Химический состав, свойства нормального желудочного сока, значение соляной кислоты в желудочном пищеварении. Физико-химические свойства желудочного сока, виды кислотности. Исследования желудочного сока. Определение дебит часа НСІ.
Желудочный сок — сложный по составу пищеварительный сок, вырабатываемый различными клетками слизистой оболочки желудка. Париетальные клетки фундальных желёз желудка секретируют соляную кислоту — важнейшую составляющую желудочного сока. Основные её функции: поддержание определённого уровня кислотности в желудке, обеспечивающего превращение пепсиногена впепсин, препятствование проникновению в организм болезнетворных бактерий и микробов, способствование набуханию белковых компонентов пищи, её гидролиз, стимулирует выработку секрета поджелудочной железы.Бикарбонаты НСО3− необходимы для нейтрализации соляной кислоты у поверхности слизистой оболочки желудка и двенадцатиперстной кишки в целях защиты слизистой от воздействия кислоты.
Пепсин является основным ферментом, с помощью которого происходит расщепление белков. Существует несколько изоформ пепсина, каждая из которых воздействует на свой класс белков. Пепсины получаются из пепсиногенов, когда последние попадают в среду с определённой кислотностью. За продукцию пепсиногенов в желудке отвечают главные клетки фундальных желёз.
Основные химические компоненты желудочного сока :
вода (995 г/л);хлориды (5—6 г/л);сульфаты (10 мг/л);фосфаты (10—60 мг/л);гидрокарбонаты (0—1,2 г/л) натрия, калия, кальция, магния;аммиак (20—80 мг/л
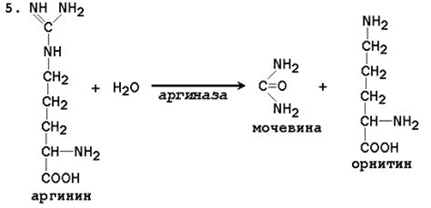
88.Пути обезвреживания аммиака в организме, место и теория образования мочевины, определение мочевины в плазме крови и мочи. Диагностическое значение.
Биосинтез мочевины – основной путь обезвреживания аммиака. Мочевина синтезируется в орнитиновом цикле, протекающем в клетках печени. Эту последовательность реакций открыли Х.Кребс и К.Хензелейт в 1932 г. Согласно современным представлениям, цикл мочевины включает последовательность пяти реакций.Две начальные реакции биосинтеза мочевины происходят в митохондриях клеток печени.

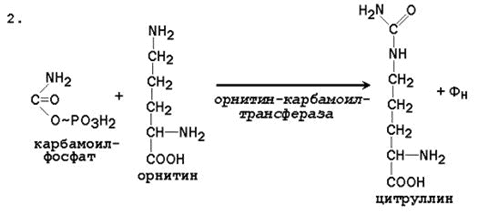
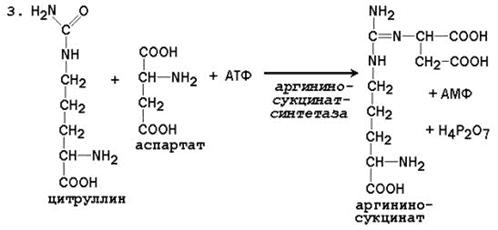
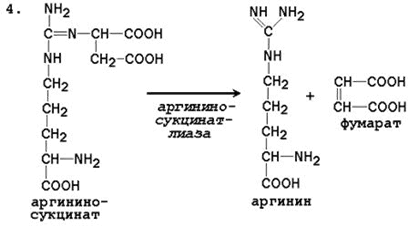
Последующие реакции протекают в цитоплазме клеток печени.
89.Образование химическая природа прямого и непрямого билирубина. Количественное определение билирубина в крови. Диагностическое определение билирубина в сыворотке крови при болезни печени и крови.
Билирубин – желто-красный пигмент, продукт распада гемоглобина и некоторых других компонентов крови. Билирубин находится в составе желчи. Анализ билирубина показывает, как работает печень человека, определение билирубина входит в комплекс диагностических процедур при многих заболеваниях желудочно-кишечного тракта. В сыворотке крови встречается билирубин в следующих формах: прямой билирубин и непрямой билирубин. Вместе эти формы образуют общий билирубин крови, определение которого имеет важное значение в лабораторной диагностике.Нормы общего билирубина: 3,4 - 17,1 мкмоль/л – для взрослых и детей (кроме периода новорожденности) . У новорожденных билирубин высокий всегда - это так называемая физиологическая желтуха. Норма прямого билирубина: 0 - 3,4 мкмоль/л. Анализ билирубина может показать отклонение от нормы билирубина. В большинстве случаев изменение уровня билирубина - признак серьезных заболеваний в организме человека.
Повышенный билирубин – симптом следующих нарушений в деятельности организма: недостаток витамина В 12 ,острые и хронические заболевания печени ,рак печени ,гепатит ,первичный цирроз печени, токсическое, алкогольное, лекарственное отравление печени ,желчнокаменная болезнь. Если прямой билирубин выше нормы, то для врача эти показатели билирубина – повод поставить следующий диагноз: острый вирусный или токсический гепатит ,инфекционное поражение печени, вызванное цитомегаловирусом, вторичный и третичный сифилис ,холецистит ,желтуха у беременных ,гипотиреоз у новорожденных. Повышение билирубина может указать на необходимость дополнительного обследования организма.
92.Изменение физико-химических свойств желудочного сока при патологии.Патологические составные части желудочного сока. Причины появления и качественные реакции на патологические части.
Припатологииизменяютсяфизико- химическиесвойстважелудочногосока.
1.Увеличение объема возможно при повышенной секреции или замедленной эвакуаци и пищи при спазме и стенозе привратника, а уменьшение объема при снижении секреции, ускоренной эвакуации пищи, при неполном закрытии привратника
2. Запах «прогорклогожира» - вызван летучими жирными кислотами и усилением окисления жирных кислот микроорганизмами; гнилостный запах- при гниении белков в желудке под действием ферментов микрофлоры, распадеопухоли, нарушении эвакуации пищи из желудка.
4. Цвет: при патологии желудочныйсок, обычно не имеющий окраски, приобретает жёлтый или зеленоватый цвет за счёт примеси желчи. Желтоватый цвет желудочный сок приобретает в том случае, если в желудочном соке отсутствует соляная кислота. Желтоватый цвет обусловлен наличием билирубина (желчного пигмента), который приотсутствии НСI неможет окислиться в биливердин. Таким образом, зеленоватый цвет обусловлен наличием желчи в присутствии НСI. Красноватый или коричневый цвет наблюдается при наличии крови.Коричневый цвет или цвет «кофейной гущи» наблюдается при наличии крови, если есть в желудочном соке НСI. Кислота, воздействуя на гемоглобин крови, окисляет его в соляно кислый гематин, имеющий коричневую окраску. Красноватый цвет приобретает желудочный сок, если имеется кровь, но нет НСI.
5. Консистенция желудочного сока может также изменяться. Желудочный сок может стать более вязким, тягучим, иногда настолько, что трудно отделить от всей массы какую-то часть для исследования. Увеличение количества слизи свидетельствует о воспалительных изменения в желудке.
93.Гниение белков в кишечнике, химическая природа продуктов гниение, место и пути обезвреживания продуктов гниения.
Известно, что микроорганизмы кишечника для своего роста также нуждаются в доставке с пищей определенных аминокислот. В кишечнике создаются оптимальные условия для образования ядовитых продуктов распада аминокислот: фенола,индола, крезола, скатола, сероводорода, метилмер-каптана, а также нетоксичных для организма соединений:спиртов, аминов, жирных кислот, кетокислот, оксикислот и др. Все эти превращения аминокислот, вызванные деятельностью микроорганизмов кишечника, получили общее название «гниение белков в кишечнике». Из ароматических аминокислот: фенилаланин, тирозин и триптофан – при аналогичном бактериальномдекарбоксилировании образуются амины: фенилэтиламин и индолилэтиламин. Кроме того, микробные ферменты кишечника вызывают постепенное разрушение боковых цепей циклических аминокислот, в частности тирозина и триптофана, с образованием ядовитых продуктов обмена – соответственно крезола и фенола, скатола и индола.После всасывания эти продукты через воротную вену попадают в печень, где подвергаются обезвреживанию путем химического связывания с серной или глюкуроновой кислотой с образованием нетоксичных, так называемых парных,кислот.. Последние выделяются с мочой. Таким образом, организм человека и животных обладает рядом защитных механизмов синтеза, биологическая роль которых заключается в обезвреживании токсичных веществ, поступающих в организм извне или образующихся в кишечнике из пищевых продуктов в результате жизнедеятельности микроорганизмов
94.Метаболизм гемоглобина и билирубина при различных видах желтухи, лабораторная диагностика желтух.
Основной источник билирубина —гемоглобин.Он превращается в билирубин в клетках ретикуло-гистиоцитарной системы, главным образом в печени, селезенке, костном мозге. За сутки распадается примерно 1% эритроцитов и из их гемоглобина образуется 10–300 мг билирубина. Приблизительно 20% билирубина образуется не из гемоглобина зрелых эритроцитов, а из других гемсодержащих веществ, этот билирубин называется шунтовым или ранним. Он образуется из гемоглобина распадающихся в костном мозге эритробластов, незрелых ретикулоцитов, из миоглобина и др. При разрушении эритроцитовгемоглобин расщепляется на глобин, железосодержащий гемосидерин и не содержащий железа гематоидин. Глобин распадается на аминокислоты и снова идет на построение белков организма. Железо подвергается окислению и снова используется организмом в виде ферритина. Гематоидин (порфириновое кольцо) превращается через стадию биливердина в билирубин. Образующийся билирубин поступает в кровь. Так как он не растворим в воде при физиологическом pH крови, то для транспортировки в крови он связывается с носителем — главным образом, альбумином.
72.Протеиногенные амины, представители, образование, химическая природа, физиологическое значение, распад.
Протеиногенные – аминокислоты входящие в состав белков. Классификация аминокислот – Циклические( Ариматические, гетероциклические), ациклические( моноаминокарбоновые, диаминокарбоновые,моноаминодикарбоновые, дикарбоновые). Циклические аминокислоты: фениланин, тирозин, триптофан, гистидин, пролин. Все протеиногенные аминокислоты являются α-аминокислотами. На их примере можно показатьдополнительные способы классификации. Названия аминокислот обычно сокращаются до 3-х буквенного обозначения. Профессионалы в молекулярной биологии также используют однобуквенные символы для каждой аминокислоты.
По строению бокового радикала
Выделяют
алифатические (аланин, валин, лейцин, изолейцин, пролин, глицин),
ароматические (фенилаланин, тирозин, триптофан),
серусодержащие (цистеин, метионин),
содержащие ОН-группу (серин, треонин, опять тирозин),
содержащие дополнительную СООН-группу (аспарагиновая и глутаминовая кислоты),
дополнительную NH2-группу (лизин, аргинин, гистидин, также глутамин, аспарагин).
По полярности бокового радикала
Существуют неполярные аминокислоты (ароматические, алифатические) и полярные(незаряженные, отрицательно и положительно заряженные).
По кислотно-основным свойствам
По кислотно-основным свойствам подразделяют нейтральные (большинство), кислые(аспарагиновая и глутаминовая кислоты) и основные (лизин, аргинин, гистидин) аминокислоты.
По незаменимости
По необходимости для организма выделяют такие, которые не синтезируются в организме и должны поступать с пищей – незаменимые аминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин). К заменимым относят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием сответствующей аминокислоты. Две аминокислоты являются условно незаменимыми (аргинин, гистидин), т.е.их синтез происходит в недостаточном количестве, особенно это касается детей.
92. Острая и хроническая почечная недостаточность. Стадий хронической болезни почек.Обмен нуклеопротеидов.Нарушение нуклепротеидов
Почечная недостаточность — это нарушение выделительной функции почек, в результате которого возникают патологические изменения водно-электролитного баланса и в крови повышается уровень азотистых соединений.
Острая почечная недостаточность (ОПН) развивается вследствие инфекционных заболеваний, травм, кровопотери, диареи, токсического воздействия ядов или некоторых лекарственных препаратов. Основные симптомы ОПН:
1.Сокращение количества выделяемой мочи до 300-500 мл. в сутки;
2.Повышение азотистых продуктов обмена в крови (азотемия);
3.Д иарея;
4.Изменения показателей артериального давления;
5.Тошнота, рвота;
6.Возможен отек легкого с появлением выраженной одышки и влажных хрипов;
7.Сонливость, явная заторможенность;
8.Предрасположенность вследствие снижения иммунитета к развитию инфекционных заболеваний — пневмонии, сепсиса, стоматита, воспаления легких.
Нуклеопротеины – сложные белки, простетическая группа которых представлена нуклеиновыми кислотами. Белки, входящие в состав нуклеопротеинов, имеют небольшую молекулярную массу, содержат много основных аминокислот (лизина, аргинина, гистидина) и соединяются с нуклеиновыми кислотами за счет электростатического взаимодействия. Так, в состав хроматина (дезоксирибонуклеопроетина) входят белки гистоны. Нуклеопротеиды построены из белка и нуклеиновых кислот — дезоксирибонуклеиновой (ДНК) и рибонуклеиновой (РНК).
При нарушении обмена нуклеопротеидов и избыточном образовании мочевой кислоты ее соли могут выпадать в тканях, что наблюдается при подагре, мочекаменной болезни и мочекислом инфаркте. Подагра (от греч. pooos — нога и agra — охота, буквально — «капкан для ног») характеризуется периодическим выпадением в суставах солей мочекислого натрия, что сопровождается болевым приступом. У больных обнаруживается повышенное количество солей мочевой кислоты в крови (гиперурикемия) и моче (гиперурикурия). Соли обычно откладываются в синовии и хрящах мелких суставов ног и рук, голеностопных и коленных суставов, в сухожилиях и суставных сумках, в хряще ушных раковин. Ткани, в которых выпадают соли в виде кристаллов или аморфных масс, некротизируются.
93.Сахарный диабет, виды сахарного диабета, диагностическое значение
Сахарный диабет – это нарушение обмена углеводов и воды в организме. Следствием этого является нарушение функций поджелудочной железы. Именно поджелудочная железа вырабатывает гормон, называемый инсулином. Инсулин участвует в процессе переработки сахара. А без него, организм не может осуществить превращение сахара в глюкозу. Вследствие чего сахар накапливается в нашей крови и выводится в больших количествах из организма через мочу. Существует две разновидности сахарного диабета, которые при определенной схожести имеют существенные отличия.
Сахарный диабет первого типа – состояние, при котором по какой-либо причине гибнут бета-клетки поджелудочной железы. Именно эти клетки вырабатывают инсулин, так что их гибель приводит к абсолютному дефициту этого гормона. Такой диабет чаще обнаруживают в детском или подростковом возрасте.
Сахарный диабет второго типа, как правило, развивается после 30–40 лет у людей, имеющих избыточный вес. При этом поджелудочная железа вырабатывает инсулин, но клетки организма не могут правильно на него реагировать, их чувствительность к инсулину снижена. Из-за этого глюкоза не может проникнуть в ткани и накапливается в крови.
71. Синтез креатина, судьба в организме. Креатинфосфат, химическая природа, значение. Креатинин. Химическая природа, значение. Принцип диагностическое значение определения креатинина в сыворотке крови.
Креатин – вещество скелетных мышц, миокарда, нервной ткани. В виде креатинфосфатакреатин является "депо" макроэргических связей, используется для быстрого ресинтеза АТФ во время работы клетки. Креатинфосфат обеспечивает срочный ресинтез АТФ в первые секунды работы (5‑10 сек), когда никакие другие источники энергии еще не активированы, и кровоснабжение мышцы не увеличено. В клетках нервной ткани креатинфосфат поддерживает жизнеспособность клеток при отсутствии кислорода. Синтез креатина идет последовательно в почках и печени в двух трансферазных реакциях. По окончании синтеза креатин с током крови доставляется в мышцы или мозг. если синтез креатина опережает возможность его фиксации в мышечной ткани, то развиваетсякреатинурия – появление креатина в моче. Физиологическая креатинурия наблюдается в первые годы жизни ребенка. Иногда к физиологической относят и креатинурию стариков, которая возникает как следствие атрофии мышц и неполного использования образующегося в печени креатина. При заболеваниях мышечной системы (при миопатии или прогрессирующей мышечной дистрофии) в моче наблюдаются наибольшие концентрации креатина –патологическая креатинурия.
Креатин — азотсодержащая карбоновая кислота, которая встречается в организме позвоночных. Участвует в энергетическом обмене в мышечных и нервных клетках. Креатин был выделен в 1832 году Шеврёлем из скелетных мышц. Роль в метаболизме. У всех позвоночных и некоторых беспозвоночных креатин образуется из креатинфосфата ферментомкреатинкиназой. Наличие такого энергетического запаса сохраняет уровень АТФ/АДФ на достаточном уровне в тех клетках, где необходимы высокие концентрации АТФ. Высокоэнергетические фосфатные запасы в клетках находятся в форме фосфокреатина или фосфоаргинина. Фосфокреатинкиназная система работает в клетке как внутриклеточная система передачи энергии от тех мест, где энергия запасается в виде АТФ (митохондрия и реакции гликолиза в цитоплазме) к тем местам, где требуется энергия (миофибриллы в случае мышечного сокращения, саркоплазматический ретикулум, для накачивания ионов кальция и во многих других местах). Кофеин не разрушает молекулы креатина. Но отчасти они действуют противоположно друг другу — креатин накапливает жидкость в организме, создавая эффект гипергидратированной клетки, а кофеин действует как мочегонное, и при должной порции препятствует этому эффекту. Креатин выпускается в виде таблеток, порошка или пилюль и может быть жидким, шипучим или жевательным.Основным запасным энергетическим источником, вырабатываемым организмом человека, является креатин-фосфат. При сокращении мышечных волокон, вещество распадается на креатинин и фосфат, в результате чего происходит высвобождение определенного количества энергии. Впоследствии креатинин попадает в кровь и удаляется из организма почками. Основным запасным энергетическим источником, вырабатываемым организмом человека, является креатин-фосфат. При сокращении мышечных волокон, вещество распадается на креатинин и фосфат, в результате чего происходит высвобождение определенного количества энергии. Впоследствии креатинин попадает в кровь и удаляется из организма почками. Такой процесс у здорового человека происходит постоянно, а, значит, содержание вещества в крови остается стабильным. Особенно опасным может быть повышение креатинина, так как этот фактор может указывать на развитие определенной патологии. Нормативный показатель креатинина в плазме крови у женщин и мужчин разная. Также его значение отличается у детей в разном возрасте. Для определения количества вещества проводится специальный анализ крови.
78. Ретинол, понятие о строении, физиологическое (действие) значение, авитаминоз, суточная потребность, распространение в природе.
Ретинол жирорастворимый витамин, антиоксидант. В чистом виде нестабилен, встречается как в растительных продуктах, так и в животных источниках. Поэтому производится и используется в виде ретинола ацетата и ретинола пальмитата. В организме синтезируется из бета-каротина. Необходим для зрения и роста костей, здоровья кожи и волос, нормальной работы иммунной системы и т. д. В высоких дозах оказывает тератогенное действие (способен вызывать врожденные дефекты развития плода).
Ретинол является жирорастворимым, поэтому для его усваивания пищевым трактом требуются жиры, а также минеральные вещества. В организме его запасы остаются достаточно долго, чтобы не пополнять их каждый день. Существует две формы этого витамина: это готовый витамин А (ретинол) и провитамин А (каротин), который в организме человека превращается в витамин A, поэтому его можно считать растительной формой витамина A.При недостатке витамина А на коже образуются трещины, секутся волосы и слоятся ногти. Витамин A имеет бледно-желтый цвет, который образуется из красного растительного пигмента бета-каротина.
ричина
Помимо пищевой недостаточности, причиной гиповитаминоза А может быть
а) нехватка витаминов Е и С, защищающих ретинол от окисления,
б) гипотиреоз (снижение функции щитовидной железы),
в)железодефициты, т.к. в кишечнике и печени превращение каротиноидов в витамин А катализируют железо‑содержащие ферменты (например, β-каротин-диоксигеназа), активируемые тиреоидными гормонами.
Клиническая картина
1. Стерильность– желтое тело беременности накапливает каротиноиды β-каротин и лютеин. Вероятно, они несут антиоксидантную нагрузку, обеспечивая жизнеспособность и нормальное функционирование желтого тела.
2. При сильном гиповитаминозе и авитаминозе происходит нарушение темновой адаптации –куриная слепота;
3. Задержка роста, похудание, истощение;
4. Специфические поражения глаз, слизистых оболочек, кожи:
· кожа– гиперкератоз (пролиферация и патологическое ороговение кожи, сухость и шелушение – т.н. "жабья кожа") приводит к вторичным гнойным процессам,
· глаза– ороговение эпителия слезного канала (ксерофтальмия) приводит к его закупорке. Это порождает, во-первых, сухость роговой оболочки глаза, т.к. нет слезы, во-вторых, влечет за собой воспаление роговой оболочки из-за отсутствия лизоцима (антибактериального фермента слезы). Оба фактора приводят к кератомаляции – отек, изъязвление, размягчение роговой оболочки,
· слизистые оболочки – из-за снижения синтеза гликопротеинов и нарушения барьерной функции слизистых оболочек происходит поражение эпителия желудочно-кишечного тракта, дыхательных путей и мочеполовой системы (также нарушение сперматогенеза).
Гипервитаминоз
Причина
Избыточный прием витамина А с витаминными препаратами и, реже, с пищей.
Клиническая картина
Острое отравление сопровождается головной болью, тошнотой, слабостью, ступором, отеком соска зрительного нерва (вследствие ликворной гипертензии), может повышаться температура.
При хроническом отравлении нарушается пищеварение, исчезает аппетит, наступает потеря веса тела, снижается активность сальных желез кожи и развивается сухой дерматит, ломкость костей.
У витамина А в высоких дозах имеется нефротоксичность, канцерогенность и эмбриотоксичность.
Роль печени в обмене веществ
Печень в организме человека выполняет целый ряд разнообразных и жизненно важных функций. Печень участвует практически во всех видах обмена: белковом, липидном, углеводном, водно-минеральном, пигментном.
Участие печени в белковом обменехарактеризуется тем, что в ней активно протекают синтез и распад белков, имеющих важное значение для организма. В печени синтезируется за сутки около 13-18 г белков. Из них альбумины, фибриноген, протромбин образуются только и печени. Кроме того, здесь синтезируется до 90% альфа-глобулинов и около 50% гамма-глобулинов организма. В связи с этим при заболеваниях печени в ней либо снижается синтез белков и это приводит к уменьшению количества белков крови, либо происходит образование белков с измененными физико-химическими свойствами, в результате чего понижается коллоидная устойчивость белков крови и онилегче, чем в норме, выпадают в осадок при действии осадителей (солей щелочных и щелочноземельных металлов, тимола, сулемы и др.). Обнаружить изменение количества или свойств белков можно с помощью проб на коллоидоустойчивость или осадочных проб, среди которых часто используются пробы Вельтмана, тимоловая и сулемовая.
Печень является основным местом синтеза белков, обеспечивающих процесс свертывания крови (фибриногена, протромбина и др.). Нарушение их синтеза, как и недостаточность витамина К, развивающаяся вследствие нарушения желчеотделения и желчевыделения, приводят к геморрагическим явлениям.
Активно протекающие в печени процессы превращений аминокислот (переаминирование, дезаминирование и др.) при ее тяжелых поражениях существенно изменяются, что характеризуется увеличением концентрации свободных аминокислот в крови и выделением их с мочой (гипераминоацидурии). В моче также могут быть обнаружены кристаллы лейцина и тирозина.
Образование мочевины происходит только в печени и нарушение функций гепатоцитов приводит к увеличению ее количества в крови, что оказывает отрицательное влияние на весь организм и может проявиться, например, печеночной комой, нередко заканчивающейся гибелью больного.
Обменные процессы, протекающие в печени, катализируются различными ферментами, которые при ее заболеваниях выходят в кровь и поступают в мочу. Важно, что выход ферментов из клеток происходит не только при их повреждении, но и при нарушении проницаемости клеточных мембран, имеющем место в самом начальном периоде заболевания, поэтому изменение ферментных спектров является одним из важнейших диагностических показателей оценки состояния больного еще в доклинический период. Например, при болезни Боткина уже в дожелтушный период отмечено увеличение в крови активности АлТА, ЛДГ и АсТА, а при рахите — увеличение уровня щелочной фосфатазы.
Печень выполняет важнейшую для организма антитоксическую функцию. Именно в ней происходит обезвреживание таких вредных веществ, как индол, скатол, фенол, кадаверин, билирубин, аммиак, продукты обмена стероидных гормонов и др. Пути обезвреживания токсических веществ различны: аммиак превращается в мочевину; индол, фенол, билирубин и другие образуют безвредные для организма соединения с серной или глюкуроновой кислотами, которые выводятся с мочой.
Роль печени в углеводном обменеопределяется прежде всего ее участием в процессах синтеза и распада гликогена. Это имеет большое значение для регуляции уровня глюкозы в крови. Кроме того, в печени активно протекают процессы взаимопревращения моносахаридов. Галактоза и фруктоза превращается в глюкозу, а глюкоза может стать источником для синтеза фруктозы.
В печени протекает также процесс глюконеогенеза, при котором из неуглеводных веществ — молочной кислоты, глицерина и гликогенных аминокислот — происходит образование глюкозы. Печень участвует и в регуляции углеводного обмена путем контроля за уровнем инсулина в крови, так как в печени содержится фермент инсулиназа, расщепляющая инсулин в зависимости от потребности организма.
Энергетические потребности самой печени обеспечиваются за счет распада глюкозы, во-первых, по анаэробному пути с образованием лактата и, во-вторых, по пептозному пути. Значение указанных процессов заключается не только и образовании НАДФН2 для различных биосинтезов, но и возможности использовать продукты распада углеводов в качестве исходных веществ для различных обменных процессов.
В обмене липидов паренхиматозные клетки печени играют ведущую роль. Непосредственно в гепатоцитах протекают процессы биосинтеза холестерина, желчных кислот, образование фосфолипидов плазмы, кетоновых тел и липопротеидов. С другой стороны, печень контролирует обмен липидов всего организма. Хотя триацилглицерины составляют только 1% от общей массы печени, но именно ею регулируются процессы синтеза и транспорта жирных кислот организма. В печень, поступает большое количество липидов, которые «сортируются» в зависимости от потребностей органов и тканей. При этом в одних случаях может усиливаться их распад, до конечных продуктов, а в других желчные кислоты могут идти на синтез фосфолипидов и кровью доставляться к тем клеткам, где они необходимы для образования мембран, или же липопротеидами транспортироваться к клеткам, которые испытывают недостаток в энергии, и т. д.
Немаловажное значение имеет печень и в водно-минеральном обмене. Так, она является депо крови, а, следовательно, и внеклеточной жидкости, в ней может накапливаться до 20% всего объема крови. Кроме того, для некоторых минеральных веществ печень служит местом накопления и запасания. К ним относятся натрий, магний, марганец, медь, железо и др. В печени идет синтез белков, транспортирующих минеральные вещества по крови: трансферрина, церулоплазмина и др. Наконец, печень — это место инактивации гормонов, обеспечивающих регуляцию водно-минерального обмена (альдостерона, вазопрессина).Гепатит – это воспаление печени. По происхождению гепатиты подразделяются на вирусные (гепатит А, В, С, гепатит при желтой лихорадке, при СПИДе) и невирусные.Гепатоз– острое или хроническое заболевание печени невоспалительного характера. В основе его лежат патологические изменения функциональных клеток печени – гепатоцитов.
Дата добавления: 2018-02-15; просмотров: 2462; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
