Свойства сопряжённых алкадиенов
Наибольшее практическое значение среди сопряжённых диенов имеют:
дивинил или бутадиен-1,3 CH2=CH–CH=CH2 (легко сжижающийся газ, Tкип –4,5 °C),
изопрен или 2-метилбутадиен-1,3 CH 2 =C(CH 3 )–CH=CH 2 (жидкость, T кип 34 °С).
По химическим свойствам диеновые углеводороды подобны алкенам – дают те же качественные реакции (обесцвечивают растворы брома или перманганата калия), легко окисляются и вступают в реакции присоединения по электрофильному и радикальному механизмам. Однако сопряжённые диены отличаются от алкенов и других диенов характерными особенностями, которые обусловлены делокализацией (рассредоточением) р-электронов
Молекула бутадиена-1,3 СН 2 =СН–СН=СН 2 содержит четыре атома углерода в sp2-гибридизованном состоянии и имеет плоское строение (все атомы углерода и водорода лежат в одной плоскости).

р-Электроны двойных связей образуют единое р-электронное облако (сопряжённую систему) и делокализованы между всеми атомами углерода.

Порядок связей (число общих электронных пар) между атомами углерода имеет промежуточное значение между 1 и 2, то есть нет чисто одинарной и чисто двойных связей. Строение бутадиена более точно отражает формула с делокализованными связями.

Аналогично построены молекулы изопрена CH 2 =C(CH 3 )-CH=CH 2:

Образование единого π-электронного облака, охватывающего 4 атома углерода,  приводит к возможности присоединения реагента по концам этой системы, то есть к атомам С(1) и С(4). Поэтому дивинил и изопрен наряду с присоединением реагента по одной из концевых двойных связей (1,2- или 3,4-) вступают в реакции 1,4-присоединения. Соотношение продуктов 1,2- (3,4-) и 1,4-присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения). В избытке реагента присоединение происходит по обеим кратным связям.
приводит к возможности присоединения реагента по концам этой системы, то есть к атомам С(1) и С(4). Поэтому дивинил и изопрен наряду с присоединением реагента по одной из концевых двойных связей (1,2- или 3,4-) вступают в реакции 1,4-присоединения. Соотношение продуктов 1,2- (3,4-) и 1,4-присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения). В избытке реагента присоединение происходит по обеим кратным связям.
|
|
|
Делокализованные р-связи отличаются от локализованных (изолированных) р-связей более высокой поляризуемостью. Это расширяет реакционную способность сопряженных диенов: кроме реакций радикального и электрофильного присоединения, свойственных алкенам, возможно также нуклеофильное присоединение
Реакции присоединения к сопряжённым диенам
Гидрирование (присоединение водорода)
При взаимодействии бутадиена-1,3 с водородом в момент выделения (например, в реакции натрия со спиртом) получается бутен-2, то есть происходит 1,4-присоединение. Формально этот процесс можно представить следующим образом: при действии реагента двойные связи разрываются, к крайним атомам углерода С(1) и С(4) присоединяются атомы водорода (H•), а свободные валентности (неспаренные электроны) образуют π-связь между атомами С(2) и С(3):
|
|
|
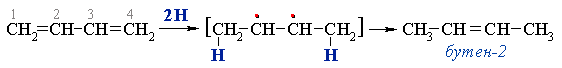
В присутствии катализатора Ni образуется продукт полного гидрирования:
 (н-бутан)
(н-бутан)
Изопрен реагирует аналогично:
CH2=С(CH3)–CH=CH2 + 2H  (CH3)2C=CH–CH3 (2-метилбутен-2)
(CH3)2C=CH–CH3 (2-метилбутен-2)
CH2=С(CH3)–CH=CH2 + 2H2 (Ni, t)  (CH3)2CH–CH2–CH3 (2-метилбутан)
(CH3)2CH–CH2–CH3 (2-метилбутан)
Галогенирование (присоединение галогенов)
Хлор и бром легко присоединяются к алкадиенам по электрофильному механизму подобно алкенам. При взаимодействии эквимолярных количеств бутадиена-1,3 и брома образуются продукты как 1,2-, так и 1,4-присоединения:

В избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана:
CH2Br–CHBr–CHBr–CH2Br
В случае изопрена, кроме реакций 1,2- и 1,4-присоединения, возможно также 3,4-присоединение:
CH2=С(CH3)–CH=CH2 + Br2  CH2=С(CH3)–CHBr–CH2Br
CH2=С(CH3)–CHBr–CH2Br
При облучении УФ-светом или в присутствие соединений – источников свободных радикалов (например, пероксидов ROOR) галогены присоединяются к сопряжённым диенам по радикальному механизму с образованием 1,2- (3,4-), 1,4-дигалогеналкенов и 1,2,3,4-тетрагалогеналканов.
Гидрогалогенирование (присоединение галогеноводородов)
Присоединение HCl и HBr к сопряженным диенам происходит также в 1,2- (3,4-) и 1,4-положения и подчиняется тем же закономерностям: с повышением температуры увеличивается доля продукта 1,4-присоединения.
|
|
|

Дата добавления: 2021-06-02; просмотров: 110; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
