Получение альдегидов и применение альдегидов.
Тема 3.3. ««Кислородсодержащие органические соединения»
3.3.2. Карбонильные соединения. Альдегиды. Кетоны. Карбоновые кислоты. Сложные эфиры.
План.
- Карбонильные соединения: классификация, номенклатура, изомерия.
- Строение карбонильной группы, физические свойства и физиологическое действие альдегидов.
- Химические свойства альдегидов и кетонов.
- Получение, применение альдегидов.
5. Классификация карбоновых кислот. Гомологический ряд предельных одноосновных кислот: номенклатура, изомерия.
6. Строение карбоксильной группы, физические свойства
7. Химические свойства уксусной кислоты.
8. Получение, применение уксусной кислоты.
9. Строение и номенклатура сложных эфиров.
10. Свойства сложных эфиров, применение.

1. К карбонильным соединениям относятся соединения, содержащие карбонильную группу (карбонил, окси-группу).


 Эти соединения, в зависимости от связанных с ней заместителей, делятся на две основные группы: альдегиды и кетоны. Альдегиды содержат карбонильную группу, которая связана с первичным атомом углерода, т.е. находится в начале углеродной цепи. Кетоны содержат карбонильную группу, которая связана со вторичным атомом углерода, т.е. находится в середине углеродной цепи. Карбоновые кислоты кроме карбонильной группы имеют еще и гидроксогруппу, причем обе функциональные группы связаны с одним (первичным) атомом углерода. Кислоты тоже относят иногда к карбонильным соединениям.
Эти соединения, в зависимости от связанных с ней заместителей, делятся на две основные группы: альдегиды и кетоны. Альдегиды содержат карбонильную группу, которая связана с первичным атомом углерода, т.е. находится в начале углеродной цепи. Кетоны содержат карбонильную группу, которая связана со вторичным атомом углерода, т.е. находится в середине углеродной цепи. Карбоновые кислоты кроме карбонильной группы имеют еще и гидроксогруппу, причем обе функциональные группы связаны с одним (первичным) атомом углерода. Кислоты тоже относят иногда к карбонильным соединениям.
|
|
|
Рассмотрим сначала альдегиды и кетоны. В зависимости от природы углеродного радикала различают алифатические и ароматические карбонильные соединения, а также предельные и непредельные.





Функциональная группа у альдегидов находится на конце углеродной цепи, у первичного атома углерода. У альдегидов она является главной функциональной группой и счет атомов идет от нее. Карбонильная группа в названии альдегида обозначается добавлением суффикса –аль. Цифра в названии не указывается, ведь это всегда первый атом углерода. Т.е. изомерии положения функциональной группы для альдегидов нет. Возможна только изомерия углеродного скелета и межклассовая изомерия с кетонами. У кетонов оксо-группа указывается добавлением суффикса –он. Кроме того, надо указать, где находится эта группа. Эта цифра должна быть как можно  меньше.
меньше.

 Например:
Например:
 Метаналь (формальдегид, муравьиный альдегид) Этаналь (ацетальдегид, уксусный альдегид)
Метаналь (формальдегид, муравьиный альдегид) Этаналь (ацетальдегид, уксусный альдегид)
 2-метилгексанон-3.
2-метилгексанон-3.
Пропаналь (пропионовый альдегид)
Пропанон

 Бутаналь (масляный альдегид)
Бутаналь (масляный альдегид)
Метилпропаналь
Физические свойства.
|
|
|
Карбонильные соединения не образуют водородных связей, поэтому температуры кипения у них ниже, чем у соответствующих спиртов. Метаналь – газ ( кипит при -210С), все другие низшие альдегиды – жидкости, высшие – твердые вещества. Низшие альдегиды летучи и имеют характерный запах. Они растворимы в воде. Водный 40% раствор метаналя называют формалином. Этаналь летучая жидкость (температура кипения 210С), с неприятным удушливым запахом (в малых концентрациях он пахнет яблоками). Простейшим кетоном является ацетон(диметилкетон, пропанон): бесцветная жидкость с характерным запахом, хорошо растворим в воде, сам хороший растворитель.
Физиологическое действие. Формальдегид ядовит, вызывает денатурацию белков, легко окисляется в организме и превращается в сильную муравьиную кислоту. Это исходное вещество для получения ряда лекарственных препаратов (например, уротропина). Уротропин можно использовать также в качестве сухого горючего. Ацетальдегид тоже ядовит. Он является продуктом неполного окисления этанола в организме человека и именно с ним связаны тяжелые последствия алкогольного отравления. Ацетон – один из продуктов метаболизма жирных кислот в организме человека. Его повышенная концентрация в крови и моче характерна при отравлении, тяжелых случаях диабета, при токсикозах и голодании. Повышение концентрации ацетона нарушает работу нервной системы.
|
|
|
Особенности строения карбонильной группы.  Атом углерода карбонильной группы находится в состоянии sp2 гибридизации и образует три
Атом углерода карбонильной группы находится в состоянии sp2 гибридизации и образует три  -связи, лежащие в одной плоскости под углом 1200 и одну
-связи, лежащие в одной плоскости под углом 1200 и одну  -связь с атомом кислорода, за счет негибридной р-орбитали. Причем связи между атомами углерода и кислорода сильно поляризованы. В результате на атоме углерода образуется частичный положительный заряд, и он становиться удобным объектом для атаки нуклеофила. Эта атака для альдегидов приводит к реакции присоединения (АN). В зависимости от природы радикала, связанного с карбонильной группой, величина заряда на атоме углерода может быть разной, т.е. альдегиды вступают в реакцию присоединения с разной активностью.
-связь с атомом кислорода, за счет негибридной р-орбитали. Причем связи между атомами углерода и кислорода сильно поляризованы. В результате на атоме углерода образуется частичный положительный заряд, и он становиться удобным объектом для атаки нуклеофила. Эта атака для альдегидов приводит к реакции присоединения (АN). В зависимости от природы радикала, связанного с карбонильной группой, величина заряда на атоме углерода может быть разной, т.е. альдегиды вступают в реакцию присоединения с разной активностью.
Химические свойства.
1) Альдегиды - один из наиболее легко окисляющихся классов органических соединений. При этом обычно образуются соответствующие карбоновые кислоты. А окисление в жестких условиях или очень сильным окислителем приведет к образованию углекислого газа.
|
|
|
Полное окисление:

+ О2 → СО2 + Н2О
Реакция «серебряного зеркала» (р. Толленса) – с аммиачным раствором нитрата серебра (обычно вместо формулы комплексного соединения серебра в уравнении пишут формулу оксида серебра). Образуется соответствующая карбоновая кислота и свободное серебро, которое выделяется в виде черного осадка или блестящей (зеркальной) пленки на поверхности сосуда.


+ Ag2O → + Ag↓
Реакция «медного зеркала» (р. Фелинга) – реакция окисления альдегидов комплексным соединением меди (II) (обычно вместо формулы комплексного соединения меди в уравнении пишут формулу гидроксида меди (II). Образуется соответствующая карбоновая кислота и оксид меди (I) оранжевого цвета. Эти реакции окисления (с оксидом серебра и с гидроксидом меди) используют как качественные на альдегиды.


+ Cu(OH)2↓ → + CuOH↓
Cu(OH)↓ → Cu2O↓ + H2O
Можно использовать как качественную реакцию на альдегиды и реакцию с фуксинсернистой кислотой. В этом случае мы наблюдаем изменение окраски раствора в характерный розовый цвет.
Для написания реакций окисления очень удобно пользоваться «дорогой ОВР», по которой в основном и протекают эти реакции. В процессе реакции обычно окисляется только углерод функциональной группы, а углеродная цепь не подвергается изменениям. Из первичных спиртов легко образуются альдегиды, а они легко окисляются до карбоновых кислот. Но при образовании карбоновых кислот из кетонов (т.е. на третьей стадии окисления) цепь начинает разрываться, потому что углерод карбоксильной группы должен быть первичным. Поэтому кетоны в целом менее активны, чем альдегиды. Окисление кетонов проходит аналогично окислению альдегидов, но в более жестких условиях и сопровождается разрывом углеродной цепи и образованием нескольких карбоновых кислот. Окончательное разрушение углеродного скелета происходит только на последней стадии, при образовании углекислого газа.
Углеводород (0) ↔ спирт (1) ↔ альдегид (2) ↔ карбоновая кислота (3) ↔ СО2 (4)
2) Для карбонильной группы характерны реакции нуклеофильного присоединения с разрывом двойной связи. Такие реакции присоединения протекают для альдегидов с разными веществами.

Например, к реакциям присоединения (АN) относится реакция гидрирования (т.е. присоединения водорода). Эту реакцию можно рассматривать как реакцию восстановления альдегидов и кетонов. Из кетонов образуются вторичные спирты, а из альдегидов – первичные.

+ H2 → CH3-CH2-OH
Можно сделать вывод: карбонильные соединения легко окисляются и восстанавливаются.
спирт ↔ альдегид ↔ карбоновая кислота
Очень важной является реакция присоединения спиртов к альдегидам. При этом образуются полуацетали, а потом полуацетали при взаимодействии со спиртами превращаются в ацетали (но это уже реакция нуклеофильного замещения). Такие реакции протекают в живых организмах с углеводами.

Ш. Для карбонильной группы возможны и реакции полимеризации с разрывом двойной связи. Их можно рассматривать как результат нуклеофильной атаки кислородным атомом одной молекулы карбонильного атома другой молекулы. Например, молекулы уксусного альдегида вступают в реакцию друг с другом, при этом углеродная цепочка становится длиннее (альдольная поликонденсация). Особенно характерна такая реакция для формальдегида. Например, при хранении формалина (40% раствор формальдегида) образуется белый осадок – параформ.

Кроме того, при длительном хранении формальдегид, даже в водных растворах, способен к реакции диспропорционирования (реакция Канниццаро).
2СН2О + Н2О → СН3ОН + НСООН, и раствор приобретает кислую реакцию.
Очень важной для современной промышленности является реакция поликонденсации формальдегида с фенолом. При этом образуется фенолформальдегидная смола.
Получение альдегидов и применение альдегидов.
Альдегиды получают:
1). окисление спиртов (одноатомных первичных);
2). гидратация ацетилена (реакция Кучерова, соли ртути в роли катализатора);
3). каталитическое окисление этилена (соли меди в роли катализатора);
4). каталитическое окисление метана (получение формальдегида) и т.д.
Метаналь используют:
- в медицине для получения лекарств (например: уротропин), для хранения биопрепаратов и дезинфекции помещений (формалин денатурирует белок);
- в сельском хозяйстве для протравливания семян;
- получения параформа, фенолформальдегидных смол (полимеров) и пластмасс.
Этаналь используют:
- для производства уксусной кислоты;
- производства лекарств (хлорал – трихлорацетальдегид, его гидрат применяется в качестве снотворного), полимеров и искусственных волокон (ацетатный шелк, целлофан, целлулоид…)
 5. Карбоновые кислоты – это карбонильные соединения, в которых карбонил (группа =С=О) и гидроксогруппа (группа –ОН) находятся у одного атома углерода.
5. Карбоновые кислоты – это карбонильные соединения, в которых карбонил (группа =С=О) и гидроксогруппа (группа –ОН) находятся у одного атома углерода.
СООН
Такую функциональную группу, характерную для карбоновых кислот называют карбоксильной. В зависимости от числа карбоксильных групп различают одноосновные и многоосновные кислоты. По характеру радикала кислоты делят на предельные, непредельные и ароматические кислоты. Кислоты самый многочисленный класс органических соединений, в их составе могут быть самые разные функциональные группы. В природе кислоты могут встречаться в свободном состоянии, но чаще встречаются в виде сложных эфиров и других производных.
Гомологический ряд предельных одноосновных кислот. Атом углерода, который входит в карбоксильную группу является первичным, т.е. эта функциональная группа может находиться только на конце углеродной цепи. Точнее в начале, потому что эта функциональная группа является самой главной, она всегда обозначается в названии суффиксом «-овая кислота». Кроме систематических названий для первых представителей ряда широко используют тривиальные названия. Для предельных одноосновных кислот нет изомерии положения функциональной группы, есть только изомерия углеродного скелета и межклассовая изомерия со сложными эфирами.
Например:
Метановая (муравьиная) кислота; Этановая (уксусная кислота; Пропановая (пропионовая) кислота;
Бутановая (масляная) кислота …




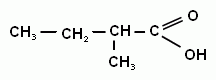


Попробуйте составить формулы щавелевой кислоты (этандиовая) и янтарной (бутандиовая) кислот. К какому гомологическому ряду кислот они относятся?
 6. Особенности строения карбоксильной группы. Взаимное влияние карбонильной и гидроксогруппы приводит к изменению их свойств. Влияние гидроксогруппы на карбонильную группу проявляется в том, что в результате смещения избытка электронной плотности кислорода к карбонильному атому углерода уменьшается положительный заряд на нем. Значит, реакции нуклеофильного присоединения по двойной связи, которые характерны для карбонильных соединений, для карбоновых кислот становятся нехарактерны. Влияние карбонильной группы на гидроксогруппу проявляется в том, что благодаря положительному заряду карбонильного атома углерода происходит смещение электронной плотности от группы ОН. Это способствует увеличению полярности связи между водородом и кислородом и уменьшает полярность связи углерода с кислородом. Т.е. облегчается разрыв связи О-Н карбоксильной группы. А значит появляются кислотные свойства, которые связаны с возможностью отщепления протона. Остается возможен и разрыв связи между углеродом и гидроксогруппой. Но эта реакция проходит хуже, чем у спиртов.
6. Особенности строения карбоксильной группы. Взаимное влияние карбонильной и гидроксогруппы приводит к изменению их свойств. Влияние гидроксогруппы на карбонильную группу проявляется в том, что в результате смещения избытка электронной плотности кислорода к карбонильному атому углерода уменьшается положительный заряд на нем. Значит, реакции нуклеофильного присоединения по двойной связи, которые характерны для карбонильных соединений, для карбоновых кислот становятся нехарактерны. Влияние карбонильной группы на гидроксогруппу проявляется в том, что благодаря положительному заряду карбонильного атома углерода происходит смещение электронной плотности от группы ОН. Это способствует увеличению полярности связи между водородом и кислородом и уменьшает полярность связи углерода с кислородом. Т.е. облегчается разрыв связи О-Н карбоксильной группы. А значит появляются кислотные свойства, которые связаны с возможностью отщепления протона. Остается возможен и разрыв связи между углеродом и гидроксогруппой. Но эта реакция проходит хуже, чем у спиртов.
Физический свойства предельных одноосновных кислот. Между молекулами кислоты, благодаря группам ОН, образуются многочисленные водородные связи. Поэтому газов среди кислот нет, у них аномально высокие температуры кипения. У муравьиной кислоты около 100  , а для уксусной – 118 Температура кристаллизации уксусной кислоты 16,6
, а для уксусной – 118 Температура кристаллизации уксусной кислоты 16,6  , поэтому абсолютную уксусную кислоту называют ледяной. Низшие представители предельных одноосновных кислот являются подвижными жидкостями, неограниченно растворимы в воде, имеют характерный запах. Начиная с бутановой кислоты, это маслянистые жидкости, ограничено растворимые, с неприятным запахом. Высшие кислоты (больше 9 углеродов в цепи) – твердые вещества, практически нерастворимые, запаха не имеют.
, поэтому абсолютную уксусную кислоту называют ледяной. Низшие представители предельных одноосновных кислот являются подвижными жидкостями, неограниченно растворимы в воде, имеют характерный запах. Начиная с бутановой кислоты, это маслянистые жидкости, ограничено растворимые, с неприятным запахом. Высшие кислоты (больше 9 углеродов в цепи) – твердые вещества, практически нерастворимые, запаха не имеют.
Химические свойства.
5). Реакции окисления. В атмосфере кислорода, или под действием другого окислителя, карбоновые кислоты окисляются до углекислого газа и воды. Легче всего окисляется муравьиная кислота. (Почему?)
CH3COOH + О2 → СО2+ H2O
Карбоновые кислоты под действием восстановителей ([H] условно) в присутствии катализаторов способны превращаться в альдегиды, спирты и даже углеводороды. Но эти реакции для них не характерны. Лучше других восстанавливается муравьиная кислота.
CH3COOH + Н2 → CH3CH=O + Н2O
 2). Диссоциация кислот. Мы рассмотрели с вами строение карбоксильной группы и видели, что карбоновые кислоты могут отщеплять протон. Величина кислотности карбоновых кислот зависит от природы радикала. Обычный алифатический радикал является донором электронной плотности и уменьшает заряд на карбонильном углероде. Поэтому предельные карбоновые кислоты – слабые, наиболее сильная из них – муравьиная (
2). Диссоциация кислот. Мы рассмотрели с вами строение карбоксильной группы и видели, что карбоновые кислоты могут отщеплять протон. Величина кислотности карбоновых кислот зависит от природы радикала. Обычный алифатический радикал является донором электронной плотности и уменьшает заряд на карбонильном углероде. Поэтому предельные карбоновые кислоты – слабые, наиболее сильная из них – муравьиная (  как фосфорная). Чем больше углеродный радикал, тем слабее кислота. Если в радикале появляются электроотрицательные заместители (например, хлор, гидроксогруппа) или бензольное кольцо, то степень диссоциации кислоты увеличивается. В растворах карбоновых кислот кислая среда, поэтому индикаторы изменяют в них свою окраску.
как фосфорная). Чем больше углеродный радикал, тем слабее кислота. Если в радикале появляются электроотрицательные заместители (например, хлор, гидроксогруппа) или бензольное кольцо, то степень диссоциации кислоты увеличивается. В растворах карбоновых кислот кислая среда, поэтому индикаторы изменяют в них свою окраску.
3). Для растворов карбоновых кислот будут возможны все реакции характерные для кислот. При взаимодействии кислот с некоторыми металлами (до Н), оксидами металлов, щелочами и солями более слабых кислот проходят реакции замещения водорода на металл. Эти реакции можно назвать реакциями электрофильного замещения водорода.
CH3COOH + NaOH  CH3COONa + H2O
CH3COONa + H2O
CH3COOH + Mg  (CH3COO)2Mg + H2
(CH3COO)2Mg + H2
CH3COOH + NaНСO3  CH3COONa + СО2 + H2O
CH3COONa + СО2 + H2O
CH3COOH + Fe3O3 → (CH3COO)3Fe + H2O
При этом образуются соли карбоновых кислот. Остатки кислот в этом случае называются ацилаты (например: ацетат-соль уксусной кислоты, формиат-соль муравьиной кислоты и т.д.).
4). Для карбоновых кислот характерны так же реакции нуклеофильного замещения.Связанный с атомом углерода карбонильной группы заместитель (группа ОН) способен замещаться на другой нуклеофил. Способность к реакции нуклеофильного замещения возрастает с увеличением положительного заряда на карбонильном атоме углерода. По сравнению с альдегидами кислоты труднее подвергаются нуклеофильной атаке и нуждаются в катализаторах- кислотах.
Наиболее важные из реакций нуклеофильного замещения – реакции этерификации. Так называют реакции образования сложных эфиров из кислот и спиртов. В отсутствии катализатора реакция протекает очень медленно. В кислой среде реакция заметно ускоряется. Эта реакция обратимая. Обратная реакция относится к реакциям гидролиза. Для увеличения практического выхода и сдвига равновесия в нужную сторону из реакционной смеси надо удалять один из продуктов реакции, например, связывать воду концентрированной серной кислотой.
CH3- CO-OH + C 2 H 5 O-H  CH3-CO-OC2H5 + H2O
CH3-CO-OC2H5 + H2O
5). У карбоновых кислот есть свойства, обусловленные наличием и характером углеродного радикала. Например, предельные карбоновые кислоты могут вступать в реакцию свободно-радикального замещения, образуя галогензамещенные кислоты (ультрафиолетовое излучение).
CH3COOH + Cl2 → CCl3COOH + HCl
Если радикал непредельный, то для него возможны реакции присоединения по двойной связи. Например, реакция гидрирования, обесцвечивание бромной воды.
СН2=СН-СООН + Н2 → СН3- СН2 -СООН
Непредельные кислоты способны и к реакциям полимеризации (олифа). А ароматические кислоты (например, бензойная) могут вступать в реакции, характерные для бензольного кольца.
Обратите внимание! Реакции присоединения по двойной связи, которые характерны для карбонильной группы, для кислот не характерны. Здесь проявляется влияние гидроксогруппы на величину положительного заряда карбонильного атома углерода. Неподеленные электронные пары кислорода из гидроксогруппы смещаются к карбонильному углероду и уменьшают заряд на нем. Поэтому атака нуклеофила на карбонильный углерод становится проблематичной.
Получение кислот.
1) окисление альдегидов;
2) окисление спиртов (без выделения альдегидов как промежуточного продукта);
3) окисление алканов (каталитическое, без выделения промежуточных соединений);
4) гидролиз жиров.
Применение кислот.
Муравьиная (метановая) кислота – едкая жидкость, неограниченно растворимая в воде, вызывает сильные ожоги кожи, имеет резкий запах. Спиртовые растворы (1,25%) применяют в медицине как раздражающее средство для растирания, под названием муравьиный спирт. Используется как растворитель. И как восстановитель (у нее есть альдегидная группа).
Уксусная (этановая) кислота – жидкость, при температуре ниже 16,6оС превращается в бесцветные кристаллы, имеет резкий характерный запах. Хорошо растворима в воде. 6-9% раствор называют уксусом (столовым уксусом), 40-80% раствор – уксусной эссенцией. Уксусную кислоту используют как растворитель. Уксусную кислоту применяют для получения многих лекарственных препаратов, красителей, пестицидов, полимеров, искусственного волокна.
Существует понятие «жирные кислоты», т.е. кислоты, входящие в состав жиров. К таким кислотам относятся высшие карбоновые кислоты с неразветвленной углеродной цепью и четным числом атомов углерода. Наиболее важные из предельных жирных кислот: пальмитиновая (гексадекановая С16) и стеариновая (октадекановая С18) кислоты. Это твердые, легкоплавкие, жирные на ощупь вещества. Входят в состав животных жиров, а пальмитиновая входит также в состав спермацета и пчелиного воска. Ее используют как основу для мазей. Из непредельных кислот наиболее распространенная олеиновая кислота (С17Н33СООН), которая входит в состав почти всех природных жиров. Олеиновая кислота – маслянистая жидкость без вкуса и запаха,  =0,7г/см3. Двойная связь находится в середине цепи. Линолевая (С17Н31СООН) и линоленовая (С17Н29СООН) имеют соответственно две и три двойные связи, это тоже маслянистые жидкости без вкуса и запаха. Обе кислоты содержаться в виде сложных эфиров в некоторых растительных маслах.
=0,7г/см3. Двойная связь находится в середине цепи. Линолевая (С17Н31СООН) и линоленовая (С17Н29СООН) имеют соответственно две и три двойные связи, это тоже маслянистые жидкости без вкуса и запаха. Обе кислоты содержаться в виде сложных эфиров в некоторых растительных маслах.
9. Сложные эфиры (эстеры) – производные спиртов и карбоновых кислот. Общая формула:
 В формуле можно выделить: остаток карбоновой кислоты, радикал карбоновой кислоты, радикал спирта, остаток спирта, сложноэфирную группировку (группу).
В формуле можно выделить: остаток карбоновой кислоты, радикал карбоновой кислоты, радикал спирта, остаток спирта, сложноэфирную группировку (группу).
Номенклатура.
1) Систематическая: Корнем названия сложных эфиров является название алкана, соответствующего кислоте, к которому добавляют суффикс «-оат». Название спиртового радикала обозначается в префиксе.


а) этилпропаноат б) метилбутаноат
2) Традиционная: а) этиловый эфир пропионовой кислоты или даже пропионовоэтиловый эфир или этилпальмиат;
б) метиловый эфир масляной кислоты и т.д.
Изомерия возможна трех видов: углеродного скелета, положения сложноэфирной группы и межклассовую изомерию с карбоновыми кислотами.
10. Особенности строения и свойств сложных эфиров. Наличие полярной карбонильной связи облегчает реакции нуклеофильного замещения. Остаток спирта в молекуле сложного эфира можно заместить на какой-нибудь другой нуклеофил (гидроксогруппу, аминогруппу, галоген и т.д.). Отсутствие полярной связи О-Н ведет к отсутствию водородных связей.
Физические свойства сложных эфиров. Эфиры с небольшой молекулярной массой – это летучие подвижные жидкости с низкой температурой кипения и характерным запахом. А эфиры высших кислот и спиртов - это твердые, без запаха и цвета, жирные на ощупь вещества. Эти твердые вещества называют восками. В воде эфиры нерастворимы, но растворяются в органических растворителях.
Химические свойства. Характерны реакции нуклеофильного замещения, важнейшая из них – гидролиз. Эта реакция является обратной для реакции этерификации и в кислой среде обратима. Поэтому реакцию можно записать по-разному.
CH3- CO-OH + C2H5O-H  CH3-CO-OC2H5 + Н-HO реакция этерификации
CH3-CO-OC2H5 + Н-HO реакция этерификации
CH3-CO-OC2H5 + Н-HO  CH3- CO-OH + C2H5O-H реакция гидролиза
CH3- CO-OH + C2H5O-H реакция гидролиза
В присутствии щелочей гидролиз становится необратимым процессом, т.к. кислота вступает в реакцию нейтрализации со щелочами, в реакционном пространстве концентрация кислоты уменьшается и (по правилу Ле Шателье) равновесие смешается в сторону образования этой кислоты. Соли высших карбоновых кислот, образующиеся при таком гидролизе жиров, называют мылами, поэтому гидролиз сложных эфиров в щелочной среде принято называть омылением.
Нахождение в природе. Карбоновые кислоты содержатся в растениях и животных, обычно в виде производных – сложных эфиров, ангидридов и т.д. Входят в состав эфирных масел, жира, фосфолипидов, восков, спермацета, витаминов, красителей.
Получение.
- в промышленности: реакция этерификации;
- экстракция природных сложных эфиров.
Применение.
- растворители;
- ароматизаторы;
- изготовление полимеров (оргстекло) и синтетических волокон (лавсан);
- производство СМС (воска в шампунях), лекарств (валерьянка).
Дата добавления: 2021-06-02; просмотров: 95; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
