Графическое строение атома углерода.
Государственное автономное профессиональное образовательное учреждение Тюменской области
«ТЮМЕНСКИЙ КОЛЛЕДЖ ПРОИЗВОДСТВЕННЫХИСОЦИАЛЬНЫХ ТЕХНОЛОГИЙ»

Предельные углеводороды
Химия
(сборник адаптированных конспектов)
Тюмень
2020
Сборник адаптированных конспектов по учебной дисциплины «Химия» разработан в соответствии с « Рекомендациями по организации получения основного общего образования в пределах освоения образовательных программ СПО на базе основного общего образования с учетом требований Федеральных государственных образовательных стандартов и получаемой профессии или специальности среднего профессионального образования » и Примерной программой, рекомендованной ФГАУ «ФИРО» 21 июля 2015 г, по специальности 35.02.04- Технология комплексной переработки древесины, 15.02.14. – Оснащение средствами автоматизации технологических процессов и производств ( по отраслям), 13.02.11 – Техническая эксплуатация и обслуживание электрического и электромеханического оборудования ( по отраслям), 23.02.04. – Техническая эксплуатация подъемно-транспортных, строительных, дорожных машин и оборудования (по отраслям ), 08.01.24 – «Мастер столярно-плотничных, паркетных и стекольных работ», 35.02.12 – Садово-парковое и ландшафтное строительство. 08.02.05.Строительство и эксплуатация автомобильных дорог и аэродромов. 08.02.09. – Монтаж, накладка и эксплуатация электрооборудования промышленных и гражданских зданий. 35.02.01. – Лесное и лесопарковое хозяйство», 25.02.08.Эксплуатация беспилотных авиационных систем.
|
|
|
Организация–разработчик: государственное автономное профессиональное образовательное учреждение Тюменской области «Тюменский колледж производственных и социальных технологий».
Разработчик:
Солодовникова Н. С., преподаватель
Рассмотрена ПЦК «Технология деревообработки».
Протокол №____________ от «____»__________20___г.
Председатель ПЦК
_________________Быкова Е.Л.
Содержание
ТЕМА 1 Строение атома углерода
ТЕМА 2 Теория химического строения органических соединений А.М.Бутлерова
ТЕМА 3 Строения молекулы
ТЕМА 4 Химические свойства метана
ТЕМА 5 Номенклатура алканов
ТЕМА 6 Алгоритм решения задач
|
|
|

Тема 1:
Строения атома углерода

Рисунок 1.1
Атом углерода
Электронное строение атома углерода.


Рисунок 1.1 Рисунок 1.2
Электронное строение атома углерода
Общее число электронов в атоме углерода равняется шести, на что указывает порядковый номер элемента. Электроны в атоме располагаются по энергетическим уровням, их число определяется номером периода, в атоме углерода их два: на первом уровне находится два электрона, на втором уровне их четыре , на что указывает номер группы(Рис.1.1, 1.2). Кроме уровней имеются подуровни: первому уровню соответствует 1 S - подуровень, максимум электронов на котором равно 2, второму уровню соответствует два подуровню S и P . Максимум электронов на P - подуровне равно шести.
В атоме углерода два электрона располагаются на первом уровне S подуровня, еще два электрона располагается на втором уровне S подуровня и два P – электрона находится на втором уровне.
Электронная формула углерода: C-1s 22s 22p2
Графическое строение атома углерода.
|
|
|
Электроны в атоме располагаются по ячейкам, в одной ячейке может находиться не более двух электронов. Следовательно, S -подуровню соответствует одна ячейка, P -подуровню соответствует три ячейки. В атоме углерода валентные электроны, то есть электроны, находящиеся на внешнем энергетическом уровне, располагаются следующим образом: два электрона занимают S ячейку, а два P –электрона занимают отдельные ячейки. На P -подуровне одна ячейка остается свободной, в нее переходит один из S – электронов.
Вывод: Все четыре валентных электрона становятся неспаренными – они определяют валентность углерода в соединениях.
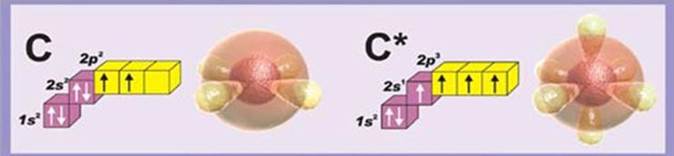
Рисунок 1.5
Дата добавления: 2021-05-18; просмотров: 113; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
