Правила построения электронной оболочки
ЕГЭ, химия Задание 1. Строение атома
- Атом - электронейтральная, химически не делимая частица вещества.
Атом состоит из ядра и электронной оболочки.
В ядре атома расположены нуклоны: протоны (имеют заряд +1 и массу 1) и нейтроны (имеют массу 1 и не имеют заряда).
Электронная оболочка - это все электроны, расположенные вокруг ядра атома. Электроны имеют заряд -1 и очень маленькую массу (масса 1 протона равна массе 2000 электронов), поэтому ею пренебрегают при подсчете общей массы атома.

2. Ядро атома заряжено положительно. Численно заряд ядра равен числу протонов в нем.
Электронная оболочка атома заряжена отрицательно. Суммарный заряд электронной оболочки численно равен общему числу электронов.
Так как атом электронейтрален, то в нем число электронов равно числу протонов и определяется по порядковому номеру элемента в ПС.
Число нейтронов рассчитывают, отняв от атомной массы порядковый номер.
p+ = е- = Z
n = Ar – Z
Например:

- В атоме электроны расположены на энергетических уровнях (уровень-расстояние от ядра). Число уровней в атоме равно номеру периода.
Энергетический уровень, который заполняется последним, называют внешним электронным слоем (или внешним энергетическим уровнем).
Электронный слой = энергетический уровень = номер периода.
- На каждом уровне может располагаться определенное число электронов. Максимум электронов для каждого уровня определяют по формуле: N=2n2, где N – главное квантовое число, а n- номер уровня.
|
|
|
| Уровень | Подуровень | Расчет электронов | 2n2 |
| 1 | S | 2 | 2 |
| 2 | S P | 2 6 | 8 |
| 3 | S P d | 2 6 10 | 18 |
| 4 | S p d f | 2 6 10 14 | 32 |
- Число электронов внешнего слоя для элементов главных подгрупп (А-подгрупп) равно номеру группы.
- В атоме может изменяться число электронов, но при этом атом становится ионом: катионом, если он отдает электроны (заряд +) и анионом, если он принимает электроны (заряд -).
7. Число электронов ионов отличается от числа электронов атомов. Чтобы атом стал анионом, ему необходимо принять электроны. Так, например, в атоме кислорода электронов 8, а в анионе кислорода О2- их будет (8+2) = 10. Чтобы атом стал катионом, он должен отдать электроны. Например, в атоме кальция Ca 20 электронов, а в катионе кальция Ca2+ 18.
8. В атоме никогда не меняется число протонов!
-
 В атомах одного и того же элемента может находиться разное число нейтронов (они отвечают только за массу). Такие атомы называются изотопами.
В атомах одного и того же элемента может находиться разное число нейтронов (они отвечают только за массу). Такие атомы называются изотопами.
Изотопы - атомы химических элементов, имеющие различное число нейтронов, а следовательно, разную массу.
|
|
|
Изотопы водорода: протий (только один протон); дейтерий (1 протон, 1 нейтрон); тритий (1 протон, 2 нейтрона).
Итог
| Номер периода | Число электронных слоев в атоме |
| Номер группы | Число электронов на внешнем электронном слое |
| Порядковый номер элемента | Общее число электронов, общее число протонов, заряд ядра атома |
| Атомная масса – порядковый номер = | Общее число нейтронов |
Правила построения электронной оболочки
1. Принцип наименьшей энергии: суммарная энергия всех электронов атома, находящегося в основном состоянии, минимальна.
Основное состояние атома (невозбужденное) – устойчивое состояние атома с наименьшей энергией.
 В невозбужденном состоянии орбитали атома заполняются в порядке увеличения энергии. Каждый электрон располагается так, чтобы его энергия была минимальной, т. е. среди свободных орбиталей он выбирает орбиталь с самой низкой энергией. Чем ближе орбиталь к ядру, тем ниже у нее энергия. Следовательно, электронная оболочка атома начинает заполняться от ядра к периферии. Порядок заполнения энергетических подуровней можно запомнить в виде ряда: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s….
В невозбужденном состоянии орбитали атома заполняются в порядке увеличения энергии. Каждый электрон располагается так, чтобы его энергия была минимальной, т. е. среди свободных орбиталей он выбирает орбиталь с самой низкой энергией. Чем ближе орбиталь к ядру, тем ниже у нее энергия. Следовательно, электронная оболочка атома начинает заполняться от ядра к периферии. Порядок заполнения энергетических подуровней можно запомнить в виде ряда: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s….
|
|
|

Можно воспользоваться аналогией из макромира: электроны, заполняя орбитали, ведут себя подобно воде, заполняющей стакан. Вода всегда заполняет стакан снизу вверх и никогда – наоборот.
2. Принцип Паули: в атоме не может быть даже двух электронов со всеми четырьмя одинаковыми квантовыми числами.
Если бы электроны "руководствовались" только принципом наименьшей энергии, то в конкретном атоме они все оказались бы на 1s-орбитали. Но этого не происходит, потому что существует принцип Паули, утверждающий, что в атоме нет двух электронов, обладающих одинаковыми характеристиками.
Вспомним, что атомная орбиталь характеризуется тремя квантовыми числами (n, l, m), а спиновое квантовое число (s) может принимать только два значения, следовательно, на одной АО может быть не более двух электронов.

 Электронное облако может быть образовано только одним или двумя электронами. Если на орбитали находится только один электрон, то его называют неспаренным. Если на орбитали находится два электрона, то они обладают противоположными спинами и их называют спаренными. Орбиталь без электронов называют свободной орбиталью.
Электронное облако может быть образовано только одним или двумя электронами. Если на орбитали находится только один электрон, то его называют неспаренным. Если на орбитали находится два электрона, то они обладают противоположными спинами и их называют спаренными. Орбиталь без электронов называют свободной орбиталью.
|
|
|
Используя принципы наименьшей энергии и Паули изобразим строение электронной оболочки атома бора.
3. Правило Хунда (Гунда): в пределах подуровня электроны распределяются по орбиталям таким образом, чтобы модуль суммы их спиновых квантовых чисел был максимальным.
Вспомним, что электрон – заряженная частица, и, следовательно, электроны друг от друга отталкиваются; а раз так, то им выгоднее находиться на разных орбиталях одного подуровня, так как электронные облака этих орбиталей в пространстве не совпадают.
 Рассмотрим строение электронной оболочки атома углерода. У шестого электрона "возникает проблема": где ему выгоднее разместиться на 2р-подуровне – на свободной АО, или на АО с неспаренным электроном. Если шестой электрон сможет попасть на ту же орбиталь, что и предыдущий, то сумма спиновых квантовых чисел этих электронов по принципу Паули обязательно будет равна 1/2 + (–1/2) = 0 (электроны должны быть с разными спинами). А если этот электрон займет другую 2р-АО, то сумма спиновых квантовых чисел окажется равной 1/2 + 1/2 = 1, то есть больше, чем в первом случае. Модуль суммы окажется больше, чем в первом случае, и тогда, когда спиновые квантовые числа обоих электронов будут отрицательными. Следовательно шестой электрон согласно правилу Хунда займет свободную АО 2р-подуровня.
Рассмотрим строение электронной оболочки атома углерода. У шестого электрона "возникает проблема": где ему выгоднее разместиться на 2р-подуровне – на свободной АО, или на АО с неспаренным электроном. Если шестой электрон сможет попасть на ту же орбиталь, что и предыдущий, то сумма спиновых квантовых чисел этих электронов по принципу Паули обязательно будет равна 1/2 + (–1/2) = 0 (электроны должны быть с разными спинами). А если этот электрон займет другую 2р-АО, то сумма спиновых квантовых чисел окажется равной 1/2 + 1/2 = 1, то есть больше, чем в первом случае. Модуль суммы окажется больше, чем в первом случае, и тогда, когда спиновые квантовые числа обоих электронов будут отрицательными. Следовательно шестой электрон согласно правилу Хунда займет свободную АО 2р-подуровня.
 Обобщим. Заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным.
Обобщим. Заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным.
ЗАПИСЬ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ АТОМА
Подробные электронные конфигурации атомов изображают двумя способами: графически, с помощью квадратиков со стрелками (часто называют энергетическими диаграммами); в строчку, когда перечисляются все занятые энергетические подуровни с указанием общего числа электронов на каждом из них.

Последовательность заполнения орбиталей и максимальное число электронов на каждом подуровне:
ПРОСКОК» ИЛИ «ПРОВАЛ» ЭЛЕКТРОНА
У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома.
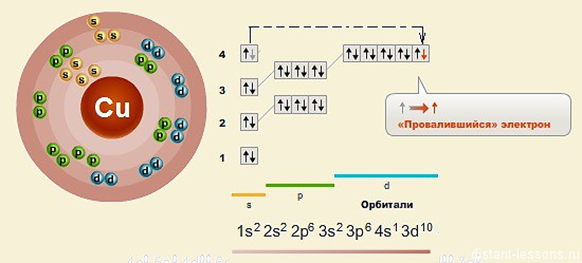

ВОЗБУЖДЕННОЕ СОСТОЯНИЕ АТОМА Все электронные конфигурации, о которых мы говорили выше, являются конфигурациями с наименьшей энергией и соответствуют основному состоянию атома. Получив энергию извне (облучение или нагревание системы), один либо несколько электронов могут переходить на более высокий энергетический подуровень. Состояние атома, при котором электрон из электронной пары с предыдущего подуровня «распаривается» и переходит на следующий подуровень, называется возбужденным состоянием атома. ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ Валентность атома определяется числом неспаренных электронов. При наличии свободных орбиталей электроны атома могут распариваться, перескакивать на на другой подуровень, т.е. атом переходит в возбужденное состояние, поэтому валентность может быть постоянной и переменной. При этом число неспаренных электронов, а, следовательно, число связей, образуемых атомом, увеличивается. Высшая валентность всегда равна номеру группы. Для определения низшей переменной валентности (количества свободных электронов) , которой чаще всего обладают неметаллы, необходимо из 8 вычесть номер группы. Валентность зависит: 1. От количества электронов на внешнем уровне 2. От количества свободных неспаренных электронов 3. От наличия свободных орбиталей Электронные формулы ионов Ионы – заряженные частицы, они получаются из атомов путем отдачи электронов (тогда образуются катионы) или принятия электронов (образуются анионы). Примеры: S2- (16+2=18е) P3+ (15-3=12е) Na+ (11-1=10е) Электронная формула иона получается путем добавления или вычитания электронов из электронной формулы атома ( до инертной оболочки – 8е).
Дата добавления: 2021-04-05; просмотров: 55; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
