Химические свойства Марганца.
Развивающая:
- привитие навыков самообразования, самореализации личности.
Воспитательная:
- формирование интереса к предмету, ответственности к своим действиям.
В результате изучения темы обучающийся должен знать:
· общая характеристика элементов VII группы, побочной подгруппы периодической системы Д. И. Менделеева;
· характеристика марганца, исходя из его положения в периодической системе, с точки зрения теории строения атома, степени окисления;
· получение и свойства марганца;
· соединения марганца. Оксиды, гидроксиды. Марганцовая кислота;
· калия перманганат, его окислительные свойства в кислой, нейтральной и щелочной средах.
Межпредметные связи: ОГСЭ. 02. История, ОП. 08. Органическая химия.
Оснащение занятия: периодические таблицы Д.И. Менделеева, таблица растворимости.
ПЛАН И СОДЕРЖАНИЕ ЗАНЯТИЯ
(структура занятия)
Организационная часть (проверка присутствующих, готовность обучающихся к занятию, наличие формы, проверка домашнего задания и т д.)
Формулировка темы и ее мотивация
- начальная мотивация ученой деятельности (название темы, её цель, значение, связь с современностью, перспективы развития вопроса;
- актуализация опорных знаний (Фронтальный опрос).
1) Какие степени окисления может проявлять хром и почему?
2) Химические свойства хрома?
3) Применение соединении хрома в медицине?
Основная часть (изложение нового материала)
|
|
|
План:
1. Общая характеристика элементов VII группы, побочной подгруппы периодической системы Д. И. Менделеева.
2. Характеристика марганца, исходя из его положения в периодической системе, с точки зрения теории строения атома, степени окисления.
3. Получение и свойства марганца.
4. Соединения марганца. Оксиды, гидроксиды. Марганцовая кислота.
5. Калия перманганат, его окислительные свойства в кислой, нейтральной и щелочной средах.
Подгру́ппа ма́рганца — химические элементы 7-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы побочной подгруппы VII группы)[1]. В группу входят переходные металлы марганец Mn, технеций Tc и рений Re.[2] На основании электронной конфигурации атома к этой же группе относится и элемент борий Bh, искусственно синтезированный в 1976 г. группой Юрия Оганесяна из Объединённого института ядерных исследований в Дубне[3].
Как и в других группах, члены этого семейства элементов проявляют закономерности электронной конфигурации, особенно внешних оболочек, в результате проявляется сходство физических свойств и химического поведения:
Некоторые свойства элементов 7 группы
|
|
|
| Атомный номер | Химический элемент | Электронная оболочка | Атомный радиус, нм | p, г/см³ | t пл , °C | t кип , °C | ЭО |
| 25 | марганец, Mn | 2, 8, 13, 2 | 0,131 | 7,45 | 1244 | 1962 | 1,6 |
| 43 | технеций, Tc | 2, 8, 18, 13, 2 | 0,136 | 11,5 | 2172 | 4876 | 1,36 |
| 75 | рений, Re | 2, 8, 18, 32, 13, 2 | 0,137 | 20,53 | 3180 | 5600 | 1,46 |
| 107 | борий, Bh | 2, 8, 18, 32, 32, 13, 2 |
Элементы группы 7 имеют по 7 валентных электронов. Все они являются серебристо-белыми тугоплавкими металлами. В ряду Mn — Tc — Re химическая активность понижается. Электропроводность рения приблизительно в 4 раза меньше, чем вольфрама. Металл этот представляет собой прекрасный материал для изготовления нитей электроламп, более прочных и долговечных, чем обычные вольфрамовые. На воздухе компактный металлический марганец покрывается тончайшей плёнкой окисла, которая предохраняет его от дальнейшего окисления даже при нагревании. Напротив, в мелко раздроблённом состоянии он окисляется довольно легко.[4]
Распространение в природе]
Два из четырёх членов группы — технеций и борий, являются радиоактивными с достаточно коротким периодом полураспада, ввиду чего в природе они не встречаются.
Марганец принадлежит к распространённым элементам, составляя 0,03 % от общего числа атомов земной коры. Небольшие количества марганца содержат многие горные породы. Вместе с тем, встречаются и скопления его кислородных соединений, главным образом в виде минерала пиролюзита MnO2. Ежегодная мировая добыча марганцовых руд составляет около 5 млн т.
|
|
|
Чистый марганец можно получить электролизом растворов его солей. Около 90 % всей добычи марганца потребляется при изготовлении различных сплавов на основе железа. Поэтому из руд обычно выплавляют прямо его высокопроцентный сплав с железом — ферромарганец (60-90 % Мn), которым затем и пользуются для введения марганца в другие сплавы. Выплавку ферромарганца из смеси марганцовых и железных руд ведут в электрических печах, причём марганец восстанавливается углеродом по реакции:
{\displaystyle \mathrm {MnO_{2}+2\ C\longrightarrow 2\ CO+\ Mn} } 
Технеций в земной коре не содержится. Очень малые его количества были получены искусственно, причём было установлено, что по химическим свойствам он гораздо ближе к рению, чем к марганцу. Однако детальное изучение элемента и его соединений пока не осуществлено.
Содержание рения в земной коре весьма мало (9⋅10−9 %). Элемент этот является чрезвычайно распылённым: даже наиболее богатые рением минералы (молибдениты) содержат его в количествах, обычно не превышающих 0,002 % по весу. Сколько-нибудь широкого использования рений и его производные пока не находят. Тем не менее, в 2007 г. мировое производство рения составило около 45 тонн. Он также является химически активным элементом.
|
|
|
Физические свойства Марганца. Плотность Марганца 7,2-7,4 г/см3; tпл1245 °С; tкип 2150 °С. Марганец имеет 4 полиморфные модификации: б-Мn (кубическая объемноцентрированная решетка с 58 атомами в элементарной ячейке), в-Мn (кубическая объемноцентрированная с 20 атомами в ячейке), г-Мn (тетрагональная с 4 атомами в ячейке) и д-Mn (кубическая объемноцентрированная). Температура превращений: б=в 705 °С; в=г 1090 °С и г=д 1133 °С; б-модификация хрупка; г (и отчасти в) пластична, что имеет важное значение при создании сплавов.
Атомный радиус Марганца 1,30 Е. ионные радиусы (в Е): Mn2+ 0,91, Mn4+ 0,52; Mn7+ 0,46. Прочие физические свойства б-Mn: удельная теплоемкость (при 25°С) 0,478 кДж/(кг·К) [т. е. 0.114 ккал/(г·°С)]; температурный коэффициент линейного расширения (при 20°С) 22,3·10-6град-1; теплопроводность (при 25 °С) 66,57 Вт/(м·К) [т. е. 0,159 кал/(см·сек·°С)]; удельное объемное электрическое сопротивление 1,5-2,6 мком·м (т. е. 150-260 мком·см): температурный коэффициент электрического сопротивления (2-3)·10-4 град-1. Марганец парамагнитен.
Химические свойства Марганца.
Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны).
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:{\displaystyle {\ce {Mn + O2 -> MnO2}}} 2Mn+O2→2MnO
Марганец при нагревании разлагает воду, вытесняя водород:
{\displaystyle {\ce {Mn{}+2H2O->[^{\circ }t]Mn(OH)2{}+H2\uparrow }}} 
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
С соляной и серной кислотами реагирует по уравнению
{\displaystyle {\ce {Mn{}+2H^{+}->Mn^{2}+{}+H2\uparrow }}} 
С концентрированной серной кислотой реакция идёт по уравнению
{\displaystyle {\ce {Mn{}+2H2SO4->MnSO4{}+SO2\uparrow +2H2O}}} 
С разбавленной азотной кислотой реакция идёт по уравнению
{\displaystyle {\ce {3Mn{}+8HNO3->3Mn(NO3)2{}+2NO\uparrow +4H2O}}} 
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
Mn2O7 в обычных условиях — жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4).
При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
{\displaystyle {\ce {2 MnO2{}+ 4 KOH{}+ O2 -> 2 K2MnO4{}+ 2 H2O}}} 
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция
{\displaystyle {\ce {3 K2MnO4{}+ 3 H2SO4 -> 3 K2SO4{}+ 2 HMnO4{}+ MnO(OH)2 v + H2O}}} 
Раствор окрашивается в малиновый цвет из-за появления аниона MnO4−, и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия)
{\displaystyle {\ce {2KMnO4->[^{\circ }t]K2MnO4{}+MnO2{}+O2}}} 
Под действием сильных окислителей ион Mn2+ переходит в ион MnO4−:
{\displaystyle {\ce {2 MnSO4{}+ 5 PbO2{}+ 6 HNO3 -> 2 HMnO4{}+ 2 PbSO4{}+ 3 Pb(NO3)2{}+ 2 H2O}}} 
Эта реакция используется для качественного определения Mn2+ (см. в разделе «Определение методами химического анализа»).
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления. Подробное описание реакции см. в разделе «Определение методами химического анализа». В нейтральных или кислых водных растворах ион Mn2+ образует окрашенный в бледно-розовый цвет аквакомплекс [Mn(H2O)6]2+.
Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основный характер, MnO(OH)2 — амфотерный. Хлорид марганца (IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:
{\displaystyle {\ce {MnO2{}+4HCl->MnCl2{}+Cl2\uparrow +2H2O}}} 
Нулевая степень окисления у марганца проявляется в соединениях с σ-донорными и π-акцепторными лигандами. Так, для марганца и известен карбонил состава Mn2(CO)10.
Известны и другие соединения марганца с σ-донорными и π-акцепторными лигандами (PF3, NO, N2, P(C5H5)3).
Химически Марганец достаточно активен, при нагревании энергично взаимодействует с неметаллами - кислородом (образуется смесь оксидов Марганца разной валентности), азотом, серой, углеродом, фосфором и другими. При комнатной температуре Марганец на воздухе не изменяется: очень медленно реагирует с водой. В кислотах (соляной, разбавленной серной) легко растворяется, образуя соли двухвалентного Марганца. При нагревании в вакууме Марганец легко испаряется даже из сплавов.
Марганец образует сплавы со многими химическими элементами; большинство металлов растворяется в отдельных его модификациях и стабилизирует их. Так, Cu, Fe, Co, Ni и другие стабилизируют г-модификацию. Al, Ag и другие расширяют области в- и у-Mn в двойных сплавах. Это имеет важное значение для получения сплавов на основе Марганца, поддающихся пластической деформации (ковке, прокатке, штамповке).
В соединениях Марганец обычно проявляет валентность от 2 до 7 (наиболее устойчивы степени окисления +2, +4 и +7). С увеличением степени окисления возрастают окислительные и кислотные свойства соединений Марганца.
Получение Марганца. Наиболее чистый Марганец получают в промышленности по способу советского электрохимика Р. И. Агладзе (1939) электролизом водных растворов с добавкой (NH4)2SO4 при рН = 8,0-8,5. Процесс ведут с анодами из свинца и катодами из титанового сплава АТ-3 или нержавеющей стали. Чешуйки Марганца снимают с катодов и, если необходимо, переплавляют. Галогенным процессом, например, хлорированием руды Мn, и восстановлением галогенидов получают Марганец с суммой примесей около 0,1%. Менее чистый Марганец получают алюминотермией по реакции:
3Mn3O4 + 8Al = 9Mn + 4Al2O3
а также электротермией.
Применение Марганца. Основной потребитель Марганец - черная металлургия, расходующая в среднем около 8-9 кг Марганца на 1 т выплавляемой стали. Для введения Марганца в сталь применяют чаще всего его сплавы с железом - ферромарганец (70 - 80% Марганец, 0,5 - 7,0% углерода, остальное железо и примеси). Выплавляют его в доменных и электрических печах. Высокоуглеродистый ферромарганец служит для раскисления и десульфурации стали; средне- и малоуглеродистый - для легирования стали. Малолегированная конструкционная и рельсовая сталь содержит 0,9 - 1,6% Mn; высоколегированная, очень износоустойчивая сталь с 15% Mn и 1,25% С (изобретена английским металлургом Р. Гейрилдом в 1883 году) была одной из первых легированных сталей. В СССР производится безникелевая нержавеющая сталь, содержащая 14% Сr и 15% Mn.
Марганец используется также в сплавах на нежелезной основе. Сплавы меди с Марганцем применяют для изготовления турбинных лопаток; марганцовые бронзы - при производстве пропеллеров и других деталей, где необходимо сочетание прочности и коррозионной устойчивости. Почти все промышленные алюминиевые сплавы и магниевые сплавы содержат Марганец. Разработаны деформируемые сплавы на основе Марганца, легированные медью, никелем и других элементами. Гальваническое покрытие Марганца применяется для защиты металлических изделий от коррозии.
Соединения Марганца применяют и при изготовлении гальванических элементов; в производстве стекла и в керамической промышленности; в красильной и полиграфической промышленности, в сельском хозяйстве и т. д.
Оксид марганца (IV) МnO2. Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата МnO2 nН2O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и Н2SO4, азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя.
Применяется для промышленного производства марганца, как деполяризатор в «батарейках» (сухих гальванических элементах), компонент минеральных пигментов, осветлитель стекла.
Соединения Mn(+2)- восстановители. Оксид MnO - порошок серо-зеленого цвета; обладает основными свойствами. нерастворим в воде и щелочах, хорошо растворим в кислотах. Гидрооксид Mn(OH)3 - белое вещество, нерастворимое в воде. Соединения Mn(+4) могут выступать и как окислители (а) и как восстановители (б):
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (а)
(по этой редакции в лабораториях получают хлор)
MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O (б)
(реакция идет при сплавлении).
Оксид Марганца (II) MnO2 - черно-бурого цвета, соответствующий гидрооксид Мп(ОН)4 - темно-бурого цвета. Оба соединения в воде нерастворимы, оба амфотсрны с небольшим преобладанием кислотной функции. Соли типа K2MnO4 называются манганитами.
Из соединений Mn(+6) наиболее характерны марганцовистая кислота и ее соли манганаты. Весьма важны соединения Mn(+7) - марганцовая кислота, марганцовый ангидрид и перманганаты. Уравнения важнейших реакций:
4МnO2 = 2Мn2O3 + O2 (530-585 °С)
2МnO2 + 2Н2SO4(конц.) = МnSO4 + O2↑ + 2Н2O (кипячение)
МnO2 + 4НС1(конц.) = МnС12 + С12↑ + 2Н2O
МnO2 + Н2SO4 (гор.) + КNO2 = МnSO4 + КNO3 + Н2O
МnO2 + 2Н2SO4 + 2FeSO4 = МnSO4 + Fе2(SO4)3 + 2Н2O
МnO2 + 2КОН + КNO3 = К2MnO4 + KNO2 + Н2O (350-450 °С)
ЗМnO2 + ЗК2CO3 + КС1O3 = ЗК2MnO4+ КС1 + ЗCO2 (400 °С)
В природе самое распространенное соединение марганца — минерал пиролюзит
Манганат калия К2MnO4. Оксосоль. Темно-зеленый, плавится под избыточным давлением О2. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону МnO42-. Медленно разлагается при разбавлении раствора водой, быстро — при подкислении. Проявляет окислительно-восстановительные свойства.
Качественная реакция — появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO4.
Уравнения важнейших реакций:
3K2MnO4(конц) +2H2O→(t) 2KMnO4+MnO2↓+4KOH
3K2MnO4(разб)+4HCl=2KMnO4+MnO2↓+2H2O+4KCl
K2 MnO4 +8HCl(конц)=MnCl2+2Cl2↑+4H2O+2KCl
3K2MnO4+2H2O+4CO2(г)=2KMnO4+MnO2↓+4KHCO3
2K2 MnO4+Cl2(насыщ)=2KMnO4+2KCl
2K2MnO4+2H2O→ H2↑+2KMnO4+KOH (эликтролиз) Получение: сплавление МnO2 с сильными окислителями (KNO3, КClO3).
Перманганат калия КМnO4. Оксосоль. Красно-фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде (интенсивно-фиолетовая окраска раствора отвечает иону МnO4), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до МnII , в нейтральной среде – до Mn IV в сильнощелочной среде — до МnVI
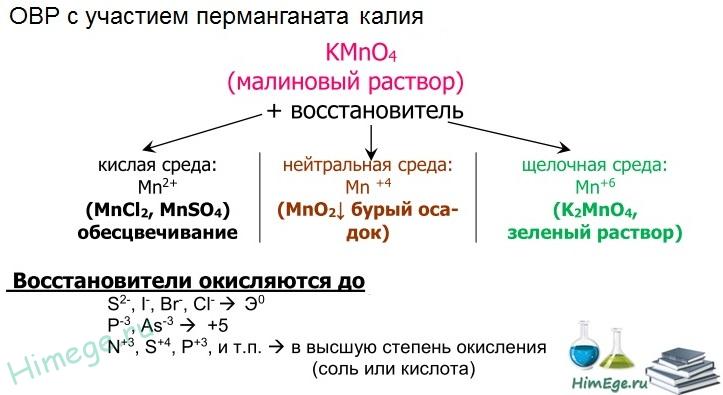
Качественная реакция на ион МnO4 — исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике. Уравнения важнейших реакций:
2КMnO4= К2MnO4 + МnO2 + O2 (200—240°С)
4КМnO4 + 2Н2O→МnO2↓+ 3O2↑ + 4КОН (t)
2КМnO4(т) + 16НСl(конц.) = 2МnС12 + 5С12↑ + 8Н2O + 2КС1 (80°С)
2КМnO4(т) + 2Н2SO4 (96%) = 2КНSO4 + Мn2O7 + Н2O (на холоду)
4КМnO4 (насыщ.) + 4КОН (15%) = 4К2МnO4+ O2↑ + 2Н2O (100 °С)
2КМnO4 + 2(NН3• Н2O)= 2МnO2↓ + N2↑ + 4Н2O+ 2КОН (50 °С)
2МnO4— + 16Н+ +10I— = 5I2+2Мn2+ + 8Н2O
2МnO4— + 6Н+ + 5Н2O2 (разб.) = 2Мn2+ + 5O2↑+ 8Н2O
2МnO4— + 6Н+ + 5SO32- =2Мn2+ + 5SO42- + ЗН2O
МnO4— + 8Н+ + 5Fе2+ = Мn2+ + 5Fе3+ + 4Н2O
2МnO4— + 6Н+ + 5NO2— = 2Мn2+ + 5NО3— + 3Н2O
2МnO4— + 3Н2S (насыщ.) = 2МnO2↓ + 3S↓ + 2Н2O + 2OН—
2МnO4— + Н2O + 3SO32- = 2МnO2↓ + 3SO42-+ 2OH—
2МnO4— + 2Н2O + ЗМn2+ = 5МnO2↓ + 4Н+ (50-80 °С)
2МnO4— + 2OH— (конц.) + SO32- = 2МnO42-+ SO42- + Н2O
Получение — электролиз раствора К2MnO4
Домашнее задание: А.В. Бабков, Т.И. Баранова, В.А. Попков. «Общая и неорганическая химия» – М: ГЭОТАР-Медиа, 2013. Стр. 314-317,321-323.
Внеаудиторная самостоятельная работа обучающихся: подготовка сообщений на тему «Применение марганца и его соединений в медицине».
Литература
1. А.В. Бабков, Т.И. Баранова, В.А. Попков. «Общая и неорганическая химия» – М: ГЭОТАР-Медиа, 2013.
2. Егоров А.С. Химия. Пособие-репетитор для поступающих в вузы. – Ростов н/Д, Феникс, 2007.
3. Хомченко Г.П. Химия для поступающих в ВУЗы/ Г.П. Хомченко, - М.: Новая Волна, 2007.
4. Глинка Н.Л. Общая химия: Учебное пособие/ Под ред. А.И. Ермакова. – М.: Интеграл-пресс, 2007-728с.
Преподаватель _______________
Дата добавления: 2021-04-15; просмотров: 76; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
