Особенности строения электронных оболочек атомов элементов больших периодов (переходных элементов).
К переходным элементам относятся элементы d – семейства.
Вопрос: 1) как определяют семейства элементов?
2) какие бывают семейства?
К d – семейству относят элементы, в электронных конфигурациях которых заполняется d-подуровень.
Переходные элементы являются элементами 4 периода. Они обладают общими свойствами, которые отличают их от непереходных элементов. Наиболее важными из них являются следующие.
1. Все переходные элементы являются типичными металлами, обладающими значительной твердостью, прочностью, высокими температурами плавления и кипения, высокой проводимостью, способностью образовывать разнообразные сплавы.
2. Для переходных металлов характерен более широкий набор степеней окисления, кислотно-основных и окислительно-восстановительных свойств их соединений.
3. Наличием незавершенных конфигураций d-орбиталей атомов переходных металлов обусловлены особенности магнитного поведения их соединений.
4. Соединения переходных элементов чаще окрашены, чем соединения непереходных элементов.
Задание: написать электронные конфигурации калия и кальция.
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4 s-подуровень, т.к. он имеет меньшую энергию, чем 3d-подуровень. К, Са — s-элементы, входящие в главные подгруппы. У атомов от Sc до Zn заполняется электронами 3d-подуровень. Это 3d-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
|
|
|
Порядок заполнения электронами атомных орбиталей определяется:
1.Принципом наименьшей энергии
Шкала энергий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
2. Состояние атома с полностью или наполовину заполненным подуровнем (т. е. когда на каждой орбитали имеется по одному неспаренному электрону) является более устойчивым.
Этим объясняется «провал» электрона. Так, устойчивому состоянию атома хрома соответствует следующее распределение электронов:
Cr: 1s22s22p63s23p64s13d5, а не 1s22s22p63s23p64s23d4,
т. е. происходит «провал» электрона с 4s-подуровня на 3d-подуровень.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4s− на 3d-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d5 и 3d10:
Cr 1s22s22p63s23p63d44s2… 
Cu 1s22s22p63s23p63d94s2… 

1s22s22p63p64s13d1 или1s22s22p63p63d14s1


1s22s22p63p64s23d2 или1s22s22p63p63d24s2


1s22s22p63p64s23d3 или1s22s22p63p63d34s2


1s22s22p63p64s23d10 или1s22s22p63p63d104s2


|
|
|
1s22s22p63p64s23d104p1 или1s22s22p63p63d104s24p1


1s22s22p63p64s23d104p6 или1s22s22p63p63d104s24p6
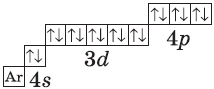
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни 3s,3р и 3d, всего на них 18 электронов. У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень. Элементы от Ga до Кr — р-элементы.
У атома криптона внешний (четвертый) слой завершен, имеет 8 электронов. Но всего в четвертом электронном слое, как вы знаете, может быть 32 электрона; у атома криптона пока остаются незаполненными 4d− и 4f-подуровни.
Закрепление.
Задание: написать электронные конфигурации марганца, железа, кобальта, никеля.
Дата добавления: 2021-02-10; просмотров: 233; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
