Келтірілген жылу. Клаузиус теоремасы.
Беттік керілу.
Беттік керілу — екі фазаның (дененің) бөліну бетінің термодинамикалық сипаттамасы. Өлшем бірліктері Дж/м2 немесе Н/м. Беттік керілуді бөліну беті сұйықтық болған жағдайда, бет контурының ұзындық бірлігіне әсер ететін және фазалардың берілген көлемдерінде бетті ең кіші шамаға (минимумға) дейін жиыруға ұмтылатын күш ретінде де қарастыруға болады. Екі қоюланған (конденсацияланған) фазаның шекарасындағы беттік керілу, әдетте, фазааралық керілу деп аталады. Жаңа бетті түзетін жұмыс, зат молекулаларын дене көлемінен беттік қабатқа ауыстыру кезіндегі молекулааралық ілініс күшін жеңуге жұмсалады. Беттік қабаттағы молекулааралық күштердің тең әсерлі күшінің шамасы дене көлеміндегідей нөлге тең болмайды әрі ол ілініс күштері көбірек болатын фаза ішіне қарай бағытталады. Сонымен беттік керілу беттік (фазааралық) қабаттағы молекулааралық күштердің теңгерілмеуінің өлшемі болады.
Сұйықтық ішіндегі молекулаларды жан-жағынан өзге молекулалар тартып тұрады. Және бұлар бір-бірін теңестіріп отыр.
Ал беттік қабатта орналасқан молекулаларға әсер ететің күш тек бір жағынан болады, судың үстінде молекулалар жоқ болғандықтан, осының салдарынан сұйықтықтың молекулалары ішке ұмтылады. Бұндай молекулалардың қорытқы күші ішке бағытталған.
|
|
|
Осының салдарынан сұйықтық бетінде беттік керілу күші пайда болады. Бұл күштің салдарынан сұйықтық бетінде беттік керілу деген атпен белгілі физикалық эффектер пайда болады. Осы керілу күшінің арқасында кейбір жәндіктер су бетінде сырғанай алады.
Беттік керілу коэффициенті
σ беттік керілу коэффициенті дегеніміз сұйықтық бетінде пайда болатын F керілу күшінің осы беттің l еңінің бөлімдісіне тең шама:
σ = F/l
Беттік керілу коэффициентінің өлшем бірлігі Н/м немесе Дж/м2.
12 Сұйықтардағы жұққыштық құбылысы.
Әр түрлі орталардың шекарасында (мыс: сұйық және қатты дене) жұғу және жұқпау құбылысын бақылауға болады. Молекулалық тартылу күштері сұйықтар мен қатты денелердің молекулаларының арасында да болады, олар шама жағынан сұйықпен қатты дененің табиғатына байланысты.
Егер сұйық пен қатты дененің молекулаларының арасындағы тартылыс күші сұйықтың молекулаларының тартылыс күшінен көп болса, сұйықтың молекулалары қатты дененің бетіне жабысады. Бұл құбылыс жұғу деп аталады, сұйық жұққыш деп аталады, ал сұйық беті гидрофильді болады (2-сурет). Егер сұйық пен қатты дененің арасындағы молекулаларының тартылыс күші, сұйықтың молекулаларының тартылыс күшінен аз болса, сұйық жұқпайтын деп аталады, ал сұйық беті гидрофобты болады (3-сурет).
|
|
|
Жұғу жағдайында бұрышq < p/2 , ал толық жұғылғанда q =00. Толық жұғылмағанда бұрыш
q =  -ғатең болады.
-ғатең болады.

Егер шыны таяқшаны сынапқа батырып алсақ, онда сынаптың жұғынын байқамаймыз. Ал егер осы таяқшаны суға батырып алсақ, онда оның ұшында су тамшысын байқаған болар едік. Бұл қарапайым тәжірибелер сынап молекулаларының тартылу күшінен артық болатынын көрсетеді, ал су молекулаларына келсек, олар бір-біріне шыны молекулаларына қарағанда әлсіз тартылады. Егер сұйық молекулаларының бір біріне тартылу күші қатты дене молекулаларының өзара тартылғанына қарағанда әлсіз болса, онда сұйық осы затқа жұғады. Мысалы, су таза шыныға жұғады да, ал парафинге жұқпайды. Егер сұйық молекулаларының бір-біріне тартылу күші қатты дене молекулаларының тартылу күшінен артық болса, онда сұйық осы затқа жұқпайды.
|
|
|
13 Сұйықтардағы беттік керілу құбылысы.
Сонымен беттік керілу беттік (фазааралық) қабаттағы молекулааралық күштердің теңгерілмеуінің өлшемі болады.Жылжымалы сұйықтық үшін беттік керілу — еркін беттік энергияға тепе-тең шама. Сыртқы әсер болмаған жағдайда сұйықтық беттік керілудің салдарынан шар (бет мейлінше кіші және еркін беттік энергияның мәні барынша аз болатын жағдай) пішіндес болады. Егер фазалардың көлемдері молекулалардың өлшемдерімен салыстырғанда жеткілікті үлкен болса, онда беттік керілу беттің шамасы мен пішініне тәуелді болмайды. Беттік керілу температураның жоғарылауынан, сондай-ақ, беттік белсенді заттардың әсерінен азаяды. Сұйықтық пен газдың (будың) немесе сұйықтық пен сұйықтықтың оңай жылжымалы шекарасындағы беттік керілуді әр түрлі жолмен өлшеуге болады. Молекулалары (атомдары) еркін орын ауыстыра алмайтындықтан қатты дененің беттік керілуін тәжірибе арқылы анықтау қиын. Анизотропия салдарынан кристалдың әр қырындағы беттік керілу әр түрлі болып келеді.
|
|
|
14 Капиллярлық құбылыс.
Капиллярлық құбылыстар– бір-бірімен араласпайтын заттардың шекарасында, беттік керілудің әсерінен пайда болатын физикалық құбылыстар.
Басқа сұйықтықпен, газбен немесе өзінің буымен шекаралас орналасқан сұйық бетінің иілуі де Капиллярлық құбылыстарқа жатады. Сұйықтық бетінің иілуі салдарынан, оның астында қосымша капиллярлық қысым (р) пайда болады. Бұл қысымның шамасы Лаплас теңдеуімен өрнектеледі: р=р1––р2=212/r, мұндағы 12 – екі ортаның шекарасындағы беттік керілу, р1 және р2 – сұйықтықтағы (1) және онымен жанасқан ортадағы (2) қысым, r – беттің орташа қисықтық радиусы. Сұйықтықтың ойыс бетінің (r<0) астындағы қысым теріс таңбалы (р<0), ал дөңес бетінің (r>0) астындағы қысым оң таңбалы (р<0) болады. Шекаралық бет жазық (r=) болса, сұйықтыққа қосымша қысым әсер етпейді (р=0). Капиллярлық құбылыстар молекулааралық күш пен сыртқы күш (негізінен, ауырлық күші) әсерінен болатын сұйықтық бетінің тепе-теңдігі мен қозғалысының кейбір түрлерін де қамтиды. Сыртқы күш әсер етпесе немесе ол басқа күшпен теңгерілсе, сұйықтық беті жазық болмай имек болады. Мысалы, салмақсыздық жағдайындағы шектелген сұйықтық көлемі беттік керілудің әсерінен шар тәрізді пішін алады. Бұл жағдайда сұйықтық орнықты тепе-теңдікте болады. Өйткені, көлемдері бірдей геометриялық денелердің ішінде бетінің ауданы ең аз болатын дене – шар. Едәуір мөлшерде алынған тұтқырлығы аз сұйықтық, өзі құйылған ыдыстың пішінін қабылдайды. Жердің тарту күші беттік керілудің әсерін жеңетіндіктен, мұндай сұйықтықтың бос беті жазық болады. Бірақ сұйықтықтың массасы кеміген сайын беттік керілудің рөлі артады. Сұйықтықты газ ішіне бүріккенде немесе газды сұйықтықпен араластырғанда шар тәрізді майда тамшылар немесе көпіршіктер пайда болады.
15 Еркіндік дәреже саны.
Еркіндік дәрежесінің саны[1] Серпімді жүйелердің тербелістерін зерттеу кезінде уақыттың әрбір сәтінде жүйенің орнын табудағы тәуелсіз параметрлер саны.
Еркіндік дәрежесі бойынша энергияның біркелкі таралу заңы - классикалық жүйелерге қолданатын статистиканың негізгі заңдарының бірі. Механикалық жүйенің еркіндік дәрежелері саны деп жүйенің орнын анықтауда мүмкіндік беретін тәуелсіз координаталардың жиынтығын айтады. Материалдық нүктенің кеңістіктегі орны оның үш координаттарының мәндерімен анықталады. Газдардың жылу сыйымдылығын өлшегенде атомдарды материалдық нүктелер деп есептеуге болады. Олай болса, бір атомды молекулалар үш ілгерілемелі еркіндік дәрежеге, екі атомды молекулалар – үш ілгерілемелі, және екі айналмалы, көп атомды молекулалар және абсолютті қатты дене – үш ілгерілемелі және үш айналмалы еркіндік дәрежесіне ие болады. Жылулық тепе-теңдік жағдайында молекуланың әр еркіндік дәрежесіне тең орташа бірдей кинетикалық энергиядан келеді. Мұндағы, - Больцман тұрақтысы. Екі немесе көп атомды молекулалар айналмалы және тербелмелі қозғалыстар жасайды. Тербелмелі қозғалыстың болуы кинетикалық энергияның потенциалдық энергияға ауысуынан және керісінше болуымен байланысты. Молекуладағы атомның тербеліс энергиясын ескерсек, орташа кинетикалық және орташа потенциалдық энергиясын қарастыруымыз қажет. Молекуланың толық энергиясы , (8.11) мұндағы i – ілгерілемелі, айналмалы және екі еселенген тербелмелі еркіндік дәрежелері сандарының қосындысы.
Атомдардың арасында қатаң байланысы бар молекула үшін i молекуланың еркіндік дәрежелерінің санына тең болады.
Массасы m газдың ішкі энергиясы газдың бір молінің энергиясын m массадағы киломольдердің санына көбейткенге тең болады.
16 Термодинамикалық жүйенің ішкі энергиясы.
Термодинамикалық жүйенің негізгі сипаттамасы оның ішкі энергиясы-U болып табылады. Ішкі энергия жүйенің микробөлшектерінің (молекулалар, атомдар, электрондар және т.б.) бейберекет қозғалысының кинетикалық энергиясынан, осы бөлшектердің өзара әсерлесуінің потенциалдық энергия-сынан және ішкі молекулалық энергиясынан тұрады. Денелер жүйесінің ішкі энергиясы әрбір жеке денелердің ішкі энергиялары мен денелер жанасатын жұқа қабаттағы молекулалардың арасындағы өзара әсерлесу энергиясы болып табылады.
Ішкі энергия жүйе күйінің функциясы болады. Демек, жүйе бір күйден екінші күйге өткен кезде оның ішкі энергиясының өзгерісі әрқашан да ауысу жолына тәуелсіз, яғни жүйенің бір күйден екінші күйге келтіретін процесіне немесе процестер жиынтығына тәуелсіз, тек осы күйлердегі ішкі энергияның мәндерінің айырымына тең.
Идеал газдарда молекулалардың өзара әсерлесуінің потенциалдық энергиясы нольге тең, сонда газдың бір моліне қатысты ішкі энергиясы NA молекулалардың кинетикалық энергияларының қосындысына тең болады:
Um=(i/2)kTNA=(i/2)RT (8.2)
Газдыңтаңдапалынған m массасыүшінішкіэнергия:
Um=( m/m)(i/2)RT =n( i/2)RT (8.3)
мұндағы m-заттыңмолярлықмассасы, n-мольдерсанынкөрсететінзатмөлшері.
Ішкіэнергия (U) негізіненекітүрліпроцестің: дененіңжұмыс A істеуіменденегеберілгенжылумөлшерінің Q есебіненөзгереді. Бірденеденекіншіденегеэнергияныңберілуінеәкелетінмакроскопиялықпроцестердіңжиынтығы жылуберілу депаталады.
17 Жұмыс және жылу мөлшері.
Жұмыс, физикада – күштің сан шамасы мен бағытына және оның түсу нүктесінің орын ауыстыруына тәуелді күш әсерінің өлшемі. Күштің жұмысы деп те аталады. Егер күштің (F) сан шамасы мен бағыты тұрақты, ал дененің орын ауыстыруы (M0M1) түзу сызықты болса (1-сурет), онда Жұмыс (А) мынаған тең: A=FScosa.
Жылу мөлшері - жылу берілу кезінде дененің алатын немесе жоғалтатын энергиясы жылу мөлшері болып табылады. Жылу мөлшері Q әрпімен белгіленеді. Жылу мөлшері ішкі энергия өзгерісінің өлшемі бола тұрып, дененің температурасына байланысты. Қыздыру барысында судың температурасын t 1-ден t 2-ге неғұрлым көбірек өзгерту керек болса, онда оған анағұрлым көп жылу мөлшерін беру қажет. Жылу мөлшері - физикалық шама және ол температураның t 1-ден t 2-ге дейінгі өзгерісіне пропорционал, яғни Q~(t2-t1). Егер дененің температурасы жоғарыласа, онда ол дененің қандай да бір жылу мөлшерін алғанын, егер төмендесе, онда жылу шығарғанын көрсетеді.
Жылу мөлшері - жылу алмасу кезінде дененің алған немесе жоғалтқан энергиясын айтады.
Жылу мөлшері мына шамаларға тәуелді: (тәжірибелер көрсетіледі).
• Дене температурасына;
• Дене массасына;
• Дене жасалған зат тегіне.
 ; өлшем бірлігі Дж
; өлшем бірлігі Дж
Белгілі заттың масса бірлігінің температурасын 10С-қа өзгертуге қажет жылу мөлшерін көрсететін физикалық шаманы меншікті жылу сыйымдылық деп атайды. 
өлшем бірлігі  .
.
18 Газ молекулаларының жылдамдықтары.

19 Идеал газ. Қысым.
20 Газдардың кинетикалық теориясының негізгі теңдеуін қорытып шығару. 
21 Менделеев-Клапейрон теңдеуі. Күй теңдеуі.

22 Молекула-кинетикалық теорияның негізгі теңдеуі.

23 Дальтон заңы.
Қоспа газдардың қысымы Дальтон заңының көмегімен анықталады:
Қоспа газдардың қысымы қоспаны құрайтын жеке газдардың парциаль қысымдарының қосындысына тең болады: 
Парциаль қысым деп қоспадағы басқа газдардың қысымын ескермеген жағдайдағы жеке газдардың түсіретін қысымын айтады. Қоспа газдарға Менделеев-Клапейрон теңдеуін қолдануға болады. 
мұндағы:  - қоспа газдың толық массасы,
- қоспа газдың толық массасы,  - қоспа газдың зат мөлшері,
- қоспа газдың зат мөлшері, 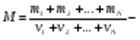 қоспа газдың мольдік массасы,
қоспа газдың мольдік массасы,  - қоспа газдағы жеке газдардың үлесі.
- қоспа газдағы жеке газдардың үлесі.
24 Газ молекулаларының жылдамдықтары.

25 Газ молекулаларының жылдамдықтарына байланысты таралуы.
Идеал газдың молекулаларының жылдамдықтар бойынша үлестірілу функциясы максимал болған кездегі жылдамдық, ең ықтимал жылдамдық деп аталады:

Орташа арифметикалық жылдамдықмына өрнектің көмегімен анықталады:

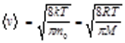
Молекулалардың орташа квадраттық жылдамдығымына өрнектің көмегімен анықталады:


 функциясы үлестірілу функциясы деп аталады. Шекке көше отырып мынаны аламыз:
функциясы үлестірілу функциясы деп аталады. Шекке көше отырып мынаны аламыз:

Сонымен, үлестірілу функциясы – бірлік көлемнің ішіндегі газ молекулаларының кез-келген  жылдамдықтың маңайында
жылдамдықтың маңайында  интервалында жататын жылдамдықты алу ықтималдылығы. Функцияның түрі былай беріледі:
интервалында жататын жылдамдықты алу ықтималдылығы. Функцияның түрі былай беріледі:

26 Максвелдік таралуды қорытып шығару.
1831 жылы Фарадей ашқан электромагниттік индукция құбылысын терең зерттей отырып Максвелл мынадай қорытындыға келді: магнит өрісінің кез келген өзгерісі қоршаған кеңістікте қуйынды электр өрісін туғызады.
Фарадей тәжірибелеріндегі тұйықталған өткізгіште индукциялық ЭҚК-ін тудыратын осы құйынды электр өрісі екен. Бұл құбылыстың ерекшелігі сол, құйынды электр өрісі тек өткізгіште ғана емес (ол өрістің бар-жоғын көрсететін қосымша құрал), бос кеңістікте де пайда бола алады. Кеңістіктің кез келген нүктелеріндегі магнит өрісі индукциясының өзгерісі кезінде құйынды электр өрісі туындайды.
27 Молекулалардың өзара әсерлесу күштері мен қарапайым потенциалдар.
Молекула аралық өзара әсер – электрлік қасиеті жағынан бейтарап молекулалар немесе атомдар арасындағы өзара әсер . Молекула аралық өзара әсер молекула аралық қашықтыққа (r) тәуелді және өзара әсердің потенциалдық энергия сы U(r) арқылы өрнектеледі. Заттардың көптеген қасиеттері мен агрегаттық күйі осы U(r)-дің шамасы арқылы анықталады. Молекула аралық өзара әсер ұғымын (1873) голланд ғалымы Я. Д. Ван-дер-Ваальс нақты газдар мен сұйықтықтардың қасиетін түсіндіруге қолданды. Оның болжамы бойынша бір-біріне жақын орналасқан молекулалар арасында тебіліс күштері әсер етеді де, ал молекула аралық қашықтық (r) артқанда бұл күштер тартылыс күштерімен алмасады.
28 Соқтығысулардың орташа жиілігі.
29 Еркін жүру жолының орташа ұзындығы.
Еркін жүру жолының орташа ұзындығы  - молекулалардың екі қатар соқтығысуының арасында орташа жүріп өткен жолы.
- молекулалардың екі қатар соқтығысуының арасында орташа жүріп өткен жолы.
Молекула 1 с орта есеппен орташа арифметикалық жылдамдыққа  тең жол жүретіндіктен және де бір газ молекуласының 1 с орташа соқтығысулар саны
тең жол жүретіндіктен және де бір газ молекуласының 1 с орташа соқтығысулар саны  болса, онда еркін жүру жолының орташа ұзындығы
болса, онда еркін жүру жолының орташа ұзындығы

|
Есептеулерде басқа молекулалардың қозғалысы ескерілсе,

|
Сонда

|
30 Клапейрон-Клаузиус теңдеуі.
Клапейрон - Клаузиус теңдеуі– заттың бір фазадан басқа бір фазаға (булану, балқу, сублимация , т.б.) ауысу процесін сипаттайтын термодинамикалық теңдеу. Клапейрон - Клаузиус теңдеуі бойынша тепе-тең күйде өтетін процестегі L фазалық ауысу жылуы (мысалы, булану жылуы, балқу жылуы) мына өрнек бойынша анықталады:

,мұндағы T – ауысу температурасы (изотермиялық процесс), dp/dT – фазалық тепе-теңдік қисық сызығындағы қысымның температура бойынша алынған туындысы,  – 1-фазадан 2-фазаға ауысу кезіндегі зат көлемінің өзгерісі. Клапейрон - Клаузиус теңдеуі француз оқымыстысы Б.П. Э.Клапейрон ( 1799 – 1864 ) сұйықтық пен жылулық тепе-теңдікте тұрған конденсацияланған буға арналған Карно циклін талдау нәтижесінде алды ( 1834 ). 1850 ж. неміс физигі Р.Клаузиус ( 1822 – 1888 ) теңдеуді одан әрі жетілдіріп, оны басқа да фазалық ауысуларға арнап, қорытындылады. Бұл теңдеуді жылуды жұту немесе шығару арқылы өтетін кез келген фазалық ауысуларға қолдануға болады. Клапейрон - Клаузиус теңдеуін шешу үшін L, V1 және V2 шамаларының температура мен қысымға байланысты қалай өзгеретіндігін білу қажет. Мұның өзі күрделі мәселе. Әдетте, бұл тәуелділік тәжірибе жүзінде анықталып, Клапейрон - Клаузиус теңдеуінің сан мәні есептеледі. Клапейрон - Клаузиус теңдеуі таза заттармен қатар ерітінділерге және олардың жеке құраушыларына да қолданылады. Соңғы жағдайда Клапейрон - Клаузиус теңдеуін берілген құраушыдағы будың парциал қысымын, оның парциал булану жылуымен байланыстырады
– 1-фазадан 2-фазаға ауысу кезіндегі зат көлемінің өзгерісі. Клапейрон - Клаузиус теңдеуі француз оқымыстысы Б.П. Э.Клапейрон ( 1799 – 1864 ) сұйықтық пен жылулық тепе-теңдікте тұрған конденсацияланған буға арналған Карно циклін талдау нәтижесінде алды ( 1834 ). 1850 ж. неміс физигі Р.Клаузиус ( 1822 – 1888 ) теңдеуді одан әрі жетілдіріп, оны басқа да фазалық ауысуларға арнап, қорытындылады. Бұл теңдеуді жылуды жұту немесе шығару арқылы өтетін кез келген фазалық ауысуларға қолдануға болады. Клапейрон - Клаузиус теңдеуін шешу үшін L, V1 және V2 шамаларының температура мен қысымға байланысты қалай өзгеретіндігін білу қажет. Мұның өзі күрделі мәселе. Әдетте, бұл тәуелділік тәжірибе жүзінде анықталып, Клапейрон - Клаузиус теңдеуінің сан мәні есептеледі. Клапейрон - Клаузиус теңдеуі таза заттармен қатар ерітінділерге және олардың жеке құраушыларына да қолданылады. Соңғы жағдайда Клапейрон - Клаузиус теңдеуін берілген құраушыдағы будың парциал қысымын, оның парциал булану жылуымен байланыстырады
Ерітінділер.
Ерітінді — бір заттың екінші бір заттық ортада біркелкі таралуы аркылы әзірленген гомогендік жүйе ; кем дегенде екі компоненттерден, бірі еріткіш , екіншісі еритін зат болатын айнымалы құрамның химиялық тепе-теңдiк күйі болатын жүйе. Ерітінділер газ тәрізді, сұйық және қатты болуы мүмкін (сондай-ақ полимерлердің ерітінділері ерітінділердің үлкен тобын құрайды). Олардың ішінде жан-жақты зерттелгені және жиі қолданылатыны сұйық, әсіресе, сулы ерітінділер. Сондықтан тұрмыста ерітінділер деп, көбінесе, сұйық күйдегі молекула -дисперстік жүйелерді айтады.
Ерітінділер концентрацияларының түрлері: Ерітінділердің құрамы құрамдас бөліктердің концентрацияларымен сипатталады. Ерітінділер қаныққан, қанықпаған және аса қаныққан деп бөлінеді. Берілген температурада жақсы еритін заттардың ерігіштігінің де шегі бар. Еріген заттың концентрациясы белгілі бір мөлшерден асқанда, оның артығы ерімей, ерітіндінің түбіне шөгеді. Бұл кезде ерітінді мен еріген зат тепе-теңдік жағдайда болады. Мұндай ерітінділерді қаныққан ерітінділер, ал концентрациялары қаныққан ерітіндінің концентрациясына дейінгі барлық ерітінділерді қанықпаған ерітінділер деп атайды. Кейбір еріткіштің белгілі бір мөлшерінде еритін заттың ерігіштігіне сәйкес мөлшерінен де артық мөлшерін ерітуге болады. Мұндай ерітінділер аса қаныққан ерітінділер деп аталады. Аса қаныққан ерітінділердің тұрақтылығы нашар болады. Кез келген сыртқы әсерден еріген заттың артық мөлшері ерітіндіден бөлініп, тұнбаға түседі. Сөйтіп аса қаныққан ерітінді жай қаныққан ерітіндіге айналады.
Электролиттер және бейэлектролиттер: Кей заттар ерігенде олардың молекулалары иондарға ыдырайды, яғни диссоциацияланады . Электр тогын өткізетін болғандықтан, ондай заттардыңерітінділерін электролит ерітінділері деп атайды. Оған көптеген қышқылдар мен негіздердің , әсіресе, тұздардың ерітінділері жатады. Керісінше, ерігенде молекулаларыиондарға ыдырамайтын,сондықтан электр тогын өткізбейтін заттардың ерітінділері бейэлектролиттердің ерітінділері деп аталады.
Ерітінділердің теориялары:
Физикалық теориясы. Ерітінділердің бетіндегі бу қысымы және оның қату температурасы таза еріткіштікке қарағанда төмендеу, ал қайнау температурасы жоғарылау болады. Сонымен қатар ерітінділерде осмос қысымы байқалады. Ерітінділердің бұл қасиеттерінің барлығы тек еріген заттың молекулалар санына ғана тәуелді. Олардың өзгерістері Вант-Гофф және Рауль заңдарымен сипатталады. Мысалы, ацетонның , кез келген эфирдің немесе спирттің судағы концентрациялары бірдей ерітінділерінің осмос және бу қысымдарының салыстырмалы төмендеулері, қату температураларының төмендеуі, ал қайнау температураларының жоғарылауы бірдей болады. Бұдан кейбір ғалымдар ерітінді түзілгенде еріткіш пен еріген зат арасында ешқандай әрекеттесулер болмайды, олар тек араласады деген қорытындыға келген. Сондықтан бұл қасиеттер ерітінділердің физикалық теориясына тәжірибелік негіз болған. Идеал газдар сияқты молекулаларының арасында ешқандай әсерлесулер болмайтын, дәлірек айтқанда, мейлінше аз болатын ерітінділер идеал ерітінділер, ал қалғандарын реал ерітінділер деп атайды.
Химиялық теориясы. Күшті электролиттердің ерітінділерінің кейбір қасиеттері сұйылтылған ерітінділердің қасиеттерін сипаттайтын заңдылықтарға бағынбайды. Олардың біраз қасиеттері Дебай мен Гюккельдің “күшті электролиттер теориясымен” сипатталады. Сонымен қатар ерітінділер түзілгенде жылу бөлінуі, жүйе түсінің құрамдас ебөліктер түсінен өзгешелігі және ерітінділер көлемінің құрамдас бөліктер көлемінің қосындысына қарағанда кемуі еріген зат пен еріткіш арасында химиялық әрекеттесулер болатынын көрсетеді. Кейде олардың арасындағы байланыстың беріктігі соншалық, ерітінділерді суытқанда еріткіштің біраз мөлшері еріген затпен бірге кристалданады. Оларды жалпы сольваттар , ал еріткіш су болғанда кристаллогидраттар деп атайды. Бұл қасиеттер ерітінділердің химиялық теориясына тәжірибелік негіз болды.
Температура. Термометрлер.
Температура ( лат. temperatura – араластырылуға тиісті, өлшемдес болу, қалыпты күй) – макроскопикалық жүйенің термодинамикалық тепе-теңдік күйін сипаттайтын физикалық шама . Егер оқшауланған немесе тұйықталған жүйе термодинамикалық тепе-теңдік күйде болса, онда оқшауланған немесе тұйықталған жүйенің кез келген бөлігінде температура бірдей болады. Ал егер жүйе тепе-теңдік күйде болмаса, онда жылу (энергия) оның температурасы жоғары бөлігінен температурасы төмен бөлігіне қарай ауысып, белгілі бір уақыт өткеннен кейін жүйенің барлық бөліктеріндегі температура өзара теңеседі. Молекула кинетикалық теория тұрғысынан тепе-теңдіктегі жүйенің температурасы сол жүйені құрайтын атомдардың, молекулалардың, т.б. бөлшектердің жылулық қозғалысының қарқындылығын сипаттайды. Мысалы, классикалық статистикалық физиканың заңдарымен сипатталатын жүйе үшін бөлшектердің жылулық қозғалысының орташа кинетикалық энергиясы жүйенің абсолют температурасына тура пропорционал болады. Бұл жағдайда температура дененің жылыну (қызу) дәрежесін сипаттайды. Жалпы жағдайда температура жүйе энергиясының энтропия бойынша алынған туындысымен анықталады және ол әрқашан оң болады. Осылай анықталған температура абсолют температура немесе термодинамикалық шкала температурасы деп аталады. Бірліктердің халықаралық жүйесінде абсолют температураның бірлігіне кельвин (К) қабылданған. Көп жағдайда температураны Цельсий шкаласы (t) бойынша өлшейді. Ал t және Т бір-бірімен: t=T-273,15К теңдігі арқылы байланысқан (мұнда Цельсий градусы кельвинге тең). Дене температурасы термометр арқылы өлшенеді.
Температуралық шкаласы
Температуралық шкаласы- қалыпты кысым кезінде мұздың еру нүктесі нөл градусқа, ал қайнау нүктесі - 80 градусқ теӊ.
Кельвин температуралық шкаласы
Кельвин температуралық шкаласы- температура бірлігі ретінде кельвин алынатын термодинамикалык температуралык шкала.
Ремюр температуралық шкаласы
Ремюр температуралық шкаласы - қалыпты қысымда мұздың еру нүктесі нөл градуска, ал судың кайнау нүктесі 80 градуска сәйкес келетін температуралык шкала. Муздын еру температурсы 0 градуска сайкес келеды.
Фаренгейт температуралық шкаласы
Фаренгейт темературалық шкаласы - қалыпты қысымда мұздың еру нүктесі 32 градуска, ал судың кайнау нүктесі 212 градуска сэйкес келетін температуралық шкала.
Цельсий температуралық шкаласы
Цельсий темературалық шкаласы - калыпты кысымда мұздың еру нүктесі нөл градуска, ал судың кайнау нүктесі 100 градуска сәйкес келетін температуралык шкала.
Термометр ( гр. θέρμη — жылу; Үлгі:Lang-el2 — өлшеймін) — дененің, заттың, ауаның температурасын өлшеуге арналған аспап. Термометрді ойлап тапқан адам ретінде Галилео Галилейді атайды. Оның өз қолымен жазған еңбектерінде термометрдің нақты сипаттамасы жоқ, бірақ оның шәкірттері Нелли мен Вивиани Галилейдің 1597 жылы термоброскопқа ұқсас бір нәрсе жасап шығарғанын байқаған. Галилей бұл кездері өзі жасап шығарған аспапқа ұқсайтын құралдың сипаттамасы кездесетін Герон Александрийскидің еңбектерін зерттеп жүрген еді, бірақ ол денелердің температурасын өлшеу үшін емес, судың температурасын жылыту арқылы көтеру үшін арналған еді. Термоскоптың құрылысы трубкаға жабыстырылған шыныдан жасалған шариктен тұрды. Шарикті аздап қыздырып, трубканың соңын су құйылған ыдысқа сүңгітеді. Аздаған уақыттан кейін шариктің ішіндегі ауа салқындайды, оның қысымы төмендеп, су атмосфералық қысымның нәтижесінде трубка бойымен жоғары көтеріледі. Одан кейін біраз уақыт өткен соң, шариктің ішіндегі ауаның температурасы төмендеп, судың деңгейі түсе бастайды. Термоскоптың көмегімен тек дененің жылу деңгейін ғана білуге болатын еді, температураның сандық мәнін білу мүмкін емес еді, өйткені шкала жоқ еді. Оған қоса, судың деңгейі тек дененің температурасынан ғана емес, атмосфералық қысымға да байланысты еді.
1657 жылдары Галилейдің термоскопын флоренциялық ғалымдар жетілдірді. Олар аспапқа шкала орнатып, шариктағы және трубкадағы суды алып тастады. Бұл тек сапалық жағынан емес, сандық жағынан денелердің температурасын салыстыруға сүмкіндік берді. Осының нәтижесінде аспап мүлдем өзгеріп сала берді: термоскопты шаригімен төмен қаратып, трубкаға судың орнына спирт құйылды және ыдысты алып тастады. Бұл аспаптың қызметі денелердің кеңеюіне негізделді, «үнемі» сақталып тұратын нүктелер ретінде жазғы ең ыстық температура мен қысқы ең суық температура алынды. Термометрды ойлап табушылардың қатарында лорд Бэкон , Роберт Фладд, Санкториус, Скарпи, Корнелио Дреббельдің есімдері де аталады және Галилеймен жақсы қатынаста болған Порте мен Соломон де Каус та бар. Бұл барлық термометрлар құрылғы ішіндегі ауа мен суға байланысты еді. Олар температура мен атмосфералық қысымға байланысты өз көрсеткіштерін өзгертіп отырды.
Бұдан кейін де біраз италия және франция ғалымдары термометрді дамытты. Ал термометрді қазіргі түріне 1723 жылы Фаренгейт келтірді және оны қалай істейтінін суреттеп берді. Басында ол да өз трубкаларын спиртпен толтырды, сосын барып сынапқа көшті. Өзінің шкаласында нөл деп ол қар мен нашатыр немесе ас тұзымен араласқандағы температураны алды. Ал судың қатуының бастауы деп 32° градусты, ал сау адамның денесінің температурасы ретінде ол 96° алды. Сосын ол судың қайнау температурасын анықтады, ол 212° тең болды.
Мұздың еруі мен судың қайнау температурасын 1742 жылы Цельсий нақтылап көрсетті, бірақ басында ол 0°-ты қайнау, ал 100°-ты қату температурасы ретінде көрсетті сосын Штремердің кеңесі бойынша оларды керісінше орналастырды. Фаренгейттің термометрлары жасалуы бойынша әдемі істелінген, бірақ Цельсийдің жасаған термометрлары ыңғайлырақ болды. Реомюрдің 1736 жылы жасаған жұмыстары Фаренгейттің жасағандарынан бір қадам артта тұрғандай болды. Реомюрдің термометрі үлкен, қолдануға ыңғайсыз, ал оның шкалалары нақты температураны көрсете алмады. 1848 жылы ағылшын ғалымы Уильям Томпсон (лорд Кельвин) температуралардың абсолютті шкаласын жасауға болатынын дәлелдеді, бұл жағдайда нөл, судың құрамына немесе термометрді толтырып тұрған сұйықтыққа еш қатысы болмайды. «Кельвин шкаласында» есептеу нүктесі ретінде абсолют нөл ұғымы алынды. Оның мәні: -273,15°С-қа тең. Бұл температурада молекулалардың жылулық қозғалысы тоқтайды, өз кезегінде денелердің бұдан әрі салқындауы мүмкін емес. Қазір термометрлардың көп түрі бар:
Сұйық заттар арқылы жұмыс істейтін термометрлар – сыртқы температураның өзгеруіне байланысты термометрдың ішіне құйылған сұйықтықтың көлемінің өзгеруіне негізделген.
Электрлі термометрлар – бұл термометрлердің жұмыс істеу принципі сыртқы температура өзгергенде өткізгіште пайда болатын қарсылыққа байланысты.
Механикалық термометр – бұл термометрлардың жұмыс істеу принципі жоғарыда айтып өткен термометрлар сияқты, тек бір айырмашылығы мұнда датчик орнына металды спираль немесе биметалдан жасалған лента қолданылады.
Инфрақызыл термометрлар – инфрақызыл термометрлер денеге жанаспай-ақ температураны анықтай алады. Дамыған елдерде сынапты термометрларды медициналық деңгейді былай қойғанда, үй жағдайында да қолданбайды. Инфрақызыл термометрлардың мүмкіндіктері өте зор:
v Қолдануда қауіпсіз
v Барынша нақты нәтиже көрсетеді
v Нәтижені аз уақыт ішінде көрсетеді (шамамен 0,5 секунд).
33 Температураның тәжірибелік және абсольюттік шкалалары. температураның әр түрлі мәндеріне сәйкес келетін цифрлар тізбегінің жүйесі. Температура тікелей өлшеуге болмайтын шама. Сондықтан оның мәнін қарастырылып отырған заттың басқа бір физикалық қасиетінің (көлемнің, қысымның, электр кедергісінің, ЭҚК-нің, сәуле шығару қарқындылығының және т. б.) температуралық өзгерісі бойынша анықтайды. Температуралық шкаланы құру үшін температураның бастапқы санақ нүктесі және температура бірлігінің өлшемі (градус) таңдап алынады. Эмпирикалық температуралық шкала әдетте осылай анықталады. Температуралық шкалада негізінен бір құраушылы жүйенің фазалық тепе-теңдік нүктелеріне (реперлік немесе тұрақты нүктелер деп аталатын) сәйкес келетін негізгі екі температура белгіленеді.
34 Ерігіштік.заттың белгілі бір еріткіште еру қабілеті. Белгілі бір жағдайдағы заттың ерігіштігінің сипаттамасы ретінде оның қаныққан ерітіндідегі концентрациясы алынады. Сондықтан ерітіндінің құрамын қалай сипаттаса, ерігіштікті де сан жағынан солай сипаттайды. Мысалы, заттың белгілі бір температурада белгілі бір еріткіштегі ерігіштігін оның қаныққан ерітіндісіндегі еріген заттың массалық үлесімен не оның молярлық концентрациясымен (моль/л) сипаттауға болады. Ерігішті көбінесе, еріткіштің 100 массалық бірлігінде қаныққан ерітінді түзілгенше еритін еріген заттың масса бірлігімен көрсетеді. Оны кейде ерігіштік коэффициенті деп те атайды, молекулалары полюсті немесе иондық байланыспен байланысқан заттар (су, спирт, сұйық аммиак) полюсті еріткіштерде жақсы еритіндігі, ал молекулалары полюссіз заттар (бензол, күкіртті көміртек) полюссіз еріткіштерде еритіндігі анықталды. “Ұқсас заттар бір-бірінде жақсы ериді” деген ескі қағида осы заңдылықты тұжырымдайды.
Идеал ертінділер.
кез келген температурамен концентрацяларда Рауль заңына бағынатын ертінділерді идеал ертінділер деп атайды. Рауль заңы; Кез келген затты еріткенде ерткіш буының қысымы төмендейді,Осы негізде ертінді құрамы мен бу қысымының төмендеуі арасындағы байланысты Ф.Рауль ашты.
36 Термодинамикалық жүйенің ішкі энергиясы.молекулалардың ретсіз қозғалысының кинетикалық энергиясы, молекулалардың өзара әсерлесуінші потенциялық энергиясы және ішкі молекулалық энергиясы кіреді. Ішкі энергия жүйе күйінің функциясы болып табылады.
37 Жұмыс және жылу мөлшері.
Жұмыс, физикада – күштің сан шамасы мен бағытына және оның түсу нүктесінің орын ауыстыруына тәуелді күш әсерінің өлшемі. Күштің жұмысы деп те аталады. Егер күштің (F) сан шамасы мен бағыты тұрақты, ал дененің орын ауыстыруы (M0M1) түзу сызықты болса (1-сурет), онда Жұмыс (А) мынаған тең: A=FScosa.
Жылу мөлшері - жылу берілу кезінде дененің алатын немесе жоғалтатын энергиясы жылу мөлшері болып табылады. Жылу мөлшері Q әрпімен белгіленеді. Жылу мөлшері ішкі энергия өзгерісінің өлшемі бола тұрып, дененің температурасына байланысты. Қыздыру барысында судың температурасын t 1-ден t 2-ге неғұрлым көбірек өзгерту керек болса, онда оған анағұрлым көп жылу мөлшерін беру қажет. Жылу мөлшері - физикалық шама және ол температураның t 1-ден t 2-ге дейінгі өзгерісіне пропорционал, яғни Q~(t2-t1). Егер дененің температурасы жоғарыласа, онда ол дененің қандай да бір жылу мөлшерін алғанын, егер төмендесе, онда жылу шығарғанын көрсетеді.
Жылу мөлшері - жылу алмасу кезінде дененің алған немесе жоғалтқан энергиясын айтады.
Жылу мөлшері мына шамаларға тәуелді: (тәжірибелер көрсетіледі).
• Дене температурасына;
• Дене массасына;
• Дене жасалған зат тегіне.
 ; өлшем бірлігі Дж
; өлшем бірлігі Дж
Белгілі заттың масса бірлігінің температурасын 10С-қа өзгертуге қажет жылу мөлшерін көрсететін физикалық шаманы меншікті жылу сыйымдылық деп атайды. 
өлшем бірлігі  .
.
38 Термодинамиканың бірінші бастамасы.
Термодинамиканың бірінші бастамасы — термодинамикалық жүйелер үшін керек энергияның сақталу заңы; бұл заң бойынша жүйеге берілетін жылу оның ішкі энергиясын өзгертуге және жүйенің сыртқы күштерге қарсы жұмысына жұмсалады.
Дене күйінің барлық энергиясы - микроскопиялық қозғалысының толық түріндегі сыртқы кинетикалық энергиясы Ек және салмақ күші өрісі, электрлі немесе магнит өрісі жағдайындағы потенциалды энергия Еn, сонымен қатар, дене бөлшектерінің құрамдық әрекеттері мен қозғалу энергиясын жасаушы ішкі энергия U қосындыларынан тұрады:
E = Ek + E n +U
Қаралып отырған жылу динамикалық жүйе шамаланса, онда дененің орталық салмақтық алмасу жылдамдығы өте аз (С=0), яғни қозғалыссыз жұмыстық дене көлемінің өзгеруі туралы сөз болады, сондықтан Ек=0. Айталық, Ер=0 сонымен, бұл жерде толық энергия ішкімен бірдей (E=U), ал жүйе энергиясының өзгеруі - жұмыстық дененің, ішкі энергиясының өзгеруіне келтіреді.
Жылу динамикасының бірінші заңына сәйкес, жұмыстық дененің энергиясы кезінде, қабылданған жағдайға тиісті кезіндегі жүйенің өтуі 1 бастапқы күйінен 2 соңғы мәндеріне артуы, денеге берілген жылулық dQ және мәніне келуі dL істелінген жүйе жұмысына тең: dU=dQ-dL немесе әдетте былай жазу қабылданған -
Q = dU + dL
Сыртқы ортамен әрекеттестігі жоқ болғандағы кезінде (dQ=0 және dL=0), формуладағы dU=0, яғни жүйе энергиясы өзгеріссіз сақталады. Жүйелер қатнасының жекеленген жылулығы үшін, ондағы dQ=0 екені белгілі.
dU + dL = 0
Теңдеу жұмыстық дененің еркінше алынған санды массасы m арналып жазылған, ал меншікті мәндері үшін былай жазылады:
dq = du + dl
мұндағы q - меншікті жылулық саны; l - меншікті жұмыс; u - меншікті ішкі энергия, q, u, l бірлік өлшемі Дж/кг.
Бұл теңдеу үшін, жылудинамикасының бірінші заңының талдаушы тұжырымдалуын көрсетеді, осыған сәйкес жүйеге жеткізілген жылу, жүйелердің ішкі энергиясына жұмсалады және жұмыстың атқарылуына қарсы денеге түскен сыртқы күш. Олар, қайтымдыға да және сыртқы қайтымсыз процесстер үшін де әділетті. Себебі, қабылданған жағдайдағы жылу алмасуы кезінде, дене мен орта арасының соңғы температура айырмашылығы кезінде, қайтымсыз жылуалмасуына сәйкес келеді.
39 Газдардың жылу сыйымдылығы.
Газдардың жылу сыйымдылығы тұрақты қысымдағы жылу сыйымдылық және тұрақты көлемдегі жылу сыйымдылық болып бөлінеді.
Газды тұрақты көлемде қыздырған жағдайда

жүйеге берілген жылу түгелдей ішкі энергияны арттыруға жұмсалады.
Бір моль газ үшін тұрақты көлемдегі молярлық жылу сыйымдылық  (1)
(1)
болады.
 ,
,
ендеше
 (2)
(2)
болады.
Газды тұрақты қысымда қыздырған жағдайда бір моль газ үшін термодинамиканың бірінші заңы:

мұндағы  - 1 моль газдың көлемі.
- 1 моль газдың көлемі.
Ал тұрақты қысымдағы молярлық жылу сыйымдылық
 (3)
(3)
болады.
Менделеев-Клапейрон теңдеуін қолданып:

немесе бұл формуланы төмендегідей жазуға болады:
 (4)
(4)
(3) формуласына (1) мен (4)-ді қойғанда:
 (5)
(5)
Бұл Майер теңдеуі делінеді.
(2) формуласын (5)-ға қойсақ:
 (6)
(6)
шығады.
Сонда  - ның
- ның  -ға қатынасы мынаған тең:
-ға қатынасы мынаған тең:

40 Термодинамиканың 1-ші бастамасын изопроцестерге қолдану.
Изохоралық процесс. Бұл процесте газ көлемi өзгермейдi: V = const. Газдың iшкi энергиясының өзгерiсi оған берiлген жылу мөлшерiне тең: ΔU = Q. Егер газ қыздырылса, онда Q > 0 және ΔU > 0 – iшкi энергия ұлғаяды. Газды суытқан кезде: Q < 0 және ΔU < 0, оның iшкi энергиясы азаяды.
Изотермалық процесс. Изотермалық процесс кезiнде газдың температурасы тұрақты болады (Т = const) және оның iшкi энергиясы өзгермейдi. Газға берiлген барлық жылу мөлшерi пайдалы жұмыс атқаруға жұмсалады: Q = А′. Газ белгiлi жылу мөлшерiн (Q > 0) алған кезде, ол оң жұмыс атқарады (А′ > 0). Керiсiнше, егер газ қоршаған ортаға жылу берсе, онда оның атқарған жұмысы терiс болып саналады.
Изобаралық процесс. Изобаралық процесс кезiндегi газға берiлген жылу мөлшерi оның iшкi энергиясының бiрге өзгеруiне және қысым тұрақты болған кездей P = const жұмысты атқаруға шығындалады.
Адиабаталық процесс. Қоршаған ортамен жылу алмасуы болмайтын жағдайда өтетiн жүйедегi изопроцесс адиабаталық процесс деп аталады.
Адиабаталық процесс кезiнде Q = 0 және жүйенiң iшкi энергиясының өзгеруi жұмыс атқару арқылы ғана жүредi: ΔU= А. ΔU= А теңдiгi белгiлi қорытынды жасауға мүмкiндiк бередi. Егер жүйеде оң жұмыс жасалса, мысалы газ сығылатын болса, онда оның iшкi энергиясы ұлғаяды және температурасы өседi. Керiсiнше, газ ұлғайған кезде, ол өзi оң жұмыс атқарады (Аұ > 0). Оның iшкi энергиясы азаяды да, газ суиды.
41 Қайтымды және қайтымсыз процестер.
Қайтымды процесс кері бағытта өткізуге болатын процесті тура бағытта өткізгенде жүйе қандай күйлерден өтсе, кері бағытта сондай тізбегінен өтетін процесті айтады. Қайтымды процеске тек тепе тең процестер жатады. Қайтымды процесте жүйені қоршаған денелерде ешқандай өзгеріс болмайды.
Қайтымсыз процестер өздігінен бір бағытта өтетін процес. Нақты процестер қайтымсыз процестер болады. Олар мейлінше баяу өте отырып, қайтымды процестерге тек жуықтай алады. Қайтымды процеске мысал ретінде вакумдегі абсолют серпімді серіппеге ілінген дененің өлшейтің тербелісің алуға болады. Кедергісі бар ортада өтетін процестердің барлығы қайтымды процестер. Қайтымсыз процестерге температуралары әр түрлі денелердің бір біріне жылу алмасу салдарынан температуралары тенелу процесі жатады, себебі жылу ыссы денеден салқынға беріледі, керісінше болу мүмкін емес.
Термодинамиканың ІІ бастамасы термодинамикалық процестердің қайтымсыздығын тұжырымдайды.
-тек қана жұмыс өндіретін немесе бір жылулық резервуармен энергия алмасуын жасайтын циклдік процесс болуы мұмкін емес (У.Томсон);
- салқын денеден ыстық денеге жылу берілуі мүмкін болатын циклдік процесс болуы мүмкін емес (Р.Клаузиус).
42 Тепе-тең және тепе-теңсіз процестер.
Жүйенің тепе-тең күйі деп жүйенің барлық параметрлері, сыртқы жағдайлар өзгермей қалған кезде жеткілікті уақыт бойы тұрақты болып қалатын белгілі мәндерін сақтайтын күйін айтамыз. Тепе-тең күйлердің үздіксіз тізбегінен құралған процесс тепе-тең процесс деп аталады. Тепе-тең күй ұғымы мен қайтымды процесс ұғымы термодинамикада үлкен рөл атқарады.
Тепе-теңсіз процестерді макроскопиялық тұрғыда сипаттаудың жалпы теориясы қайтымсыз процестердің термодинамикасы деп аталады. Осы статистикалық теорияның негізінде тепе-тең емес жүйелер үшін барлық макроскопиялық заңдылықтар анықталуы тиіс. Классикалық термодинамика тепе-тең процестердің толық мөлшерлік сипаттамасын береді, ал тепе-тең емес жүйелер үшін ол қарастырылатын процестердің тек бағытын ғана анықтауға мүмкіндік беретін теңсіздіктер тағайындайды.
Осыған байланысты соңғы жылдары классикалық термодинамиканы және жекелеген тепе-теңсіз процестер үшін анықталған тәжірибелік заңдылықтарды жалпылайтын қайтымсыз құбылыстар термодинамикасы құрылуда. Бұлар, қазіргі кезеңде, тепе-теңсіз жүйелердің статистикалық теориясы толық құрылып болмағанымен, физикаға, аздаған негізгі қағидалардың негізінде, практикалық тұрғыда аса маңызды көптеген мәселелерді түсіндіруге мүмкіндік берді.
Термодинамикалық тепе-тең жүйелерде күй параметрлері зерттелетін нысанды тұтасымен сипаттайды. Ал тепе-теңсіз жүйелер үшін барлық физикалық шамалар жүйенің жекелеген кішігірім бөліктеріне қатысты анықталады, яғни, олар төңіректік (локалдық) макроскопиялық сипаттамалар түрінде қарастырылады.
Релаксация уақыты жүйенің өлшемдері, яғни көлемі өскен сайын артатыны белгілі. Олай болса, оның кіші бөліктерінде тепе-тең күй, осы бөліктердің арасында тепе-теңдік орнағаннан, әлдеқайда ерте орнайды. Сондықтан, тұтас жүйеде тепе-теңдік орнамағанымен, оның макроскопиялық кіші бөліктерінде орын алатын төңіректік тепетеңдік туралы айтуға болады. Әрбір элементар көлем, координаталар мен уақытқа тәуелді, өзіне тән температурамен, қысыммен және т.б. термодинамикалық параметрлермен сипатталады.
Осылардан, кіші бөліктердің күйін бұрын пайдаланылған параметрлердің және термодинамикалық функциялардың көмегімен сипаттауға болады. Әрине, мұнда, біріншіден, жүйенің кіші бөліктері өте көп молекулалар санынан тұрады, екіншіден, тепетең күйден ауытқу мардымсыз, үшіншіден, көршілес элементар көлемдердің қасиеттерінің арасында айырмашылық елеусіз, төртіншіден, жүйедегі барлық процестер жеткілікті дәрежеде баяу жүреді деп болжанады.
43 Дөңгелек процестер немесе циклдар.
Дөңгелек процесс, цикл — жүйенің бірнеше өзгерістерден кейін бастапқы қалпына келу процесі, термодинамикалық процесс. Дөңгелек процесстің нәтижесінде жүйе күйінің термодинамикалық параметрлері мен сипаттамалық функциялары (U — ішкі энергия, энтальпия, изохоралық және изобаралық термодинамикалық потенциалдар, энтропия, т.б.) бастапқы мәнге ие болады. Сондықтан олардың (термодинамикалық параметрлердің, сипаттамалық функциялардың) өзгерістері нөлге тең (U=0, т.б.). Термодинамиканың бірінші бастамасы (яғни энергияның сақталу заңы, Термодинамиканың бастамалары) бойынша жүйенің не жүйелердің дөңгелек процесс кезінде атқарған жұмысы (А) дөңгелек процесстің әрбір учаскесінің алған не берген жылу мөлшерлерінің (Q) алгебра қосындысына тең: U=Q–A=0, A=Q. Тура дөңгелек процесс (атқарылған жұмыс оң) деп аталатын процесте жылу жұмысқа айналады, ал кері дөңгелек процесс (атқарылған жұмыс теріс) деп аталатын процесте жұмыс жылуды температурасы төменірек денеден температурасы жоғарырақ денеге тасымалдауға жұмсалады. Дөңгелек процесс тепе-тең (дәлірегі, квази тепе-тең) дөңгелек процесс және тепе-тең емес дөңгелек процесс болып ажыратылады. Тепе-тең дөңгелек процессте бірте-бірте өтетін жүйе күйі тепе-тең күйге жуық болып келеді, ал тепе-тең емес дөңгелек процессте дөңгелек процесстің кем дегенде бір учаскесі тепе-тең емес күйде болады. Әр түрлі тепе-тең дөңгелек процессті есептеулер алғашқы тарихи термодинамикалық зерттеулер тәсіліне жатады. Мұндай зерттеулердің негізінде идеал жылу машинасының жұмыстық циклі (Карно циклі) талданды, термодинамиканың екінші бастамасының математика өрнегі табылды, термодинамикалық температура шкаласы құрылды, сондай-ақ, көптеген маңызды термодинамикалық қатыстар (Клапейрон-Клаузиус теңдеуі, т.б.) алынды. Техникада дөңгелек процесс іштен жанатын қозғалтқыштардың, әр түрлі жылулық күш және салқындатқыш қондырғылардың жұмыстық циклдері ретінде қолданылады.
Дөңгелек процесс немесе цикл деп жүйе бірнеше күйден өтіп барып бастапқы күйге қайта оралу процесін айтады. Циклдің диаграммасы тұйық қисық. Идеал газдың циклін 2 процеске бөлуге болады.
1. Газдың ұлғаюы (1-2);
2. Газдың сығылуы (2-1).
Газ ұлғайған кезде жасалған жұмыс оң dV >0, яғни жұмыс 1а2V2 V11 фигураның ауданына тең болады, ал сығылу жұмысы теріс dV<0 болады да, 2в1V1V22 фигураның ауданымен анықталады. Демек, цикл ішінде газдың жасаған жұмысы тұйық қисықтың ауданымен анықталады.
Тура цикл. Егер цикл ішінде оң жұмыс жасалса A = >0, онда цикл сағат тілімен бағыттас жүреді, тура цикл деп аталады (сурет 1). Ал егер цикл ішінде жасалатын жұмыс теріс A = <0 болса, цикл сағат тіліне қарсы бағытта болады да, кері цикл деп аталады.
Кері цикл. Тура цикл жылу двигательдерінде қолданылады. Жылу двигательдері деп жұмысты сырттан алынған жылу арқылы периодты түрде жасайтын двигательдерді айтады. Кері цикл салқындатқыш машиналарда қолданылады. Салқындатқыш машиналар деп сыртқы күштердің жұмысы арқылы жылу температурасы төмен денеден жоғары денеге берілетін машиналарды айтады.
Дөңгелектік процесс нәтижесінде жүйе бастапқы күйіне қайта оралады, яғни ішкі энергияның толық өзгерісі нульге тең. Дөңгелек процесс үшін термодинамиканың 1 заңын жазайық:
Q = ΔU + А, ΔU = 0, бұдан Q = А,
Демек цикл ішінде жасалған жұмыс сырттан берілген жылуға тең. Бірақ цикл нәтижесінде жүйе жылуды алуы да, беруі де мүмкін, сондықтан
Q = Q1 - Q2,
Q1 - жүйенің алған жылу мөлшері,
Q2 - жүйенің берген жылу мөлшері.
44 Термодинамиканың 2-ші бастамасы және оның маңызы.
Термодинамиканың екінші заңы — атом, молекулала секілді статистикалық нысандардың, үлкен санынан тұратын жүйелердің өз бетінше ықтималдығы аздау күйден ықтималдығы молырақ күйге ауысу процесін сипаттайтын табиғаттың түбегейлі заңы.
Термодинамиканың екінші бастамасы жылу машиналарының жұмыс істеу прициптерін байқаудан қалыптасты. Сондықтан жылу машинасының схемасын қарастырайық(6-сурет).

5-сурет. 6-сурет.
Сонда температурасы жоғары Т1 жылу көзінен бур циклде алынатын Q 1 жылу мөлшері жұмыстық денег беріліп, А жұмыс өндіреді. Ал жылу мөлшерінің бір бөлігі Q 1 суытқышқа беріліп отырады: Q 2= Q 1- A . Сөйтіп жылу двигателінде өндірілген жұмыс: A = Q 1- Q 2. Практикалық тұрғыдан қарағанда өндірілген А жұмыс қыздырғыштан алынған Q 1 жылу мөлшерінің қандай бөлігі екенінің үлкен маңызы бар.
Жылу машинасының термиялық п.ә.к. η=I болуы үшін Q 2=0 шарты орындалуы керек, яғни берілген жылу мөлшерінің көп бөлігі жұмысқа айналса, машинаның соғурлым тиімді болатыны анық. Сөйтіп, жылу машинас тек қыздырғыштан алынған жылу мөлшері арқылы жұмыс өндірер еді, бүл мүмкін емес. Француз инженері С.Карно 1824 жылы жылу машинасының жұмыс істеуі үшін міндетті түрде температурасы әр түрллі екі жылу көзі болуы керек екенін дәлелдеді.
45 Карно циклі және оның пайдалы әсер коэффициенті. Карно теоремалары.
Карно машинасындағы жұмыс атқарушы дене, өз күйiнiң өзгеру циклiн периодты түрде қайталап тұратын, идеалды газ болып табылады. Бұл цикл Карно циклi болып табылады, осыған ұқсас процесстер айналмалы немесе циклдық процесстер деп аталады. Карно машинасында үйкелiске және қоршаған ортамен жылу алмасуға кеткен энергиялардың шығындары ескерiлмейдi, сондықтан бұл машинаны Карноның идеалды жылу машинасы деп атайды.Карноның қайтымды циклының ПӘК:
η к =(T1–T2)/T1
Бірінші теоремасы- жылулық қозғалтқыштың пайдалы әсер коэффициенті туралы теорема.мұндағы T1 – қыздырғыштың температурасы, T2 – суытқыштың температурасы. жұмыстық дененің табиғатына және жылулық қозғалтқыштың құралымына тәуелді болмайды, ол тек қыздырғыш (T1) пен суытқыштың (T2) температураларымен ғана анықталады.
Екінші теоремасы- соққы теориясында – абсолют серпімсіз соққы кезіндегі кинетикалық энергияның кемуі жайлы теорема.Соққы кезіндегі жүйенің кинетикалық энергиясының кемуі, жүйе нүктелерінің кеміген жылдамдықпен қозғалған кезіндегі кинетикалық энергиясына тең.
Келтірілген жылу. Клаузиус теоремасы.
Берілген жылу мөлшерінің қыздырғыш не суытқыш температурасына қатынасы келтірілген жылу деп аталады. Карно циклында газдың изотрмиялық ұлғаюы және сығылуы кезіндегі келтірілген жылулары бірдей болады.
Клаузиус теоремасы жылуды сыртқы резервуарлармен алмасатын және термодинамикалық циклден өтетін термодинамикалық жүйе үшін (мысалы, жылу қозғалтқышы немесе жылу сорғысы)
Берілген жылу мөлшерінің қыздырғыш не суытқыш температурасына қатынасы келтірілген жылу д.а. Карно циклында газдың изотрмиялық ұлғаюы және сығылуы кезіндегі келтірілген жылулары бірдей болады.
 1an1 жолымен жүретін тепе тен цикл қарастырайық. Тура а және кері б өтудің сызықтарын қиятындай шексіз жақын орналасқан адиабата сызайық. Әрбір кесіндінің ортасынан изотерма өткізейік. Онда а және б сызықтарының әрқайсысын шексіз жақын изотермалардан тұрады деп, және оларды жұм. зат Тa1 ,Ta2 ,...., температуралары бір бірқатар қыздырғыштардан d'Qa1, d'Qa2, .... жылу алады және Тб1 ,Tб2 ,.... температуралары бір бірқатар С-тарға d'Qб1, d'Qб2, .... жылу береді деп есептейміз. Осындай әрбір циклға келтірілген жылулардың теңдігі туралы мына формуланы қолданайық.
1an1 жолымен жүретін тепе тен цикл қарастырайық. Тура а және кері б өтудің сызықтарын қиятындай шексіз жақын орналасқан адиабата сызайық. Әрбір кесіндінің ортасынан изотерма өткізейік. Онда а және б сызықтарының әрқайсысын шексіз жақын изотермалардан тұрады деп, және оларды жұм. зат Тa1 ,Ta2 ,...., температуралары бір бірқатар қыздырғыштардан d'Qa1, d'Qa2, .... жылу алады және Тб1 ,Tб2 ,.... температуралары бір бірқатар С-тарға d'Qб1, d'Qб2, .... жылу береді деп есептейміз. Осындай әрбір циклға келтірілген жылулардың теңдігі туралы мына формуланы қолданайық.
 ;
; 
Алынған өрнектерді қосайық:

Келтірілген жылулардың қосындысы өту жолына байланыссыз-Клаузиус теоремасы.
Клаузиус теңдігі.

Энтропия.
Энтропия (грек. еntropіa – бұрылыс, айналу) – тұйық термодинамикалық жүйедегі өздігінен жүретін процестің өту бағытын сипаттайтын күй функциясы. Энтропияның күй функциясы екендігі термодинамиканың екінші бастамасында тұжырымдалады. Энтропия ұғымын термодинамикаға 1865 ж. Р.Клаузиус енгізген. Энтропия
термодинамикалық жүйенің сыртқы ортамен жылу алмасу және өздігінен өшетін процестердің өту бағытын сипаттайтын шама. ,  . Ішкі энергия сияқты Энтропия процестін жүріа өтетің жолына байланысты емес кез келген процесте бастапқы күйіне келетің болса, онда Энтропияның толық өзгеруі нөлге тең.
. Ішкі энергия сияқты Энтропия процестін жүріа өтетің жолына байланысты емес кез келген процесте бастапқы күйіне келетің болса, онда Энтропияның толық өзгеруі нөлге тең.  .
.
48 Энтропияның қасиеттері.
Қайтымсыз процесте онашаланған жүйенің энтропиясы артады және процестер Энтропия артатын жаққа бағытталады  .
.
Қайтымды процестердеонашаланған жүйенің энтропиясы  , өзгермейді S=const және изоинтропиялық процесд.а. Егер жүйе онашаланбай сыртқы ортаға жылу беретін болса, Энтропия азаяды.
, өзгермейді S=const және изоинтропиялық процесд.а. Егер жүйе онашаланбай сыртқы ортаға жылу беретін болса, Энтропия азаяды.
Энтропияжүйені құрайтын бөлшектердін бей берекетсіздігінің өлшемі.
Изотермиялық 
Изохоралық 
Изобаралық 
Адиабаталық  ,S=const
,S=const
49 Еркін энергия және энтальпия.
Физикада және физикалық химияда еркін энергия жұмысты орындау үшін қол жетімді термодинамикалық жүйенің ішкі энергиясының мөлшеріне жатады. Термодинамикалық еркін энергияның әр түрлі формалары бар: Гиббстің еркін энергиясы - тұрақты температура мен қысымда болатын жүйеде жұмысқа айналуы мүмкін энергия . Гиббстің еркін энергиясы үшін теңдеуі:G = H – TS онда G Gbbs еркін энергиясы, H - энтальпия, T - температура, S - энтропия. Энтальпия (гр. enthalpo – жылытамын, қыздырамын), жылулық функция, жылу мөлшері – термодинамикалық жүйе күйінің функциясы болып келетін жылуға қатысты шама. Бұл терминді алғаш Х.Камерлинг-Онненс енгізген. Энтальпия (H) жүйенің ішкі энергиясының (U) және жүйенің қысымы (p) мен көлемі көбейтіндісінің қосындысына тең: H=U+pV. Энтальпия Бірліктердің Халықаралық жүйесінде (СИ) джоульмен (Дж.) өрнектеледі.
Гельмгольцтің еркін энергиясы - тұрақты температура мен көлемде жұмысқа айналуы мүмкін энергия. Гельмгольцтің еркін энергиясы үшін теңдеуі: A = U – TS мұндағы A - Helmholtz еркін энергиясы, U - жүйенің ішкі энергиясы, T - абсолюттік температура (Kelvin) және S - жүйенің бойымыздағы ентропиясы.
Ландаудың еркін энергиясы бөлшектері мен энергиясын қоршаған ортаға айырбастауға болатын ашық жүйенің энергиясын сипаттайды. Ландаудың еркін энергиясы үшін теңдеуі: Ω = A - μN = U - TS – μN онда N - бөлшектердің саны және μ - химиялық потенциал.
50 Нақты газдардың идеал газ заңдарынан ауытқуы.
Бойл-Мариот және Гей-Люссак заңдарына бағынбайтын газдар . Газдардың мінсіз жағдайдан ауытқу мөлшері олардың тығыздығы артқан сайын ( қысым жоғары, температура төмен) өсе түседі, яғни газ тамшылары неғұрлым бір-біріне жақын орналасқан сайын, олардың бір-біріне әсері солғұрлым күшейе түседі.Идеал газ – бөлшектерінің өзара әсері ескерілмейтін газдың теориялық моделі. Ол классикалық идеал газ және кванттық идеал газ болып ажыратылады. Классикалық идеал газдың қасиеттері классикалық физика заңдарымен – Клапейрон теңдеуімен , сондай-ақ оның дербес түрлері Бойль–Мариотт заңы және Гей-Люссак заңымен сипатталады. Классикалық идеал газ бөлшектерінің энергиясы Больцман үлестірілуіне сәйкес болып үлестіріледі. Менделеев - Клапейрон теңдеуі:  Бойль–Мариотт: T=const pV=C C- берілген газ массасының грамм-молекула саны мен абсолют температураға пропорционал болатын тұрақты шама.
Бойль–Мариотт: T=const pV=C C- берілген газ массасының грамм-молекула саны мен абсолют температураға пропорционал болатын тұрақты шама.
Гей-Люссак заңы:  =
= 
51 Ван-дер-Ваальс теңдеуі.
Нақты газдардың күйін анықтайтын теңдеуді алу үшін голланд ғалымы Ван-дер-Ваальс Менделеев-Клапейрон теңдеуіне молекулаларды өлшемдерін және өзара әсерлесуін ескеретін түзету енгізді. Бұл алынған теңдеу нақты газдардың күй теңдеуі немесе Ван-дер-Ваальс теңдеуі деп аталады. Мөлшері 1 моль нақты газ үшін Ван-дер-Ваальс теңдеуі келесі түрде жазылады:
 мұндағы: а, в -Ван-дер-Ваальс тұрақтылары, өлшем бірліктері
мұндағы: а, в -Ван-дер-Ваальс тұрақтылары, өлшем бірліктері

52 Молекулалардың эффективті диаметры.
Молекулалардың эффективті диаметрі дегеніміз олардың соқтығысуы кезінде екі молекуланың центрлерінің ең аз жақындау қашықтығы. Газ молекулаларының  эффективті диаметрі
эффективті диаметрі  еркін жүру жолының орташа ұзындығымен байланысы мына қатынаспен анықталады
еркін жүру жолының орташа ұзындығымен байланысы мына қатынаспен анықталады

мұндағы  - газдың бірлік көлеміндегі молекулалар саны. Ауа молекулаларының
- газдың бірлік көлеміндегі молекулалар саны. Ауа молекулаларының  эффективті диаметрін жоғарыдағы формуласына
эффективті диаметрін жоғарыдағы формуласына  -нің төмендегі өрнегін қойып, табуға болады
-нің төмендегі өрнегін қойып, табуға болады  , мұндағы
, мұндағы  - қалыпты жағдайдағы бірлік көлемдегі молекулалар саны (Лошмид тұрақтысы
- қалыпты жағдайдағы бірлік көлемдегі молекулалар саны (Лошмид тұрақтысы  ).
).
Молекулаларының  эффективті диаметрі үшін соңғы өрнек мына түрде болады
эффективті диаметрі үшін соңғы өрнек мына түрде болады
 ,
,
53 Заттардың кризистік күйі.
Кризистік күй – екі фазалы жүйенің физикалық қасиеттері бірдей болып, олардың арасындағы фазалар айырмашылығы түгелдей жойылатын тепе-теңдіктің шекті күйі. Күй диаграммасында фазалардың тепе-теңдік қисығында шекті нүктелер – кризистік нүктелер сәйкес келеді. Гиббстің фазалық ережесі бойынша, кризистік нүкте таза заттың екі фазасының тепе-теңдігі кезінде оқшауланған, ал екі құраушысы бар ерітінділерде ол нүктелер кризистік қисық құрайды. Жүйенің сәйкес параметрлері – кризистік қысым (Рк), кризистік көлем (Vк), кризистік концентрация (Хк), т.б. деп аталады. Сондай-ақ, фазалық ауысу жылуы мен фазааралық беттік керілуі азаяды және кризистік нүктеде нөлге айналады. заттардың кризистік қасиеттеріне кризистік температура (Ткр), кризистік қысым (Ркр) және кризистік молдік көлем (Vmкр) жатады.
Кризистік температура (Ткр) – бұл заттардың сұйық және газ тәрізді күйі арасындағы айырмашылық жоғалатын, яғни сұйықтық бумен тепе-тең күйде болуы мүмкін ең жоғары температура. Кризистік температурада зат заттың екі әртүрлі фазалары барлық қасиеттері жағынан мәндес болып келетін кризистік күйге өтеді. Кризистік температурадан жоғары жағдайда газ немесе түзілген бу ешқандай қысым әсерінен сұйылтыла алмайды.
Кризистік қысым (Ркр) – кризистік температурадағы химиялық заттардың қаныққан буларының қысымы.
Кризистік молдік көлем (Vmкр) – кризистік температура мен қысымда зат иеленетін молдік меншікті көлем, см3/моль.Бір компонентті жүйе (таза зат( жағдайында кризистік күй тек «сұйық – бу» тепе-теңдігі үшін мүмкін. Таза зат кризистік күйде үш кризистік параметрлермен сипатталады: кризистік температура (Ткр), кризистік қысым (Ркр) және кризистік молдік көлем (Vmкр). Мысалы, су үшін Ткр = 647,3К, Ркр = 22,13 МПа, Vmкр = 54,88 см3/моль. Екі компонентті жүйеде кризистік күй төрт параметрлермен сипатталады: температура, қысым, молдік немесе меншікті көлем және молдік немесе массалық үлес.
Кризистік көлем (Vmкр) – кризистік температура мен қысымда зат иеленетін меншікті көлем:  .мұндағы Vкр – кризистік көлем, см3/г; Vmкр – кризистік температура мен қысымда зат иеленетін молдік меншікті көлем, см3/моль; М – заттың молекулалық массасы, г/моль.
.мұндағы Vкр – кризистік көлем, см3/г; Vmкр – кризистік температура мен қысымда зат иеленетін молдік меншікті көлем, см3/моль; М – заттың молекулалық массасы, г/моль.
Жуықталған параметрлерді келесі түрде есептейді:

 ;
;  мұндағы Тпр, Рпр, Vпр – тиісінше заттың жуықталған температурасы, қысымы және көлемі; Ткр, Ркр, Vкр – тиісінше заттың кризистік температурасы, қысымы және көлемі; Т, Р, V – тиісінше заттың температурасы, қысымы және көлемі.
мұндағы Тпр, Рпр, Vпр – тиісінше заттың жуықталған температурасы, қысымы және көлемі; Ткр, Ркр, Vкр – тиісінше заттың кризистік температурасы, қысымы және көлемі; Т, Р, V – тиісінше заттың температурасы, қысымы және көлемі.
54 Джоуль-Томсон құбылысы.
Нақты газдың ішкі энергиясы оны құрайтын молекулалар қозғалысының кинетикалық энергиясымен олардың өзара әсерлесуінің потенциалдық энергиясының қосындысы болып табылады: U = Eк + Eп Молекулалардың өзара әсерлесуінің Eп потенциалдық энергиясы олардың арақашықтығына тәуелді, сондықтан Eп көлемге тәуелді болуға тиісті. Сыртқы ортаменен энергияның алмасуы болмаса, көлемі өзгергенде газдың ішкі энергия U тұрақты болып қалады. Олай болса D Eп = - D Eк яғни, нақты газдың көлемі өзгергенде потенциалдық энергияның өзгерісі салдарынан молекулалар қозғалысының кинетикалық энергиясыда өзгереді. Eк = CVT теңдігі нақты газ үшінде орындалады, себебі CV оның молекулалар қозғалысының кинетикалық энергиясымен ғана анықталады. Сонда D Eп = - СV × D T Сыртқы денелермен жұмыс атқарылмаса және олармен жылу алмасуы болмаса, көлемі өзгергенде нақты газдың температурасыда өзгереді. Тек нақты газдарда болатын бұл құбылысты Джоуль-Томсон эффектісі дейді. Егер ұлғаю кезінде газдың температурасы төмендесе, ДжоульТомсон эффектісін оң дейді, ал егер газдың температурасы жоғарласа – теріс боладык
55 Кристалл және аморф денелер.
Физикада қатты дене деп тек кристалл денелерді айтады. Аморфты денелердің сырт қарағанда көлемін және пішінін сақтауы оларды қатты дене етіп көрсеткенімен, бұл денелер өте тұтқыр сұйық деп қарастырылады. Температура жоғарылаған сайын олардың сұйыққа тән қасиеттері бірден көріне бастайды, бірте-бірте еріп, сүйықтың барлық қасиеттеріне ие болады.
Аморфты денелер – изотропты. Кристалдың қасиеттері әр түрлі бағыттарда түрліше болады. Кристалдар – анизотропты.
Аморфты денелер. Атомдарының ретті орналасуы алыс қашықтықтарда да қайталанып отыруымен сипатталатын кристалдық денелерден аморфты денелердің айырмашылығы, мұнда тек жуық тәртіп қана орын алады. Кейбір заттар кристалл және аморфтық түрде де бола алады.
Кристалдар. Өзінің формасын да, көлемін де сақтайтын затты қатты дене деп атайтынымыз белгілі. Бірақ бұлар заттың қатты күйін тек сыртқы түріне қарап қана сипаттайды. Физикалық тұрғыдан алғанда біз бұл белгілеріне қарап қатты күйді сұйық күйден айыра аламыз.
Кристалдардың ішкі құрылымсын рентген сәулелерінің көмегімен зерттеулер олардағы бөлшектердің (молекулалар, атомдар және иондардың) дұрыс орналасатынын көрсетті, яғни олар кристалдық (кеңістіктік) тор түзейді. Кристалдық тордағы қатты дененің бөлшектерінің ең орнықты тепе-теңдік қалпына сәйкес нүктелері тордың түйіндері деп аталады.
56 Кристалдардың құрылымы.
Өзінің формасын да, көлемін де сақтайтын затты қатты дене деп атайтынымыз белгілі. Бірақ бұлар заттың қатты күйін тек сыртқы түріне қарап қана сипаттайды. Физикалық тұрғыдан алғанда біз бұл белгілеріне қарап қатты күйді сұйық күйден айыра алмаймыз.
Қатты денелерді зерттеген кезде табиғатта олардың белгілі бұрыштармен орналасқан жазық беттерінің болатыны, кей жағдайларда олардың дұрыс көпбұрыштар түрінде кездесетіні белгілі. Мұндай қатты денелерді монокристалдар деп атайды.Көпшілігінде монокристалдардың мөлшерлері өте кішкентай, әйтсе де олардың арасында үлкендері де бар,мысалы тау хрусталының кейбір монокристалының өлшемі адам бойымен теңеседі.
Кристалдардың ішкі құрылысын рентген сәулелерінің көмегімен зерттеулер олардағы бөлшектердің(молекулалар, атомдар және иондардың) дұрыс орналасатынын көрсетті, яғни олар кристалдық (кеңістіктік) тор түзеді. Кристалдық тордағы қатты дененің бөлшектерінің ең орнықты тепе-теңдік қалпына сәйкес нүктелері тордың түйіндері деп аталады.
Тордың түйіндері дұрыс орналасып, кристалл ішінде периодты түрде қайталанып отырады.Бөлшектердің кристалдық тор түйіндерінде дұрыс орналасуы алыс реттілік деп аталады.
Физикада қатты денелер деп кристалдық құрылымы бар денелер ғана аталады.Басқаша айтқанда, қатты дене бөлшектерінің орналасуында алыс реттілік болу керек.
Кеңістіктік тор. Кристалдағы бөлшектердің дұрыс орналасуынан кристалдардың кейбір қасиеттерінің бағытқа тәуелділігі, яғни анизотропиясы шығады.
Анизотропия қасиетәнәі тек монокристалдарға ғана тән болатынын тағы да айта кетейік. Қатты денелердің көпшілігінің құрылымы поликристалды (грек. поли-көп), яғни микроскоппен ғана көруге болатын өте ұсақ кристалдардың жиынтығынан тұрады. Бұл шағын кристалдардың бір-біріне қатысты хаосты орналасуынан қатты дене тұтастай алғанда изотропты, яғни жеке шағын кристалдардың анизотропиясы болса да, дененің барлық бағыттардағы қасиеттері бірдей. Аморфты денелер де изотропты, себебі олардың кеңістік торы жоқ. Поликристалды денелер мен аморфты денелердің айырмашылығы мынада: поликристалдық дененің анизотропия байқалатын өте кішкентай бөлігін бөліп алуға болады, ал аморфты денелердің кез келген бөлігін қарастырсақ та, ол әрқашан изотропты.
Кристалдық құрылымдардың түрлері.Кристалдардың әр түрлі типтерін және түйіндердің кристалдық торда орналасу мүмкіндіктерін кристаллография зерттейді.Физикада кристалдық құрылымдарды геометриялық тұрғыдан емес, кристалдағы бөлшектер арасындағы өзара әрекеттесу күштерінің сипаты, яғни бөлшектер арасындағы байланыстардың түрлері бойынша қарастырады.Кристалл торының түйіндерінде орналасқан бөлшектер арасында әрекет ететін күштердің сипаты бойынша кристалдық құрылымдарды төрт түрге бөледі: иондық, атомдық, молекулалық және металдық.
57 Кристалдық тордың түрлері.
Кристалдық тордың түйіндері дегеніміз, кристалдық торды құратын атомдар, молекулалар не иондар. Мысалы жоғарыдағы ас тұзының түйіндері натрий және хлор иондары болады. Кристалдық тордың түйіндеріне байланысты, кристалдық торлар - иондық, металдық, атомдық және молекулалық деп төртке бөлінеді.
Иондық кристалдық құрылым тор түйіндерінде оң және теріс зарядталған иондардың болуымен сипатталады. Иондар арасындағы электрлік тартылыс және тебілу күштері оларды тордың түйіндерінде ұстап тұр.
Иондық торда зарядтары әр түрлі иондар бір-біріне аттас зарядталған иондарға қарағанда жақынырақ орналасуынан, әраттас зарядталған иондар арасындағы тартылыс күші аттас иондардың арасындағы тебілу күштерінен артық. Иондық кристалдардың біршама беріктігі осымен түсіндіріледі.
Иондық кристалдық торы бар заттар балқыған кезде тордың түйіндеріндегі иондар ерітіндіге өтеді де ток тасымалдаушыларына айналады. Сондықтан мұндай ерітінділер жақсы ток өткізгіштер болып табылады.
Тор түйіндерінде бейтарап атомдардың болуымен сипатталатын құрылым, атомдық кристалдық құрылым деп аталады. Олар коваленттік байланысқан. Коваленттік байланыс деп іргелес орналасқан екі атомның өзара екі валенттік электрондар алмасуы кезінде туатын тартылыс күшінің салдарынан пайда болатын байланысты атайды. Әр атомнан бір-бірден алынған екі валенттік электрондар енді бір мезгілде екі атомға да тәуелді. Бұл электрондар атомдар арасында жүріп байланыстыру арқылы оларды молекулаға айналдырады.
Молекулалық кристалдық құрылым кеңістік торының түйіндерінде де заттың бейтарап молекулаларының орналасуымен ерекшеленеді. Түйіндерде оларды молекулааралық күштер ұстап тұрады. Молекулааралық өзара әрекеттесу әлсіз, сондықтан молекулалық торы бар қатты өаттар оңай қирайды және балқу температурасы төмен. Молекулалық кеңістіктік торы бар заттарға мұз, нафталин, қатты азот және органикалық қосылыстардың көпшілігі жатады.
Металдың кристалдық торының түйіндерінде оң зарядталған металл иондары бар. Барлық металдар атомдарының валенттік электрондары, яғни атом ядросынан ең алыс орналасқан электрондар атомдармен нашар байланысқан. Олар атомдарын тастап, кристалл торының бойында хаосты қозғалады, оларды жеке атомдар иемденбейді. Мұндай электрондар атомдар арасында емін-еркін қозғалып жүре алады.
58 Кристалдардың механикалық қасиетттері.
Кристалды дене болып табылады одой бірі түрлі минералдар.
Кристалды деп атайды қатты дененің физикалық қасиеттері бірдей емес әр түрлі бағыттары, бірақ ұқсас параллель бағытта.
Отбасы кристалдық тел тұрады екі топ — монокристалдар мен поликристаллов. Алғашқы кейде ие геометриялық дұрыс сыртқы түрі, ал екінші, өзбектерде аморфным телам жоқ, тән осы зат белгілі бір нысандары. Бірақ айырмашылығы аморфных тел құрылымы поликристаллов біркелкі емес, зерниста. Олар жиынтығы болып табылады сросшихся бір-бірімен хаотически бағдарланған кішкентай кристалдар — кристаллитов. Поликристаллическую құрылымын шойын, мысалы, анықтауға болады, егер қарауға үлкейткіш көмегімен үлгісі на изломе.
Көлемі бойынша кристалдар әр түрлі болады. Олардың көпшілігі көруге болады тек микроскоп. Алайда, үлкен кристалдар салмағы бірнеше тонна.
Кристалдардың құрылысы
Алуан кристалдардың нысан бойынша өте көп. Кристалдар болуы мүмкін төрт дейін) бірнеше жүздеген қырлары. Бірақ бұл ретте олар ие тамаша қасиеті — қандай болмасын, мөлшері, пішіні және саны қырлы бір кристалл, барлық жазық қырлары түйісетін бір-бірімен белгілі бір бұрыштары. Бұрыштары арасындағы оны қайдан сатып гранями әрқашан бірдей. Кристалдар тас тұздары, мысалы, болуы мүмкін нысаны куба, параллелепипед, призма немесе дененің неғұрлым күрделі нысандағы, бірақ әрқашан олардың қырлары түйісетін астында бұрыштармен. Грани кварц бар нысанын дұрыс емес шестиугольников, бірақ бұрыштары арасындағы гранями әрқашан бірдей — 120°.
59 Кристалдардың жылулық қасиеттері.
Кристалдар деп құрамына енетін бөлшектер, атомдар, иондар, молекулалар заңды түрде орналасқан көп жақты қатты денелерді атайды. Кристалл– «кристаллос» деген грек сөзінен алынған, ол суықта қатып қалған «мөлдір дене» деген ұғым береді. Ертедегі гректер осылайша мұз бен мөлдіртасты атаған. Уақыт өткен сайын кристалл деп табиғатта пайда болған немесе лабораториялық жолмен алынған көп жақты қатты денелерді атайтын болды. Табиғи кристалдарға басқа көп қырлы заттарға тәріздес шектелу элементтері тән. Оларға: жақтар, қабырғалар және бұрыштар жатады. Жақтар – көп жақты кристалдарды шектейтін жазықтықтар, қабырғалар – сол жақтардың қиылысу сызықтары. Екі қиылысқан жазықтық екі жақты бұрыш түзейді. Қырлардың қиылысу нүктесі – төбе. Кристалдардың шектелу элементтері бір-бірімен «Эйлер» формуласына сәйкес келетін заңдылықпен байланысты: h + e = r + 2; мұндағы h – кристалдағы жақтар саны, r – қырлар саны, ал е – төбелер саны. Кристалдардың мысалы деп табиғи минералдардың кристалдарын келтіруге болады: алты жақты ас тұздың (галиттің) және пириттің текшесі, кварцтың гексагондық призмасы, магнетиттің сегіз жақты октаэдрі, он екі жақты анартастың ромбододекаэдрі және пириттің пентагондодекаэдрі
60 Тасымалдау құбылыстарының молекула-кинетикалық теориясы.
Дене құрылымының молекулалық кинетикалық теориясы деп барлық денелер жеке бейберекет қозғалыстағы бөлшектерден тұрады деген көзқарас негiзiнде макроскоптық денелердiң қасиеттерi мен жылу процестерiне түсiнiк беретiн iлiмдi айтады.
Молекулалық-кинетикалық теория (МКТ) негiзi мынадай үш қасиеттен тұрады:
1. барлық денелер бөлшектерден – атомдардан, молекулалардан, оң және терiс зарядталған иондардан – тұрады;
2. бұл бөлшектер барлық уақытта үздiксiз және бейберекет қозғалыста болады;
3. бөлшектер арасында өзара әсерлесу күштерi – тартылу және тебiлу күштерi бар. Ол күштер электрлiк сипатқа ие. Бөлшектердiң өзара гравитациялық әсерлесуi өте аз.
Термодинамикалық тепе-тең емес жүйелерде ерекше қайтымсыз процестер пайда болады. Бұл процестердің нәтижесінде массаның, импульстің және энергияның кеңістіктік таралуы жүреді. Тасымалдау құбылыстарына: диффузия (массаның тасымалдануы), ішкі үйкеліс (импульстің тасымалдануы) және жылуөткізгіштік (энергияның тасымалдануы) жатады. Тасымалдаудың жалпы теңдеуі идеал газдың молекула-кинетикалық теориясы негізінде қорытылып шығады.Х осі тасымалдау бағытында бағытталатындай етіп санақ жүйесін таңдаймыз.Онда  , мұндағы
, мұндағы  - тасымалданатын физикалықсипаттама.
- тасымалданатын физикалықсипаттама.  -
-  ауданарқылы
ауданарқылы  уақытта
уақытта  бағытында молекулалартасымалдаған физикалық сипаттаманыңмөлшері.
бағытында молекулалартасымалдаған физикалық сипаттаманыңмөлшері.  қатынасы
қатынасы  физикалық шаманың градиенеті деп аталады және физикалық шаманың ең үлкен арту бағытындағы оныңөзгеру шапшандығын сипаттайды.
физикалық шаманың градиенеті деп аталады және физикалық шаманың ең үлкен арту бағытындағы оныңөзгеру шапшандығын сипаттайды.
Дата добавления: 2021-01-20; просмотров: 409; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
