Типы связей по способу перекрывания орбиталей
Примерное время выполнения задания – 2 - 3 минуты
Уровень сложности задания – базовый
Максимальный балл за выполнение задания - 1
Задание включает формулировку и перечень формул или названий веществ, из которых необходимо выбрать два, отвечающие заданному вопросу. В ответе надо записать получившуюся последовательность цифр.
| Перед выполнением предложенных заданий повторите: |
Органическая химия — раздел химии, изучающий соединения углерода, а также их строения, свойства, взаимопревращения.
 На данный момент известно около 30-ти миллионов органических веществ и это количество продолжает расти. Огромное количество соединений связано со специфическими свойствами углерода. Во - первых, атомы данного элемента способны соединяться друг с другом в цепи произвольной длины. Это соединение может быть не только последовательным, но и разветвленным, циклическим. Между атомами углерода возникают разные связи: одинарные, двойные и тройные. Во - вторых, валентность углерода в органических соединениях равна IV. Это значит, что во всех органических соединениях, атомы углерода находятся в возбужденном состоянии, имея 4 неспаренных электрона, активно ищущих свою пару. Поэтому атомы углерода имеют возможность образовывать 4 связи с атомами других элементов. К таким элементам относятся: водород, кислород, азот, фосфор, сера, галоген. Из названных, наиболее часто углерод связывается с водородом, кислородом и азотом.
На данный момент известно около 30-ти миллионов органических веществ и это количество продолжает расти. Огромное количество соединений связано со специфическими свойствами углерода. Во - первых, атомы данного элемента способны соединяться друг с другом в цепи произвольной длины. Это соединение может быть не только последовательным, но и разветвленным, циклическим. Между атомами углерода возникают разные связи: одинарные, двойные и тройные. Во - вторых, валентность углерода в органических соединениях равна IV. Это значит, что во всех органических соединениях, атомы углерода находятся в возбужденном состоянии, имея 4 неспаренных электрона, активно ищущих свою пару. Поэтому атомы углерода имеют возможность образовывать 4 связи с атомами других элементов. К таким элементам относятся: водород, кислород, азот, фосфор, сера, галоген. Из названных, наиболее часто углерод связывается с водородом, кислородом и азотом.
|
|
|
Теория строения органических соединений
1. Атомы молекул органических веществ сплетены друг с другом в последовательности, соответствующей их валентности. Так, как атом углерода четырехвалентен, он образует цепи различного химического строения.
2. Последовательность соединения атомов молекул органических веществ определяет характер их физических и химических свойств.
3. Изменение последовательности соединения атомов ведет и к изменению свойств вещества.
4. Атомы молекул органических веществ влияют друг на друга, что сказывается на изменении их химического поведения.
Таким образом, зная строение молекулы органического вещества можно спрогнозировать его свойства и наоборот, знание свойств вещества поможет установить его строение.
Гомология и изомерия
Гомологи - это вещества, схожие по строению и химическим свойствам, но различные по составу.
Изомеры - это вещества, схожие по количественному и качественному составу, но различные по строению и химическим свойствам.
Гомологи отличаются по составу на одну или несколько групп CH2. Эта разница называется гомологической. Существуют гомологичные ряды алканов, алкенов, алкинов, аренов.
|
|
|
Рассмотрим типы изомерии:
Структурная изомерия
1.1. Изомерия углеродного скелета:

1.2. Изомерия положения:
1.2.1. Изомерия кратной связи

1.2.2. Изомерия заместителей

1.2.3. Изомерия функциональных групп

1.3. Межклассовая изомерия:

Пространственная изомерия
Это такое химическое явление, при котором разные вещества, имеющие одинаковый порядок присоединения атомов друг к другу, отличаются фиксировано-различным положением атомов или групп атомов в пространстве. Данный вид изомерии бывает геометрическим и оптическим.
2.1. Геометрическая изомерия. Если в молекуле какого-либо химического соединения присутствует двойная C=C связь или цикл, то в данных случаях возможна геометрическая или цис - транс - изомерия.


В случае, когда одинаковые заместители располагаются по одну сторону плоскости, можно сказать, что это цис-изомер. Когда заместители располагаются по разные стороны — то это транс-изомер. Данный тип изомерии невозможен в случае, когда хотя бы у одного атома углерода при двойной связи имеются два одинаковых заместителя. Например, цис-транс-изомерия является невозможной для пропена.
|
|
|
2.2. Оптическая изомерия. Вы знаете, что возможно соединение атома углерода с четырьмя атомами/группами атомов.

В подобных случаях образуется оптическая изомерия, два соединения - антипода, как левая и правая рука человека:

Типы связей по способу перекрывания орбиталей
Каждая группа орбиталей обладает различной формой. К примеру, s-орбитали имеют сферическую форму, а p - орбитали - гантелеобразную.
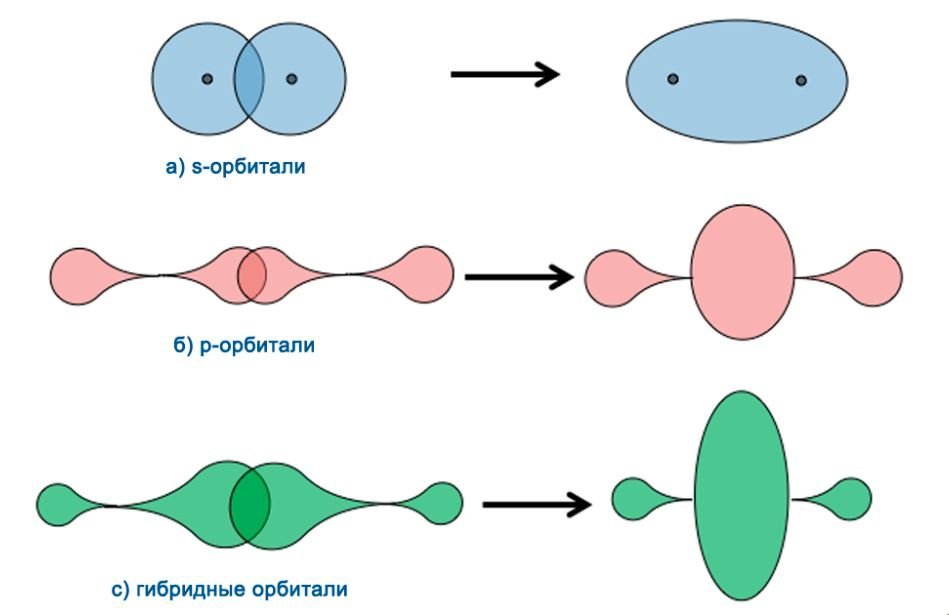
Исходя из данных форм, связи так же способны различаться друг от друга по способу перекрывания электронных орбиталей:
· σ-связи (сигма-связи) – данный тип связи возникает при перекрывании орбиталей. Перекрывание проходит таким образом, что область их перекрывания пересекается линией. Данная линия соединяет ядра.

· π-связи (пи-связи) – данный тип связи возникает вследствие перекрывания орбиталей. Перекрывание происходит над и под линией соединяющей ядра атомов.

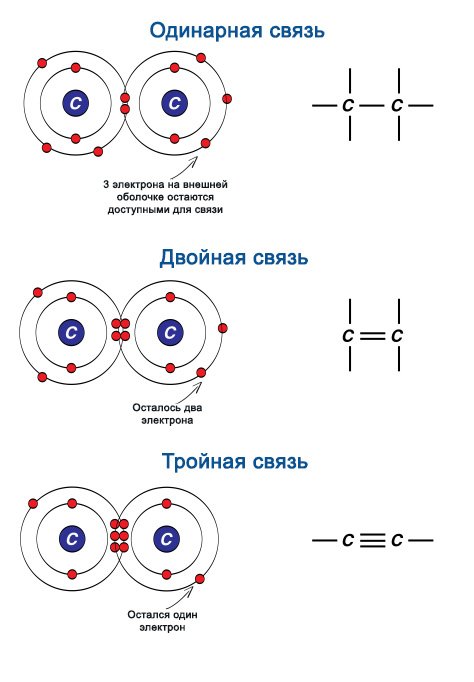
В случае ковалентного типа связи, σ-связь между двумя атомами будет содержаться всегда. При этом, π-связь будет только в случае кратных (двойных, тройных) связей.
Так же, при этом будет:
Одинарная связь. Данная связь является σ-связью.
Двойная связь. Такая связь состоит из одной σ- и одной π-связи.
|
|
|
Тройная связь. Данная связь образована одной σ- и двумя π-связями.

Дата добавления: 2021-01-20; просмотров: 109; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
