Количественные характеристики адсорбции
Особенности физической адсорбции
1.Обратимость. Процесс физической адсорбции обратим. Частицы в адсорбционных слоях не закреплены жестко. Тепловое движение адсорбированных частиц проявляется в виде колебательных движений, благодаря которым частицы то приближаются к поверхности адсорбента, то удаляются от нее. Некоторые из них могут выходить за пределы действия сил притяжения адсорбента и удаляться от поверхности. В таком случае наблюдается процесс, обратный адсорбции, – десорбция, т.е. отрыв молекул или ионов адсорбированных веществ от поверхности адсорбента и уход их в окружающее пространство.
Со временем система приходит в состояние адсорбционного равновесия:
 Адсорбция Десорбция,
Адсорбция Десорбция,
при котором среднее число частиц, покидающих поверхностный слой, становится равным среднему числу адсорбируемых частиц за тот же отрезок времени. При десорбции с поверхности адсорбента уходят молекулы адсорбтива в неизменном виде.
2. Малая специфичность. На полярных адсорбентах (силикагель, оксид алюминия и др.) адсорбируются полярные вещества, на неполярных адсорбентах (уголь) – неполярные. Так, например, активированный уголь хорошо поглощает неполярные молекулы хлора, но не адсорбирует полярные молекулы оксида углерода (II) – угарный газ. Поэтому нельзя пользоваться фильтрующими противогазами при тушении пожаров, так как в зоне пожара много оксида углерода (II).
|
|
|
3. Незначительная теплота адсорбции. Процесс физической адсорбции экзотермичен, но теплота, которая выделяется при адсорбции, незначительна и соизмерима с теплотой конденсации (8 – 40 кДж/моль).
1. Уменьшение величины адсорбции с повышением температуры. Это связано с увеличением скорости десорбции.
Процесс физической адсорбции и десорбции наглядно иллюстрируется следующим опытом. (Демонстрация опыта). В стакане (800 – 1000 мл) находится раствор красителя метилового фиолетового сиреневого цвета. В раствор добавляют несколько граммов активированного угля и интенсивно перемешивают. С течением времени раствор обесцвечивается из-за происходящего на поверхности угля процесса адсорбции. Если отфильтровать уголь на фильтре, то получим практически чистую бесцветную воду. Процесс десорбции можно продемонстрировать следующим образом. Уголь на фильтре промывают малым количеством ацетона. Фильтрат сразу окрашивается в фиолетовый цвет из-за происходящего процесса десорбции. Десорбция происходит из-за хорошей растворимости красителя в ацетоне.
Химическая адсорбция (хемосорбция) происходит в результате протекания химической реакции между адсорбтивом и адсорбентом с образованием нового поверхностного соединения. Возникают новые химические связи – ковалентные или ионные. Примером хемосорбции является поглощение оксида углерода(IV) или оксида серы(IV) натронной известью - смесью твердых гидроксидов натрия и кальция NaOH и Ca(OH)2). При поглощении этих газов происходит химическая реакция:
|
|
|
NaOH + СО2 = NaНСO3
Са(ОН)2 + СО2 = СаСО3 + Н2О
Особенности химической адсорбции
1. Необратимость. Молекулы адсорбтива не могут уйти с поверхности в неизменном виде, поскольку на поверхности образовалось новое соединение, прочно связанное с адсорбентом.
2. Специфичность. Адсорбция происходит только в том случае, если возможно химическое взаимодействие между адсорбентом и адсорбтивом. Выше приведенный пример хемосорбции (с натронной известью), показывает, что этот адсорбент может адсорбировать только газы кислотного характера (H2S, HCl), а, например, молекулы аммиака NH3 адсорбироваться не будут.
3. Высокая теплота адсорбции. Процесс химической адсорбции также экзотермичен, величина теплоты адсорбции значительна и сопоставима с тепловым эффектом химической реакции (800 – 1000 кДж/моль).
4.Увеличение величины адсорбции с повышением температуры. Это связано с возрастанием скорости химической реакции при увеличении температуры.
|
|
|
Количественные характеристики адсорбции
Для количественного описания адсорбции применяют чаще всего две величины, обозначаемые какА и Г (гиббсова адсорбция).
Величину адсорбцииА обычно определяют как количество вещества в поверхностном слое, происходящее на единицу площади поверхности или единицу массы адсорбента (абсолютная величина адсорбции)
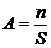 ; моль / м2
; моль / м2
где n – число моль адсорбтива в поверхностном слое;
S – площадь адсорбента.
Если площадь адсорбента неизвестна, то расчет величины адсорбции ведут не на площадь адсорбента, а на его массу:
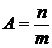 , моль / кг.
, моль / кг.
где m – масса адсорбента.
В некоторых случаях вместо количества вещества n рассчитывают массу адсорбтиваmа:
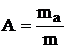 , кг/кг
, кг/кг
В этом случае размерность величины адсорбции кг/кг.
Величину адсорбции Г определяют как избыток компонента в поверхностном слое (на единицу площади поверхности) по сравнению с его количеством в равном объеме объемной фазы (избыточная адсорбция):
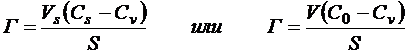
где Сv – равновесная концентрация компонента в объеме;
С0 – исходная концентрация компонента в объеме;
|
|
|
Сs - концентрация компонента в поверхностном слое;
Vs – объем поверхностного слоя толщиной h; h
V – общий объем фазы.
Сравнивая эти выражения, получим связь между величинами адсорбции А и Г: Г = А – Cvh.
При экспериментальном определении величину адсорбции обычно рассчитывают по разности исходных и равновесных концентраций адсорбата, т.е. определяют величину Г. При больших избытках, когда Сs>>Cv, равновесной концентрацией адсорбата можно пренебречь, величины А и Г приблизительно равны.
Дата добавления: 2021-01-20; просмотров: 186; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
