Тест по теме «Строение атома углерода»
Электронное строение атома углерода
Электронное строение атома углерода в основном состоянии имеет вид 1s22s22р2, то есть на s-орбитали 1-го энергетического уровня находятся два электрона, на s-орбитали и р-орбиталях 2-го энергетического уровня находятся по два электрона. Следует вспомнить, что орбиталью или электронным облаком называют совокупность положений электрона в атоме, то есть область пространства, в которой наибоее вероятно нахождение электрона. Форма электронной орбитали может быть различна. Из электронной формулы атома углерода видно, что у него две разновидности орбиталей: s и p. s-Орбиталь имеет форму сферы, а p-орбиталь – форму гантели или объемной восьмерки. Электроны заполняют орбитали атома в порядке увеличения энергии. Чем ближе к ядру находится орбиталь, тем меньшую энергию имеет электрон, расположенный на ней.
Строение электронной оболочки атома часто изображают с помощью квантовых ячеек. Каждую орбиталь обозначают квадратиком, электроны – стрелками, указывающими различное направление их спина. Валентность атома определяется главным образом числом неспаренных электронов на внешнем энергетическом уровне. Электронная конфигурация внешнего энергетического уровня атома углерода имеет вид:

В соответствии с приведенной электронно-графической формулой атом углерода может образовать по обменному механизму только две ковалентные связи. Однако в подавляющем большинстве органических соединений углерод четырехвалентен. Это можно объяснить тем, что при образовании химических связей выделяется энергия, достаточная для перехода одного из электронов с 2s-орбитали на вакантную 2p-орбиталь. Принято говорить, что атом углерода перешел в возбужденное состояние.
|
|
|

Таким образом, атом углерода имеет четыре неспаренных электрона и может образовать четыре ковалентные связи. Расположение орбиталей пространстве можно представить следующим образом:

В возбужденном состоянии три р-орбитали расположены перпендикулярно друг другу.
Гибридизация атомных орбиталей
В возбужденном состоянии атом углерода четырехвалентен и может присоединить четыре одновалентных атома, таких, например, как атомы водорода.

Действительно, простейшим органическим соединением является метан CH4. Логично предположить, что в молекуле метана три связи С–Н образованы перекрыванием p-орбиталей атома углерода и s-орбиталей трех атомов водорода, и а четвертая связь – перекрыванием s-орбиталей атомов углерода и водорода. В таком случае одна из связей должна отличаться от остальных по длине и энергии.
Кроме того три связи будут направлены под углом 90° друг к другу (p-электроны), и одна связь, образованную s-электроном, будет направлена произвольным образом, поскольку s-орбиталь имеет осевую симметрию. Однако в действительности это не так! Все связи атома углерода направлены к вершинам правильного тетраэдра и угол между ними составляет 109,5°.
|
|
|
Для объяснения этого факта американский химик Лайнус Полинг предложил теорию гибридизации атомных орбиталей (АО). Согласно этой теории атом углерода не имеет «чистых» s- и p-орбиталей. При образовании химических связей эти орбитали атома углерода усредняются по форме и энергии, превращаясь в четыре новые равноценные орбитали.

Гибридизация – это гипотетический процесс смешения разных орбиталей центрального атома многоатомной молекулы, и образование новых «гибридных» орбиталей, одинаковых по форме и энергии. Образующиеся «гибридные» орбитали имеют форму асимметричной гантели и отличаются от исходных орбиталей атома углерода. Энергия, выделяющаяся при образовании связи с участием гибридных АО, компенсирует затраты энергии на перевод атома углерода из основного состояния в возбужденное и на сам процесс гибридизации. Теория гибридизации объясняет реальное пространственное строение органических молекул.
|
|
|
Для атома углерода возможно три типа гибридизации: sр 3-гибридизация, sр 2-гибридизация, sp-гибридизация
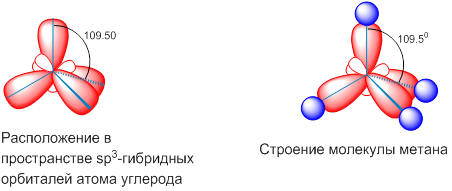
Гибридизация sр3-типа. Первое валентное состояние атома углерода. Строение молекулы метана
sр 3 -Гибридизация – это комбинация (смешение) одной s- и трёх p-орбиталей внешнего энергетического уровня и образование четырех новых sр 3 -орбиталей, имеющих форму объёмной восьмёрки с неравноценными сферами:

Каждая sр 3 -орбиталь имеет точку с нулевой электронной плотностью – узел. У всех четырех орбиталей узлы совпадают – в этом месте находится ядро атома. Гибридные орбитали испытывают взаимное отталкивание и отклоняются друг от друга в пространстве на максимально возможное расстояние. Их оси направлены к вершинам тетраэдра, в центре которого находится атом углерода, а угол между осями равен 109,5о.
Гибридизация sp2-типа. Второе валентное состояние атома углерода. Строение молекулы этилена
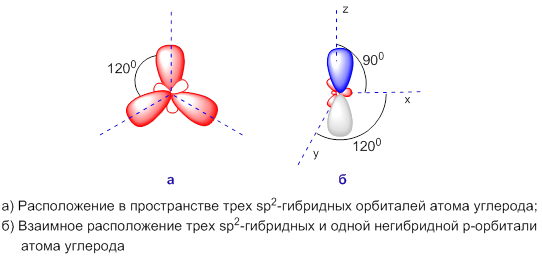
sр 2 -Гибридизация – это тип гибридизации, при котором выравниваются по энергиям одна s-орбиталь и две p-орбитали.

Три гибридные sp2-орбитали расположены в одной плоскости и максимально удалены друг от друга (направлены к вершинам треугольника, угол между ними составляет 120°). Оставшаяся негибридная p-орбиталь расположена в плоскости, перпендикулярной плоскости гибридных орбиталей:
|
|
|
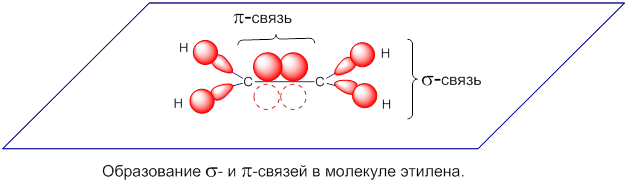
Атом, находящийся в состоянии sp2-гибридизации способен образовывать двойную связь с другим атомом (Y=Х). Одна связь – σ-связь (образована гибридной sp2-орбиталью), вторая связь – π-связь образуется при перекрывании негибридных p-орбиталей
Гибридизация sp-типа. Третье валентное состояние атома углерода. Строение молекулы ацетилена
sр-Гибридизация: взаимодействуют, выравниваясь по форме и энергии только две орбитали атома углерода: одна σ- и одна π. Образуются две новых sр-орбитали и остаются две негибридных p-орбитали:

Гибридные орбитали лежат на одной прямой, угол между их осями равен 180о, оси двух негибридизованных р-орбиталей взаимно перпендикулярны и перпендикулярны осям sp-орбиталей. При перекрывании одной sp‑орбитали и двух негибридных p-орбиталей с орбиталями другого атома образуется тройная связь.

Электронное строение молекулы ацетилена определяет её пространственное строение. Центры всех четырёх атомов лежат на одной прямой, плоскости в которых расположены электронные плотности π-связей взаимно перпендикулярны. Тройная связь содержит одну σ-связь и две π-связи.
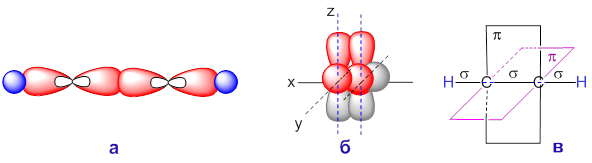
На рисунке показано образование σ-связей (а) и π-связей (б) в молекуле ацетилена, а также взаимное расположение плоскостей π-связей (в).

Модель молекулы ацетилена
Итак, гибридные орбитали атома углерода способны участвовать в образовании только σ-связей, незатронутые гибридизацией р-орбитали образуют только π-связи. Именно этой особенностью определяется пространственное строение молекул органических веществ.
Тест по теме «Строение атома углерода»
1. Изомеры - это …
а) атомы, имеющие одинаковое число протонов, но различное число нейтронов в ядре.
б) вещества, имеющие одинаковый состав, но различное химическое строение.
в) процесс выравнивания орбиталей по форме и энергии.
г) вещества имеющие одинаковое строение и свойства, состав которых отличается на одну или несколько групп СН2.
2. Длина одинарной связи (С-С) равна:
а) 0,154 нм б) 0,120 нм в) 0,134 нм г) 0,180 нм
3. Валентный угол между гибридными орбиталями в состоянии sp3-гибридизации:
а) 1200 б) 109028/ в) 1800 г) 1540
4. Даны формулы.
а) СН4 е) НС=С-СН2-СН3
б) СН3-СН3 ж) СН2=СН-СН=СН2
в) СН2= СН2 з) СН2=С=СН-СН3
г ) НС=СН и) СН2=СН-СН2-СН3
д ) СН3-СН2-СН2-СН3 к) СН2=СН-СН3
1) Выберите гомологи веществу в).
2) Напишите изомеры веществу е).
3) Молекулы каких веществ содержат только сигма-связи?
4) Укажите вещества, содержащие атомы углерода в состоянии sp-гибридизации.
Дата добавления: 2020-12-22; просмотров: 306; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
