Электронная конфигурация атома лития:
Тема 3-4. Распределение электронов в атоме. Атомные орбитали.
Причина периодического изменения свойств химических элементов кроется в строении электронной оболочки. Сущность явления периодичности: свойства элементов повторяются периодически потому, что периодически повторяется число электронов на внешнем энергетическом уровне атома.
Электронная оболочка атома состоит из электронов, распределённых по слоям – энергетическим уровням. Энергетический уровень обозначается латинской буквой n. Число энергетических уровне в атоме элемента равно номеру периода, в котором находится этот элемент. Электроны, наиболее прочно связанные с ядром и обладающие наименьшим запасом энергии, находятся на первом энергетическом уровне (n = 1).
Максимальное число электронов на уровне определяют по формуле
N = 2n2 (где n – номер уровня). На первом уровне (n = 1) могут находиться два электрона (N = 2 ∙ 12 = 2), на втором (n = 2) – восемь электронов
(N = 2 ∙ 22 = 8), на третьем (n = 3) – 18 электронов (N = 2 ∙ 32 = 18), на четвёртом (n = 4) – 32 электрона (N = 2 ∙ 42 = 32).
Орбиталь – это пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона.
Каждый энергетический уровень делится на энергетические подуровни. Число подуровней равно номеру уровня, например, первый уровень состоит из одного подуровня (его называют s-подуровень).
Второй уровень состоит из двух подуровней s -подуровня и p - подуровня.
|
|
|
Третий уровень состоит из трёх подуровней: s -, p - и d -подуровня. Четвёртый уровень состоит из четырёх подуровней: s -, p -, d - и f-подуровня.
Каждый подуровень образован орбиталями, имеющими одинаковую форму и равную энергию. По форме различают s-, p-, d- и f-орбитали.
s-орбитали имеют форму шара, иными словами, электрон, находящийся на такой орбитали (его называют s-электроном), большую часть времени проводит внутри сферы. s-орбиталь, находящуюся на первом энергетическом уровне, обозначают 1s, на втором — 2s и т. д.
р-орбитали имеют форму объемной восьмерки. Они могут быть направлены по одной из трех координатных осей (обозначаются px,py, pz), поэтому на каждом энергетическом уровне (кроме первого, где есть только s-орбиталь) существуют три р-орбитали, обладающие одинаковой энергией.
Формы d- и f-орбиталей намного сложнее. На рисунке видно, что существует 5 форм d-орбиталей и 7 форм f-орбиталей.
На каждой из орбиталей могут размещаться не более двух электронов с противоположными спинами, следовательно, s-подуровень максимально вмещает 2 электрона, p – 6, d – 10, f – 14.
Орбитали одной и той же формы, но находящиеся на разных энергетических уровнях (например, 1s, 2s и 3s-орбитали), отличаются по энергии. Чем больше номер уровня, тем выше энергия орбитали и тем больше ее размер.
|
|
|
В первую очередь электронами заполняются орбитали того подуровня, который характеризуется наименьшей энергией. На одном и том же уровне наименьшей энергией обладает s-орбиталь, далее в порядке увеличения энергии следуют р-, d- и f-орбитали.
Вначале электроны поодиночке заполняют свободные орбитали энергетически выгодного подуровня, и только когда на каждой орбитали уже имеется по одному электрону, начинается их спаривание.
Запись электронной конфигурации атома. Подробные электронные конфигурации атомов изображают несколькими способами:
1) H +1 )1 e – – схема строения атома, отображает распределение электронов по энергетическим уровням.
2) +1 Н 1 s 1 – электронная формула, отображает число электронов по уровням и по орбиталям.
3) +1 Н
| ↑1s |
- электронно-графическая формула – показывает распределение электронов по орбиталям и отображает спин электрона.
Распределение электронов в атомах элементов 1-го периода. Первый энергетический уровень вмещает максимально два электрона. Поэтому первый период состоит лишь из двух элементов – водорода и гелия. Простейший из атомов — водород. Он содержит один электрон, который занимает орбиталь с самой низкой энергией – 1s-орбиталь.
|
|
|
Электронная конфигурация атома водорода:
В атоме гелия первый энергетический уровень полностью завершен:

Элементы, в атомах которых заполняется s-подуровень, называют s-элементами. Водород и гелий - s-элементы.
Распределение электронов в атомах элементов 2-го периода. У элементов второго периода начинается заполнение второго энергетического уровня — он включает восемь электронов (n = 2, N = 8). Второй период содержит восемь элементов. У лития и бериллия заполняется 2s-орбиталь, это s-элементы. С бора начинает заполняться электронами р-подуровень. У неона, элемента, завершающего второй период, первый и второй энергетические уровни оказываются целиком заполненными.
Электронная конфигурация атома лития:

Электронная конфигурация атома бериллия:

Электронная конфигурация и диаграмма атома бора:

Электронная конфигурация атома углерода:

Электронная конфигурация атома неона:
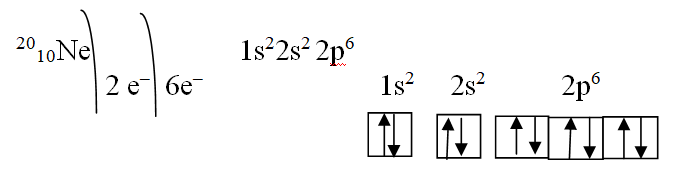
Элементы, в атомах которых заполняется p -подуровень, называют p -элементами. От бора по неон - р-элементы.
|
|
|
Распределение электронов в атомах элементов 3-го периода. В третьем периоде происходит заполнение третьего энергетического уровня. Третий уровень (n = 3) может максимально вмещать 18 электронов. Однако элементов в третьем периоде всего восемь. К концу третьего периода (у аргона) полностью заполняются 3s- и 3p-подуровни, а 3d-подуровень остается пустым, поэтому третий уровень не заполняется до конца. От натрия до аргона заполнение электронами третьего уровня протекает аналогично заполнению второго уровня: заполняется вначале 3s-орбиталь (2 электрона), затем оставшиеся 3р-орбитали (6 электронов). Натрий и магний – это s-элементы, а с алюминия по аргон - р-элементы.
Таким образом, все элементы малых периодов относятся либо к s-, либо к р-элементам.
Дата добавления: 2020-11-29; просмотров: 172; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
