Электрохимическая коррозия металлов
Принцип работы гальванического элемента
Одним из наиболее простых гальванических элементов является медно-цинковый или элемент Даниэля-Якоби, в котором цинковая и медная пластинки погружены в раствор солей ZnSO4 и CuSO4, соединенных проводником (рис. 1). Полуэлементы связаны электролитическим ключом или сообщаются через пористую перегородку. Работа такого гальванического элемента обусловлена протеканием окислительно-восстановительной реакции:
Zn0 + CuSO4 → ZnSO4 + Cu0
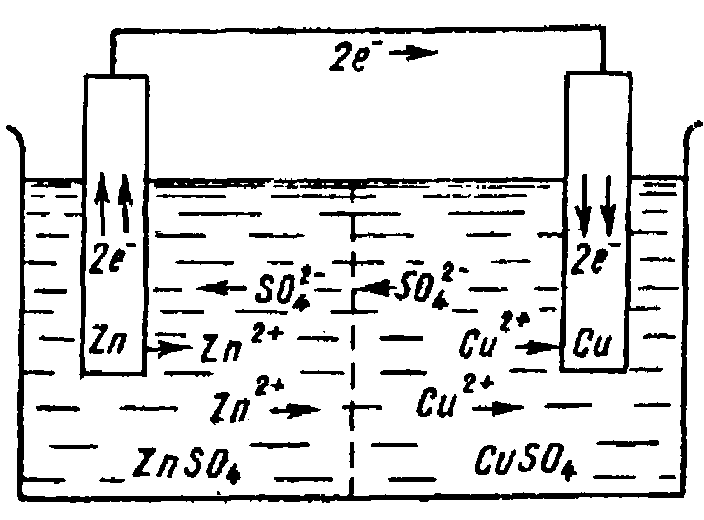
Рис. 1. Схема работы медно-цинкового гальванического элемента
Электрод из цинка (более активного металла) посылает электроны во внешнюю цепь. Атомы цинка окисляются в ионы, цинковый электрод разрушается:
Zn0(т) – 2ē = Zn2+(р-р)
Цинковый электрод, на котором происходит процесс окисления, называется анодом.
На медном электроде идет процесс восстановления. Ионы меди, принимая электроны из внешней цепи, восстанавливаются в атомы, которые осаждаются на электроде:
Сu2+(р-р) + 2ē = Cu0(т)
Медный электрод, на котором протекают процессы восстановления, называют катодом.
Одновременно анионы SO42- из сосуда с CuSO4 через пористую перегородку перемещаются в сосуд с ZnSO4. Электрическая цепь становится замкнутой. Во внешней цепи возникает электрический ток, который можно измерить гальванометром.
Гальванический элемент изображают краткой электрохимической схемой:
|
|
|
(-) Zn | Zn2+ || Cu2+ | Cu (+)
Одна вертикальная черта означает границу раздела фаз «металл – раствор» (гетерогенный процесс), две вертикальные черты – границу между растворами (гомогенный процесс).
Цинковый электрод (анод) – источник электронов – принято считать отрицательным, а медный электрод (катод) – положительным.
Причиной появления и протекания электрического тока в гальванических элементах является разность электродных потенциалов, возникающая на электродах, его электродвижущая сила ЭДС.
ЭДС гальванического элемента определяется как разность потенциалов катода и анода:
| ЭДС = Ек – Еа | (1) |
Стандартную ЭДС можно определить из значений стандартных электродных потенциалов ряда напряжений металлов.

Гальванический элемент будет работать, если рассчитанное значение ЭДС будет больше 0.
Типы электрических цепей
Различают следующие электрические цепи: химические, концентрационные, физические.
В химических цепях электроды выполнены из разных металлов. Этим и обусловлена, в основном, разность электродных потенциалов.
(-) Zn | Zn2+ || Cu2+ | Cu (+)
| ЭДС = Ек – Еа | (1) |
В концентрационных цепях электроды выполнены из одного металла, но погружены в растворы солей разной концентрации.
|
|
|
(-) Al | Al3+ || Al3+ | Al (+)
0,001 М 0,1 М
(-) Al0 – 3ē → Al3+
(+) Al3+ + 3ē → Al0

| (2) |
В физических цепях электроды выполнены из одного металла и погружены в растворы солей одинаковой концентрации, но при разных температурах.

| (3) |
Поляризация и деполяризация
Электродвижущая сила работающего гальванического элемента со временем уменьшается. Это явление называется поляризацией. Поляризацию рассчитывают, как разность потенциалов под током и при отсутствии тока:

| (4) |
где:  – значение поляризации, В;
– значение поляризации, В;  – равновесный электродный потенциал металла без тока, В;
– равновесный электродный потенциал металла без тока, В;  – равновесный электродный потенциал металла под действием тока, В.
– равновесный электродный потенциал металла под действием тока, В.
Поляризацию вызывает изменение потенциалов электродов, происходящее за счет замедления анодного и катодного процессов. В результате на аноде накапливаются ионы металла, его потенциал становится более положительным (анодная поляризация), на катоде накапливается избыток электронов, его потенциал становится более отрицательным (катодная поляризация).
Устранение поляризации называется деполяризацией.
Наибольшее значение имеет катодная поляризация. Для борьбы с ней применяют вещества, называемые катодными деполяризаторами. Обычно это окислители, которые принимают электроны от катода, препятствуя его поляризации (K2Cr2О7, MnO2 и т.д.).
|
|
|
Поляризацию можно наблюдать, если следить за работой элемента Вольта (рис. 4). Со временем его ЭДС уменьшится почти до нуля. Явление поляризации в этом случае вызвано, в основном, насыщением поверхности медного электрода водородом. Образуется своеобразный «водородный электрод», потенциал которого гораздо меньше, чем у медного электрода.
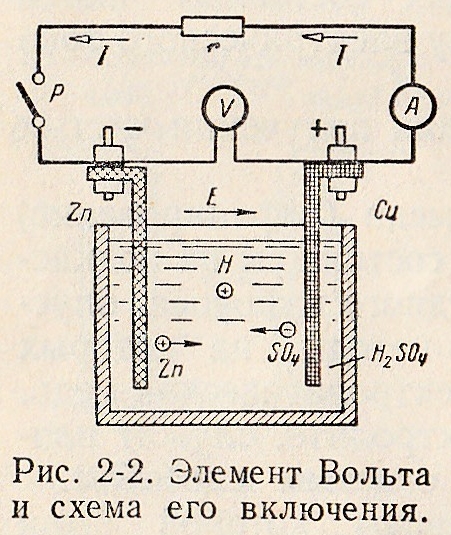
Рис. 2. Элемент Вольта
Zn + H2SO4 = ZnSO4 + H2↑
(-) Zn0 – 2ē = Zn2+
(+) 2Н+ + 2ē = Н20
Для устранения поляризации можно внести в качестве деполяризатора K2Cr2О7. Электродвижущая сила элемента резко возрастает за счет протекания реакции:
K2Cr2О7+ 3Н2 + 4H2SO4 = Cr2(SO4)3+ K2SO4+ 7H2O
Коррозия металлов
Коррозия – это самопроизвольно протекающий процесс разрушения поверхности металлов под действием агрессивной окружающей среды. Различают два основных случая коррозии металлов.
Газовая коррозия металлов
Газовая, химическая коррозия протекает при повышенных температурах, когда конденсация влаги на металлической поверхности невозможна, т.е. происходит безтоковое окисление металла.
|
|
|
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов протекает при наличии влаги, сопровождается возникновением тока в системе, с разделением общего процесса на два сопряженных, невозможных друг без друга – анодный и катодный.
| (-) А: Ме0 – nē → Меn+ | (5) |
| (+) К: 2Н+ + 2ē → Н20 при рН < 7 (кислая среда) или (+) К: О2 + 4ē + 4Н+ → 2Н2О при рН ≥ 7 (щелочная и нейтральная среда) | (6) (7) |
Анодный процесс – окисление, разрушение металла; катодный – восстановление ионов или молекул, называемых деполяризаторами, в зависимости от рН среды. В нейтральных и щелочных средах деполяризатором является кислород, в кислой среде катион водорода. Весь материальный эффект электрохимической коррозии сосредоточен на аноде.
Количество окислившегося металла на анодных участках при электрохимической коррозии можно рассчитать, используя 1 закон Фарадея: количество вещества, выделяющееся на электродах при прохождении постоянного электрического тока через систему, прямо пропорционально силе тока и времени его прохождения:

| (8) |
где: m – количество вещества, выделяющееся на электродах, г; I – сила тока, А; τ – время процесса коррозии, с; Э – электрохимическая эквивалентная масса, г/моль; F – число Фарадея (96500 Кл/моль).
Дата добавления: 2020-11-29; просмотров: 116; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
