Галогены – химически активные соединения, их активность уменьшается от фтора к йоду.
Галогены
Галогены – это элементы VII A группы главной подгруппы. К ним относятся: фтор, хлор, бром, йод и астат, который очень редко встречается в природе.

Все эти элементы являются типичными неметаллами. Галогены, означает «рождающие соли».

Так как это элементы VII A группы, значит на внешнем энергетическом уровне у них семь электронов. До завершения уровня им не хватает одного электрона, поэтому они берут этот недостающий электрон у атомов металлов, при этом образуется ионное соединение – соль, где степень окисления галогена -1.

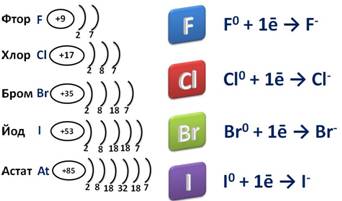
Галогены – сильные окислители, самый сильный из них фтор, который может быть только окислителем и проявлять степень окисления -1.

Остальные галогены могут проявлять и восстановительные свойства при взаимодействии с более электроотрицательным элементом – фтором, кислородом или азотом. Поэтому для них возможны степени окисления +1, +3, +5, +7. Так, в соединении HClO степень окисления хлора +1, в соединении HBrO2 степень окисления брома +3, в соединении BrF5 степень окисления брома +5, в соединении H5IO6 степень окисления йода +7.

В группе сверху вниз – от фтора к йоду – радиус атома увеличивается, поэтому усиливаются восстановительные и металлические свойства.

Все галогены представляют собой двухатомные молекулы, связь между атомами – ковалентная полярная. Все галогены имеют молекулярную кристаллическую решётку.
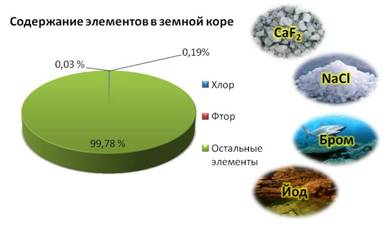
Галогены в природе существуют только в виде соединений с другими элементами. Наиболее распространены хлор и фтор, их содержание составляет 0,19% и 0,03% от массы земной коры.
|
|
|
Например, фтор входит в соcтав плавикового шпата, хлор входит в состав каменной соли, бром содержится в морской воде, а йод в подземных буровых водах.
Рассмотрим таблицу, в которой отражены физические свойства галогенов. Фтор является светло-жёлтым газом, хлор – жёлто-зелёный газ, бром – бурая жидкость, а йод – твёрдое вещество чёрно-серого цвета.




| Вещест -во | Агрегат-ное состоя-ние при н.у. | Цвет | Плот-ность, г/см3 | Температура плавления, 0С | Температура кипения, 0С |
| Фтор F2 | Газ | Светло-жёлтый | 0,0017 | -220 | -188 |
| Хлор Cl2 | Газ | Жёлто-зелёный | 0,0032 | -101 | -34 |
| Бром Br2 | Жидкость | Буровато-коричневый | 3,1 | -7 | +58 |
| Йод I2 | Твёрдое вещество | Чёрно-серый (пары фиолетовые) | 4,9 | +114 | +186 |
Из таблицы видно, что с ростом молекулярной массы увеличиваются температуры кипения и плавления галогенов, их плотность. Это связано, прежде всего, с увеличением размеров атомов и молекул, а, следовательно, и силами межмолекулярного взаимодействия. От фтора к йоду усиливается интенсивность окраски галогенов, а у кристаллов йода появляется металлический блеск.
|
|
|
Галогены – химически активные соединения, их активность уменьшается от фтора к йоду.

Фтор самый активный галоген, который при нагревании реагирует даже с золотом, серебром и платиной. Алюминий и цинк в атмосфере фтора воспламеняются. Так, в реакции цинка с фтором образуется фторид цинка. Цинк повышает свою степень окисления с 0 до +2, а фтор, наоборот, понижает степень окисления с 0 до -1. Атом цинка отдаёт по два электрона молекуле фтора. Цинк является восстановителем, а фтор – окислителем.

Остальные галогены реагируют с металлами в основном только при нагревании. Нагретый порошок железа загорается при взаимодействии с хлором. В результате этого взаимодействия образуется хлорид железа три. Железо повышает свою степень окисления с 0 до +3, а хлор понижает свою степень окисления с 0 до -1. При этом каждый атом железа отдаёт по 3 электрона молекуле хлора. Железо окисляется и является восстановителем, а хлор восстанавливается и является окислителем.

Медная проволока также сгорает в парах брома. При этом образуется бромид меди два. Медь повышает свою степень окисления с 0 до +2, а бром понижает свою степень окисления с 0 до -1. Каждый атом меди отдаёт по 2 электрона молекуле брома. Медь – восстановитель, а бром – окислитель.
|
|
|

Йод реагирует с алюминием, катализатором в этой реакции является вода. Алюминий повышает свою степень окисления с 0 до +3, а йод понижает свою степень окисления с 0 до -1. Каждый атом алюминия отдаёт по 3 электрона молекуле йода. Алюминий является восстановителем, а йод – окислителем. В результате этого взаимодействия образуется йодид алюминия.

Галогены также вытесняют друг друга из солей. Так, более активный галоген вытесняет из раствора соли менее активный.
Например, хлор вытесняет бром из раствора его соли, потому что хлор более активный галоген, чем бром. Хлор в данной реакции понижает свою степень окисления с 0 до -1, а бром повышает с -1 до 0. В результате чего, каждый бром отдаёт по 2 электрона молекуле хлора. Образуется новая соль – хлорид натрия и молекулярный бром. Хлор является окислителем, а бром – восстановителем.

Бром вытесняет йод из раствора йодида калия. В этой реакции бром понижает свою степень окисления с 0 до -1, а йод повышает свою степень окисления с -1 до 0. При этом 2 электрона от йода переходят к молекуле брома. В результате взаимодействия образуется соль – бромид калия и простое вещество – йод. Бром является окислителем, а йод – восстановителем.
|
|
|

Дата добавления: 2020-11-29; просмотров: 447; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
